小麦新种质CH09W83为八倍体小偃麦TAI7047与高感小麦品种晋太170杂交、回交后代衍生而来的高代选系, 在苗期免疫或高抗我国白粉病菌株E09、E20、E21、E23、E26、Bg1和Bg2。为定位CH09W83中的抗病基因, 将CH09W83与感病亲本杂交和回交, 通过对F1、F2、F2:3和BC1代的接种鉴定和遗传分析, 证实CH09W83成株期对E09的抗性由1对隐性核基因控制, 暂命名为
Wheat introgression line CH09W83 is immune or highly resistant to wheat powdery mildew caused by
由 Blumeria graminisf. sp. tritici ( Bgt)引起的小麦白粉病是世界各小麦产区的主要病害之一, 随着小麦品种矮化、种植密度加大和生产条件的改善, 小麦白粉病危害日趋严重。培育和推广抗病品种是控制该病害的主要手段, 为应对由于生产品种抗源的单一化造成新 Bgt菌株出现和流行及原抗病品种“丧失”抗性问题[ 1], 育种家们需要不断挖掘新的抗源基因。迄今为止, 国内外已在小麦基因组的43个位点( Pm1~ Pm47、 Pm18 = Pm1c、 Pm22 = Pm1e、 Pm23 = Pm4c、 Pm31 = Pm21)鉴定出60多个抗白粉病基因[ 2]。在这些抗病基因中除28个来自普通小麦外, 其余均源于小麦的野生近缘种属[ 3]。
在已正式命名的抗白粉病基因中, 只有为数不多的几个基因成功应用于小麦育种和生产, 如 Pm2、 Pm4a、 Pm8、 Pm21和 Pm2+Pm6。然而, 携带这些基因的抗病品种在大面积推广后, 常因流行病原菌株的变化而丧失抗性, 使小麦生产招致重大损失, 例如20世纪80年代 Pm8丧失抗性, Pm4a正在成为无效抗病基因。 Pm21对我国及欧洲的120个菌系或小种均具有良好抗性[ 4], 且抗性最稳定, 但该基因的广泛利用也可能诱导病菌菌株加速变异, 导致新致病型的提早出现。因此, 抗病新基因的持续开发和鉴定是非常必要的。中间偃麦草( Thinopyrum intermedium, 2 n= 42, JJJsJsStSt)是多年生小麦野生近缘植物, 遗传基础丰富、抗逆性强, 对小麦白粉病、条锈、叶锈、秆锈、黄矮、根腐和赤霉病表现免疫或高抗, 并且在偃麦草属中最先与小麦杂交成功, 其中一些抗病基因已被广泛应用于小麦抗病性的遗传改良[ 5, 6]。同时, 从普通小麦与中间偃麦草的杂交后代中已获得抗白粉病的小偃麦异附加系、异代换系、易位系[ 7, 8]。近几年, He等[ 9]和Luo等[ 10]分别从感病的小麦品种与八倍体小偃麦TAI7045、TAI7047杂交的后代中选育出对白粉病免疫的育种新材料, 并利用分子标记将其抗性基因定位在小麦染色体的2DL和7BS上。
CH09W83是感白粉病的普通小麦品种“晋太170”与八倍体小偃麦TAI7047杂交、回交后代的高代品系, 经温室接种鉴定, 对白粉病表现免疫, 但尚不清楚该品系对白粉病的抗性机制。本研究旨在通过遗传分析、原位杂交及分子标记定位, 确定CH09W83所含外源染色体片段的大小及其抗白粉病基因所在的染色体位置, 为更好地利用该抗源种质提供理论依据。
苗期抗性鉴定材料包括中间偃麦草、八倍体小偃麦TAI7047 (太原768/中间偃麦草Z1141//晋春5号)及其小麦亲本、CH09W83 (晋太170/TAI7047//*2晋太170, BC2F5)及其小麦亲本, 感病对照为京双16。台长29/CH09W83、CH09W83/晋太170组合的F1、F2、BC1群体及F2:3代家系用于抗病性遗传分析和抗病基因标记定位。中国春缺体-四体和双端体材料由美国堪萨斯州立大学小麦遗传资源中心提供。用于细胞学鉴定的材料包括CH09W83、台长29/CH09W83杂种F1、中国春和中间偃麦草。
苗期抗性鉴定所用白粉病菌株为E09、E20、E21、E23、E26、Bg1和Bg2, 成株期抗性遗传分析所用白粉菌株为E09, 均由中国农业科学院植物保护研究所段霞瑜研究员提供, 在本实验室保存。
植物材料在温室中生长, 选取叶枕距为3~4 cm的幼穗, 用卡诺II (无水乙醇、氯仿、冰醋酸体积比为6∶3∶1)固定液固定, 挑取处于减数分裂中期I至四分体时期的花药, 用1%醋酸洋红解剖制片, 改良苯酚品红复染, 酒精灯微烤后压片观察记录其染色体配对构型。
种子在垫有湿滤纸的培养皿中置22℃培养箱中萌发, 待根长1~2 cm时剪取根尖, 在冰水中预处理22~24 h后用卡诺氏固定液(无水乙醇、冰醋酸体积比为3∶1)固定至少24 h, 45%醋酸中压片, 液氮冷冻揭片, -80℃超低温冰箱保存备用。参照Chang等[ 11]描述的程序略作修改, 进行荧光原位杂交(GISH)。用缺刻平移法标记Fluorescent-12-dUTP的中间偃麦草基因组总DNA以其为探针, 用普通小麦中国春(CS)基因组DNA为封阻; 杂交液中探针、封阻DNA的浓度比率为1∶120, 用碘化丙锭(PI)套染杂交后的载玻片, 用抗退色剂(antifading agent)封片, 在装有CCD相机的徕卡RA-2型荧光显微镜(Leica Microsystems, 德国)下观察杂交信号并拍照。
1.4.1 成株期鉴定 2011年在温室内, 对台长29/CH09W83的F1、F2群体和F2:3代家系, 以及CH09W83/晋太170的F1和BC1群体接种北京地区流行的白粉病菌株E09, 鉴定成株期抗性。E09对台长29和晋太170有毒力, 而对CH09W83无毒力。11月上旬单粒播种供试材料, 行长1.2 m, 行宽25 cm, 每隔10行设置一行感病对照(京双16), 每隔15行设置一行诱发材料(SY95-71)。从拔节期开始, 在感病对照和诱发材料上接种E09。当病菌大量繁殖后, 采集菌种抖洒在待鉴定材料叶片上, 同时借助诱发行进行诱发感染。按叶部病害0~9级法进行抗病性分级, 于小麦抽穗期和开花期各调查一次, 以发病最重的一次作为最终抗性评价依据。其中0级为免疫, 0;级为近免疫, 1~2级为高抗, 3~4级为中抗, 5~6级为中感, 7~8级为高感, 9级为极感[ 12]。
1.4.2 苗期鉴定 将野生亲本中间偃麦草、CH09W83、TAI7047及各小麦亲本分别播于纸杯内, 放在长70 cm、宽50 cm、高20 cm的塑料盒内, 其上套铁丝架撑开的透明塑料袋隔离以防污染, 室内自然光照, 温度15~22℃。待第1片叶完全展开后, 用扫拂法充分接种白粉菌菌株E09、E20、E21、E23、E26、Bg1和Bg2的分生孢子, 一个塑料盒接种一个菌株。7~10 d后当感病对照京双16充分发病时, 采用0~4级标准调查第1片叶的反应型[ 13]。0级为免疫, 无可见病斑; 0;级为近免疫, 有过敏性坏死斑; 1、2、3和4级分别代表高抗、抗、感和高感类型。
按照SDS法[ 14]从台长29/CH09W83的F2单株及亲本叶片中提取基因组总DNA; 采用分离群体分组分析法(bulked segregant analysis, BSA)在F2群体中随机选取10株抗病植株和10株感病植株, 分别将其DNA等量混合建立抗病池和感病池。
根据GrainGenes (http://www.wheat.pw.usda.gov/)公布的引物序列, 选取569对GWM、WMC、BARC、CFD、CFA和GDM系列的SSR引物在抗、感材料间进行多态性筛选。根据初筛结果, 在多态性引物所在染色体上增补89对SSR引物(除上述系列外, 还包括GPW系列)进行目标基因的连锁分析。
PCR反应总体系为20 μL, 含2 μL 10× buffer (10 mmol L-1 Tris-HCl, pH 8.3, 50 mmol L-1 KCl, 1.5 mmol L-1 MgCl2)、0.2 mmol L-1 dNTP、1 U Taq酶、0.25 μmol L-1引物(由北京华大基因公司合成)和80~100 ng模板DNA。反应扩增程序为94℃变性5 min; 接着94℃变性45 s, 50、55或60℃(因引物不同而异)复性45 s, 72℃延伸1 min, 共35个循环; 最后72℃延伸10 min, 4℃保存备用。在PTC-200型热循环仪(MJ Research, 美国)上进行PCR反应。
在扩增后的反应体系中加入等体积的loading buffer (含0.4 g mL-1蔗糖、1 mg mL-1溴酚蓝和1 mg mL-1二甲苯腈蓝FF)充分混匀, 每个样品取4~6 μL在8%非变性聚丙烯酰胺凝胶(Acr与Bis重量比为29︰1)中恒定电压150 V下电泳2 h左右, 硝酸银染色显影。
用SAS8.0作卡方适合性检测, 用MapmakerExp 3.0计算抗白粉病基因与分子标记之间的遗传距离, 用MapDraw V2.1绘制连锁图[ 15]。根据已发表的分子标记连锁图谱和所选连锁分子标记在中国春缺体-四体、双端体DNA上的PCR扩增带型, 将抗白粉病基因及其连锁的分子标记定位于相应的染色体臂上。
苗期鉴定表明, 野生亲本中间偃麦草和TAI7047对所有菌株表现免疫(IT=0)或近免疫(IT=0;); CH09 W83对E09、E21、E23、E26、Bg1表现为免疫(IT=0)或近免疫(IT=0;), 对E20、Bg2分别表现为高抗(IT=1)和中抗(IT=2); 而TAI7047和CH09W83的3个小麦亲本晋春5号、太原768、晋太170均感白粉病 (IT = 3~4) (表1)。因此, 推测CH09W83的抗白粉病基因可能来源于八倍体小偃麦TAI7047及野生亲本中间偃麦草。
| 表1 供试材料对7个小麦白粉病菌株的抗性反应 Table 1 Seedling infection types in selected donor lines, parents, and controls to seven Bgt pathotypes |
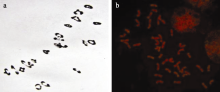
利用改良的苯酚品红复染压片法对CH09W83及其与“台长29”F1杂种的花粉母细胞减数分裂中期I (PMC MI)染色体构型的观察表明, 在所观察的103个花粉母细胞中, 90.3%的细胞其减数分裂中期I具有21个二价体(图1-a)。同时, 在四分体时期既未观察到微核, 也未发现后期I有落后染色体或者染色体提早分离的现象。这说明CH09W83与小麦染色体配对正常, 在细胞学上具有良好的遗传稳定性。以中间偃麦草基因组DNA为探针, 中国春基因组DNA 为封阻的基因组原位杂交(GISH)观察到42条均呈现红色的完整染色体, 并未发现黄绿色的中间偃麦草染色体或片段(图1-b)。这表明CH09W83可能是一个小麦-中间偃麦草的隐形异源渗入系, 它所含的偃麦草染色体片段可能很小, 采用目前的细胞学技术还无法观察其外源染色质。
为了分析CH09W83对白粉病成株抗性的遗传, 对F1植株、F2、BC1分离群体及其亲本接种白粉病菌株E09, 所有F1植株均高感白粉病, 且具有与其感病亲本台长29相似的侵染型(IT=7~9), 说明CH09W83对白粉病的抗性是隐性的。来自该组合的138个F2植株中, 抗病(免疫、近免疫、高抗和中抗)个体为32株, 感病(高感和极感)个体为106株, 抗、感分离比符合1∶3 (表2)。为证实这一结果并确定F2植株的基因型, 对上述F2植株产生的F2:3家系接种同一白粉病菌株E09。结果所有IT为0~2的F2抗病单株产生的F2:3家系均为纯合抗病; IT为5~6的F2单株产生的F2:3家系均产生抗性分离; 而IT为7~8的97个F2高感植株所产生的F2:3家系中, 有59个发生抗性分离, 38个为纯合感病; IT为9的6个F2极感植株中, 其1个F3家系为纯合感病, 1个F3家系发生抗性分离。纯合抗病和感病株分别为32和39, 抗性分离株为62, 符合1∶2∶1; CH09W83与晋太170衍生的BC1代, 其抗性分离符合1∶1 (表2)。综合上述结果, 证明CH09W83对白粉菌E09菌株的成株抗性 是由1对隐性核基因控制, 暂将其命名为 pmCH83。
| 表2 小麦感×抗杂交后代不同群体对白粉病菌株E09的成株期抗性分离 Table 2 Segregation of resistance to Bgt isolate E09 in different populations derived from susceptible × resistant parents in wheat |
569对SSR引物中, 152对(占26.7%)在亲本CH09W83和台长29间存在多态性, 但只有 Xgwm251和 Xwmc652在抗感亲本及抗感池间呈现多态性(图2)。由于 Xgwm251和 Xwmc652均被定位在小麦4B染色体上[ 16], 从4B染色体上又选择了89对SSR引物进行检测, 结果发现多态性标记 Xgpw7272和 Xgwm193与抗病基因连锁(图2)。将上述连锁标记用来检测台长29/CH09W83 F2群体的133个单株及F2:3家系, 证实这4个标记与抗白粉病基因 pmCH83存在遗传连锁关系, pmCH83的两侧临近标记是 Xgwm251和 Xwmc652, 遗传距离分别为4.3 cM和3.8 cM (图3-A), 且4个连锁标记呈共显性遗传,在F2群体中其带型比例符合1∶2∶1的分离模式(结果未显示)。
与 pmCH83连锁的4个SSR位于小麦4BL染色体[ 16], 其中 Xgwm251同时位于4BL和4DL上(http://wheat.
pw.usda.gov/cgi-bin/graingenes); Xgwm193又被定位在4BS上。根据连锁分析, 将该抗病基因初步定位在4B染色体。利用中国春小麦的缺体-四体系和端体系进一步验证 pmCH83的染色体定位结果, 发现 Xgwm251、 Xgpw7272、 Xwmc652和 Xgwm193在中国春N4AT4B、N4DT4B中扩增出预期条带, 但在中国春N4BT4A和Dt4BS中无目标产物, 证实与 pmCH83连锁的SSR标记位于4BL上(图3-B)。
CH09W83是我们从普通小麦与八倍体小偃麦TAI7047杂交、回交后代中选育出的高代品系。本研究抗性鉴定采用的7个白粉病菌株中, E09对抗病基因 Pm1、 Pm3a、 Pm3c、 Pm5、 Pm7、 Pm8、 Pm17和 Pm19有毒力; Bg1对抗病基因 Pm1a、Pm3、Pm5a、Pm6、Pm7、Pm8、Pm11、Pm14和 Pm19有毒力; Bg2对抗病基因 Pm3、Pm5a、Pm6、Pm7、Pm8、Pm11、Pm14和 Pm19有毒力; E20和E21是我国目前毒性较强的小种, 对包括 Pm4a、 Pm4b、 Pm1和 PmPS5A在内的大多数抗病基因有毒力; E23对抗病基因 Pm1a、Pm3、Pm5a、Pm6、Pm7、Pm8、Pm14和 Pm17有毒力; E26对 Pm4b、 Pm4a和 PmPS5A有毒力[ 17, 18]。接种鉴定表明, CH09W83对这7个菌株均表现免疫, 因此可作为一个白粉病新抗源用于小麦育种实践。CH09 W83与TAI7047及TAI7047野生亲本中间偃麦草具有相似的侵染型, 而其所有小麦亲本均高感白粉 病, 说明该品系对白粉病菌株E09的成株期抗性可能来自中间偃麦草(表1), 且由1对隐性核基因控制(表2)。
异源六倍体中间偃麦草的染色体组型为JJJsJsStSt[ 6], 它免疫白粉、条锈等多种小麦真菌病害[ 5, 11]。在源于中间偃麦草(居群号Z1141)的所有八倍体小偃麦中, 小偃78829是目前唯一含有完整St组染色体的八倍体类型[ 19], 但它对小麦白粉病高度感染, 这说明中间偃麦草的St组染色体上可能不含抗白粉病基因。Liu等[ 8]从普通小麦与中间偃麦草杂交后代中获得对小麦白粉病免疫的异代换系, 结合GISH分析发现中间偃麦草的一对J组染色体携有一个新的抗白粉病基因。本研究中, CH09W83是以TAI7047为抗病亲本与普通小麦杂交、回交选育的高代品系。TAI7047是一个八倍体新类型, 其外源基因组的染色体由2对St组染色体、4对Js组染色体和1对St-Js臂间易位染色体构成, 并不含有J组染色体[ 20]。据此推断, 抗白粉病基因 pmCH83可能来自中间偃麦草的Js组染色体, 其来源不同于林小虎等[ 7]和刘树兵等[ 8]报道的来自J组染色体上的抗白粉病基因。此外, 为证实抗性基因的来源, 本研究还利用4个连锁的SSR标记引物对中间偃麦草、TAI7047以及相应的小麦亲本进行了PCR扩增。结果这些引物在抗病亲本TAI7047中扩增出与CH09W83相一致的DNA片段, 而在小麦亲本晋春5号、太原768和晋太170中, 扩增出来的DNA片段则与台长29一致(图2), 这也说明抗白粉病基因可能来自中间偃麦草。但由于这些引物未能在野生亲本中间偃麦草中扩增出特异的DNA片段。因此, pmCH83的来源还需进一步证实。
利用染色体易位是导入近缘物种的有益基因, 创造小麦新种质或培育新品种的重要途径。但如果易位染色体片段过长, 往往会因目标基因与不良基因的连锁累赘(linkage drag)及细胞学稳定性差而大大降低其育种价值[ 21]。CH09W83是通过感病品种与八倍体小偃麦杂交、回交选育而成, 其性状稳定, 各遗传群体的抗病基因均能按照孟德尔遗传定律正常分离。细胞学观察表明CH09W83与普通小麦杂种F1的同源染色体能正常配对(图1-a)。并且用中间偃麦草基因组作探针也未检测到原位杂交信号(图1-b), 说明CH09W83不可能含有较大的外源染色体片段。由于GISH方法能够检出的最小片段约为50~100 Mb, 再小的片段则无法检测[ 22], 因此CH09W83可能是一个携带偃麦草抗白粉病基因的隐形异源渗入系(cryptic alien introgression)。事实上, 这种用现有的细胞学手段和有限的分子标记无法检测的隐形异源渗入系已有报道[ 23, 24]。中间偃麦草的J或Js基因组与小麦之间能发生高水平的染色体配对[ 25], 表明其J/Js组与小麦染色体存在一定的同源性; 因而在以八倍体小偃麦为桥梁导入外源基因的过程中, 这种高水平的异源染色体配对、再加之偃麦草染色体携带的促配基因[ 26], 使载有目的基因的J/Js组染色体更容易与相应的小麦部分同源染色体发生交换和重组, 并使重组后的染色体在结构上更接近于小麦, 这可能是抗白粉病隐形外源渗入系CH09W83产生的机制之一, 同时也可能是荧光原位杂交难以检测其外源DNA杂交信号的主要原因。分子标记分析表明, pmCH83与SSR标记 Xgwm193、 Xgwm251、 Xwmc652和 Xgpw7272连锁, 从遗传距离看, 似乎没有大片段外源染色体存在而导致的重组抑制现象。这暗示中间偃麦草的外源染色体片段可能不会太长。
迄今, 已在除3D、4A、4B、4D外的17条小麦染色体、45个位点上鉴定出65个抗白粉病的等位基因。其中, 只有 pm5 (7BL)、 pm9 (7AL)、 pm26 (2BS)、 mlRD30 (7AL)、 pm2026 (5AmL)、 pm42 (2BS)[ 27]和 pm47[ 2]为隐性抗白粉基因位点。而且在所有已报道的抗白粉病基因中, 只有 Pm40和 Pm43来自中间偃麦草。 Pm40位于7BS[ 10], 而 Pm43位于2DL[ 9]。本研究利用SSR标记, 已将 pmCH83初步定位在小麦染色体4BL上。由于在4BL上尚未发现其他抗白粉病基因存在, 同时, CH09W83对上述7个白粉病菌株的侵染型及抗谱也与 Pm43、特别是 Pm40的载体品系各不相同(表1)。因此, 我们推断 pmCH83极可能是一个新的抗白粉病基因位点。 pmCH83对我国北方麦区的流行菌株抗谱很广, 已知抗E09、E23、E26、Bg1、Bg2和强毒力菌株E20、E21, 但由于单基因遗传行为及其所具有的垂直抗性极有可能被以后新的致病类型所克服, 因此建议在利用 pmCH83时应考虑与其他有效抗病基因相结合, 以便延长该基因资源的使用寿命。
小麦新种质CH09W83可能是一个小麦与中间偃麦草的隐形异源渗入系, 其对白粉病菌的抗性来自中间偃麦草, 且受1对隐性核基因 pmCH83控制。该基因被初步定位在小麦4BL染色体上, 位于SSR标记 Xwmc652和 Xgwm251之间, 遗传距离分别为3.8 cM和4.3 cM。这些结果为 pmCH83的分子标记辅助选择和精细定位奠定了基础。
致谢: 山西省农业科学院植物保护研究所原宗英研究员对抗性鉴定给予大力帮助和指导, 谨致谢忱。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|





 Synthetic
Synthetic ×
×