NAC转录因子是具有多种生物功能的植物特异转录调控因子, 在植物生长发育、器官建成、激素调节和抵抗逆境等方面发挥着重要的作用。我们已分离得到一个受干旱、盐、冷等非生物逆境胁迫和植物激素ABA诱导显著上调表达的玉米NAC家族成员
NAC proteins, which are important regulatory factors, have received much attention for their biological functions in abiotic stress adaptations and tolerances, as well as in the plant metabolic processes under biotic stress and in development. Previously, we have isolated a stress-induced NAC gene, designed
干旱、盐碱等非生物逆境胁迫时常严重影响植物的正常生长发育, 也是导致农作物减产的重要环境因素[ 1]。植物在长期的进化过程中, 在分子、细胞和生理生化水平上均已形成应对外界不良环境的一系列应答机制[ 2]。研究表明, 相对于单一功能基因, 起承上启下作用的转录因子在应答非生物逆境胁迫过程中发挥着更为重要的作用[ 3]。过表达一些转录因子基因能通过调控众多胁迫相关基因的表达来提高植物的抗逆性[ 4, 5, 6]。因此, 深入解析与抗逆相关的转录因子的生物学功能及其作用机制, 将有助于更加深入地阐释植物抗逆机制, 为作物抗逆性分子育种奠定基础。
NAC 的命名来自矮牵牛NAM (NO APICAL MERIST EM)、拟南芥ATAF1/2和CUC2基因的首字母, 它是近年来发现的植物中所特有的一类转录调控因子[ 7, 8]。该家族基因所编码的蛋白质在N端有一个约150个氨基酸左右的保守序列, 将此类的保守结构域命名为NAC结构域(包含一个功能性的核酸定位信号和约60个氨基酸组成的DNA结合域), 又可划分为5个子结构域(A~E), 其中子结构域A、C和D高度保守, B和E保守性不强; C末端则被认为是具有高度多样性的转录激活区域, 其共同特征是富含丝氨酸、苏氨酸、脯氨酸和谷氨酸以及酸性氨基酸[ 9]。NAC家族成员广泛存在于植物中, 水稻和拟南芥中至少分别存在151和117个NAC家族成员, 另外, 葡萄有79个、杨树有163个、大豆和烟草各有152个家族员[ 10, 11]。
NAC家族成员除参与植物生长发育、激素调节等重要生理过程之外, 许多成员还参与植物非生物和生物胁迫应答, 在植物对外界的适应过程中发挥重要作用[ 1]。全基因组转录谱分析表明, 约20%~ 25% NAC基因在胁迫应答过程中发挥重要作用[ 10]。例如, 拟南芥中 NTL4基因与干旱诱导下叶片衰老和活性氧的产生有关, 其突变株系 ntl4的叶片衰老得以延缓且其突变植株的抗旱能力显著提高[ 12]。水稻 ONAC045基因受干旱、盐和冷胁迫诱导表达上调, ONAC045过表达转基因水稻显著提高抗旱和耐盐性[ 13]。 OsNAC5基因编码的蛋白是ABA依赖型信号通路上的一个重要转录调控因子, 在提高植物抗旱、耐盐性和应答生物逆境胁迫过程性中均发挥着重要作用[ 14]。大豆中存在两个受干旱、盐、冷和ABA诱导表达上调的NAC家族成员, 分别是 GmNAC20和 GmNAC11, 其过表达转基因株系通过调控 DREBs和其他胁迫相关基因来控制侧根发育, 从而提高植株的耐盐性[ 15]。
目前在模式植物如拟南芥和水稻中的 NAC基因与植物抗逆性关系研究方面已经取得了重要进展, 但是在玉米中与逆境胁迫相关的NAC基因的研究还报道较少。之前本实验室从玉米自交系“CN165”中分离到了一个受干旱、盐、冷和ABA诱导表达上调的玉米NAC家族成员 ZmSNAC1, 过表达 ZmSNAC1能显著提高转基因株系在苗期的耐脱水性[ 16], 但其在生殖生长发育时期(拟南芥生长约35 d, 开始抽薹)的抗逆性尚不清楚。本研究进一步对 ZmSNAC1过表达转基因株系在生殖生长发育时期的抗旱和耐盐性进行了功能验证, 证实 ZmSNAC1在植物应答非生物逆境胁迫与提高植物抗逆性中发挥着重要作用。
设计带有酶切位点的引物 ZmSNAC1-Nco I -FP: 5-TTTCCATGGGTCTGCCGATGAG-3和 ZmSNAC1- BstE II -RP: 5-TTTGGTGACCCAGCTCAGAACTGT CCCAAC-3, 以ZmSNAC1-PMD18T载体质粒为模板, 进行PCR扩增得到 ZmSNAC1带有酶切位点的片段, 扩增程序为95℃ 5 min; 95℃ 40 s, 58℃ 40 s, 72℃ 90 s, 扩增40个循环; 72℃ 10 min。将扩增产物回收并连接PMD18-T载体后测序, 选取测序正确的克隆提取质粒, 采用限制性内切酶(NEB) Nco I和 BstE II进行分步双酶切, 并用T4连接酶连接 ZmSNAC1和pCambia3301双酶切片段, 得到pCAM BIA3301-35S:: ZmSNAC1植物重组表达载体。
以构建好的植物表达载体转化根癌农杆菌( Agrobacterium tumefaciens) GV3101, 选取PCR鉴定阳性的农杆菌菌液, 采用蘸花法转化拟南芥(Col-0)。在含有7.5 mg L-1除草剂的MS培养基上筛 选阳性转基因株系, 提取转基因拟南芥DNA进行转基因株系的分子鉴定, 单株收取T1代种子, 并将其播于含有7.5 mg L-1除草剂的固体培养基上分离、鉴定, 单株收种, 之后继续按照同样方法基于抗除草剂表现筛选出T3代转基因纯合株系。
用0.5%次氯酸钠和75%乙醇对转基因株系种子和野生型拟南芥种子灭菌, 经无菌水反复冲洗后将其播于MS固体培养基上, 并于温室内培养; 之后将MS培养基上生长7 d的转基因株系和野生型幼苗移到含有蛭石∶营养土=1︰1的培养钵中, 温室内正常生长条件下(16 h光照/8 h黑暗, 22℃)培育3周, 之后停止浇水; 2周后开始观察植株的抗逆表型并统计转基因型和野生型株系的存活率。用300 mmol L-1 NaCl同时浇灌正常条件下培育3周的转基因株系和野生型株系, 每隔2 d重复浇灌一次, 2周后统计植株存活率并拍照, 以鉴定 ZmSNAC1过表达转基因株系的耐盐性。以拟南芥仍然能够保持生长、植株叶片和花序没有萎蔫死亡的定为存活植株; 叶片和花序萎蔫、枯竭死亡的则被认定为死亡植株。每个处理20个植株, 设置3个重复。
1.3.1 相对电导率测定 取受到干旱胁迫处理的转基因株系和野生型拟南芥株系, 选大小均等的叶片用去离子水振荡冲洗2~3次, 再用洁净的滤纸吸干叶片表面水分, 将其剪成适宜大小的叶块(尽量避开叶片主脉), 快速称取叶片鲜重后分别置装有15 mL 去离子水的试管中, 将试管放入真空干燥箱用真空泵抽气20 min至叶片透明且沉入水下, 然后将试管室温下放置1 h, 期间多次震荡试管, 1 h后测定其初始电导值S1并记录空白电导值, 然后沸水浴加热15 min, 冷却至室温, 摇匀后测定终电导值S2, 计算叶片相对电导率值, 设置3次重复。
1.3.2 叶绿素含量测定 取转基因株系和野生型株系待测叶片, 将其剪碎成适宜大小后放入95%的乙醇溶液, 黑暗中浸泡24 h。用日本岛津公司生产UV-160A紫外分光光度计, 以95%乙醇提取剂为对照, 分别于649 nm和665 nm波长下比色, 计算叶绿素含量。 Ca = 13.95 D665 - 6.88 D649, Cb = 24.96 D649 - 7.32D665, C = Ca + Cb ( Ca为叶绿素a的含量; Cb为叶绿素b的含量; C =总叶绿素含量)。
1.3.3 脯氨酸含量测定 按照Bate等[ 17]的方法测定脯氨酸含量。
2.1.1 干旱胁迫下植株生长和存活率鉴定 为探讨 ZmSNAC1在植物生殖生长阶段(拟南芥生长约 35 d开始抽薹)耐旱相关的生物学功能, 比较了该时期内转基因株系和野生型拟南芥在干旱胁迫条件下的表型差异。如图1所示, 在停止浇水2周后, 转基因株系OX-5和OX-7具有相对较好的叶片持绿性和伸展性; 而野生株系则明显表现叶片严重枯竭萎蔫、失绿、花序萎蔫和植株生长停滞。对于干旱胁迫2周后的植株存活率, 2个转基因拟南芥株系OX-5和OX-7分别为80%和78%, 而野生型拟南芥株系仅为28%, 转基因株系较野生型株系提高了50%~52%。
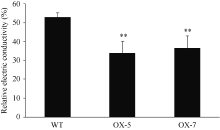
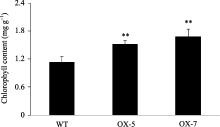
2.1.2 干旱胁迫下相关生理指标鉴定 转基因株系的抗旱性提高不仅表现在其显著提高的植株存活率上, 也表现在胁迫相关生理指标上。如图2所 示, 干旱胁迫条件下转基因株系的相对电导率较野生型株系降低了17%~21%; 而转基因株系的叶绿素含量约为1.52~1.66 mg g-1, 较野生型株系提高36%~ 47%, 差异均极显著(图3)。
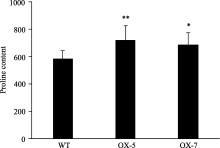
脯氨酸作为一种重要的渗透调节物质来维持植物体内正常的渗透平衡。逆境胁迫条件下, 植物体通过调节体内脯氨酸的含量以维持正常的渗透平衡, 在一定程度上缓解胁迫对自身的毒害作用。比较发现, 干旱胁迫条件下, 转基因植株内游离的脯氨酸含量较野生型株系提高17%~23% (图4), OX-5和OX-7两个转基因株系与野生型株系间脯氨酸含量的差异分别达到极显著和显著水平。
在温室中进行转基因株系抗旱性鉴定的同时也对其进行了植株的耐盐性鉴定。在拟南芥生殖生长发育时期(拟南芥生长约35 d, 开始抽薹), 用300 mmol L-1 NaCl进行浇灌处理, 2周后观察转基因和野生型植株生长情况。结果如图5所示, 转基因株系叶片的持绿性较好, 植株能够维持基本的生长; 而野生型株系则表现叶片干枯、卷曲、失绿、植株生长受到明显抑制。统计结果显示, 野生型拟南芥株系的存活率仅为34%, 而转基因株系OX-5和OX-7的存活率分别为74%和70%, 转基因株系的存活率显著高于对照株系, 表明过表达 ZmSNAC1基因提高了生殖生长阶段转基因拟南芥的耐盐性。
在逆境胁迫信号调控网络中, 转录因子作为分子开关通过与顺式作用元件结合来调控胁迫相关基因的表达。NAC类转录因子是植物中最大的转录因子家族之一, 它在植物生长发育、形态建成和抗逆等方面发挥着重要作用。此前研究发现 ZmSNAC1基因在转录水平上受干旱、盐和冷等非生物逆境胁迫和植物激素ABA、SA诱导; 将MS培养基上生长3周的 ZmSNAC1过表达转基因型和野生型幼苗脱水处理, 发现转基因株系通过降低离体叶片失水速率来提高其自身耐脱水性[ 16]。本文进一步探讨了 ZmSNAC1过表达转基因株系在生殖生长阶段(拟南芥生长约35 d, 开始抽薹)的抗逆性, 结果表明该基因的过量表达可以显著提高转基因株系的抗旱和耐盐性。
逆境胁迫条件下, 植物细胞内的渗透调节物质和保护性大分子物质积累, 起维持细胞膨压、保持细胞内水分的重要作用。脯氨酸作为一种亲水性的渗透调节物质在植物抗逆过程中起着稳定蛋白质特性、改善细胞膜和其他高分子物质的水环境, 增强细胞结构的稳定性等作用[ 18], 前人研究发现抗旱植物体内游离脯氨酸含量显著高于不抗旱品种。在本研究发现干旱胁迫条件下, ZmSNAC1过表达转基因株系体内脯氨酸含量显著高于野生型株系, 脯氨酸的迅速积累有利于转基因株系抵御外界不良 环境。
质膜是水分胁迫的原初反应位点, 干旱胁迫条件下原生质膜组成和结构均发生明显变化, 且胁迫程度强弱与电解质渗漏的多少紧密相关。本研究结果显示 ZmSNAC1过表达转基因株系叶片相对电导率较野生型植株显著降低, 这说明转基因株系细胞膜受逆境胁迫损伤程度较小。由此推测, ZmNAC1基因可能通过与一些与胁迫相关的基因启动子区域内特定的DNA序列相结合来激活或抑制相关基因的表达, 这些胁迫应答基因可能包括一些脯氨酸合成酶基因和膜损伤相关蛋白基因, 以促进植株体内渗透调节物质如脯氨酸和一些保护性蛋白的合成, 从而维持细胞的稳定性和细胞结构的完整性, 最终提高转基因株系的抗逆性。但 ZmSNAC1的具体作用和调控机制还有待进一步研究。
基于基因序列的一致性可以将NAC家族成员划分为不同的亚家族, 而基因结构和进化上的相对保守预示着同一亚家族内基因的功能具有相似性。与之前报道的ATAF亚家族相类似, OsNAC3亚家族同样被认为是与逆境胁迫应答紧密相关的[ 9, 19, 20]。例如, 水稻OsNAC3亚家族的 SNAC1基因受非生物逆境胁迫和ABA诱导, 当 SNAC1水稻过表达转基因株系花期受到严重干旱胁迫时籽粒产量明显高于野生型株系[ 4]。进化分析结果表明, 玉米 ZmSNAC1基因是逆境胁迫相关亚家族OsNAC3的一个成员[ 16], 且该基因受非生物逆境胁迫和ABA胁迫诱导表达上调。对其抗逆生物学功能研究发现, 该基因的过量表达可以提高转基因植株在苗期和生殖生长发育时期的抗逆性, 表明 ZmSNAC1基因作为ABA依赖型信号通路内的调节因子, 参与逆境胁迫信号在体内的传递。由此可见, ZmSNAC1能够在拟南芥的信号传导途径中发挥相似的调控作用, 进而推测其在玉米响应逆境胁迫的信号传导途径中应该也存在类似的机制以确保信号分子迅速而高效的传递。
玉米 ZmSNAC1基因作为与逆境胁迫应答相关的OsNAC3亚家族成员, 过表达 ZmSNAC1显著地提高转基因株系在生殖生长发育时期的抗旱性和耐盐性, 其增强的抗逆性不仅表现在显著提高的植株存活率上, 还通过对转基因株系和野生型株系相关生理指标的检测得以证实。说明该基因在植物应答干旱和盐等非生物逆境胁迫过程中发挥重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|