植物溶血磷脂酸酰基转移酶(lysophospholipid acid actyltransferase, LPAT)是三酰甘油生物合成过程中的一个关键酶, 在脂质的合成、种子的发育以及生物膜的流动性等方面有重要作用。本研究采用同源克隆的方法, 获得
Lysophospholipid acid actyltransferase (LPAT) is a pivotal enzyme of triacylglycerol biosynthesis and plays a key role in lipid synthesis, development of plant seeds and bio-membrane fluidity. Two
高等植物中甘油脂的合成存在真核途径与原核途径[ 1]。通过原核途径形成的脂质称为原核脂质, 原核脂质在质体中合成。同理, 由真核途径形成的脂质称为真核脂质, 真核脂质的合成却是在内质网。真核脂质与原核脂质的主要区别在于 sn-2位置上脂肪酸的组成, 原核脂质 sn-2位置上主要为C16脂肪酸, 而真核脂质 sn-2位置上却主要为C18不饱和脂肪酸[ 2]。溶血磷脂酸酰基转移酶(LPAT; EC 2.3.1.51)作为TAG组装过程中介导 sn-2位置上酰基化反应的一个关键酶, 具有催化溶血磷脂酸转变成磷脂酸的功能[ 3]。因此LPAT对于甘油脂的立体分布(stereospecific distribution)具有重要意义。
现已从拟南芥[ 4]、椰子[ 5, 6, 7]、油菜[ 8, 9]、甘蓝[ 10]、绣线菊[ 11, 12]、棕榈[ 13]、玉米[ 14]、红花[ 15, 16]、蓖麻[ 17]和花生[ 18]等植物中分离LPAT。研究表明, LPAT存在多种异构酶, 如拟南芥中至少存在6种异构酶, 其中LPAT1定位于质体, 与胚胎发育密切相关[ 19]; LPAT2定位于内质网, 影响雌配子的发育; LPAT3定位未知, 却主要在花粉中表达[ 4]; 而在体外检测不到LPAT4和LPAT5的溶血磷脂酸酰基转移酶活性, 它们可能与心磷脂合成有关[ 2]。最近又发现了一个由At4g 24160编码的可溶性LPAT, 兼具脂酶和水解酶活性, 推测其在维持膜脂稳定性上具有重要作用[ 20]。
LPAT与含油量的关系是前人研究LPAT的主要出发点。Maisonneuve等[ 21]研究表明, 拟南芥中2个油菜LPAT异构酶, 都能够以增加油含量和种子质量的形式来增加产量。Suryadevara等[ 22]利用菜豆球蛋白启动子介导酵母 SLC1基因在大豆中表达, 其体细胞胚、T2代和T3代种子的含油量均增加。戚维聪等[ 23]研究油菜种子发育过程中Kennedy途径的各种酶的活性变化, 发现1-酰基甘油-3-磷酸酰基转移酶(LPAAT)活性最高, 且高含油量品系中LPAAT活性高于低含油量品系。陈四龙等[ 24]研究发现, 花生 LPAT4的表达量与种子含油量积累速率一致。
非生物逆境作为一个外在影响因素, 对LPAT的表达具有调控作用。目前, 关于非生物逆境对于LPAT的影响主要集中在高盐、干旱、低温、渗透压和生长素类似物等5个方面。研究显示, 低温能够抑制拟南芥 LPAT1的表达, 降低含高熔点脂肪酸的磷酯酰甘油比例, 从而适应低温条件下的生长[ 25]。但有趣的是, 低温条件下, 拟南芥可溶性 LPAT基因(At4g24160)的表达上调, 且在高盐、缺氧和渗透压的条件下, 该基因的表达呈相同趋势。而玉米素和高温却抑制该基因的表达。
目前, 油菜中已经克隆了4个 LPAT基因, 即 BAT2 (或 ACT2)[ 8]、 BAT1.5、 BAT1.12和 BAT1.13[ 21], 其中, BAT2为 LPAT1, BAT1.5、 BAT1.12和 BAT1.13为 LPAT2, 其余油菜LPAT异构酶基因均未见报道。本研究从甘蓝型油菜湘油15中克隆了2个 LPAT4基因, 并进行了核苷酸和蛋白质的聚类分析以及时空表达与逆境表达分析, 为进一步研究其功能奠定基础。
湘油15 (本实验室保存), pMD-19T载体购自宝生物工程(大连)有限公司(TaKaRa)。反转录试剂盒、TransZol UP植物总RNA提取试剂盒、DNA胶回收试剂盒、DEPC、高保真DNA聚合酶、dNTPs、100 bp DNA Marker、DNase I等均购自北京全式金生物技术有限公司(TransGen)。非生物逆境处理试剂PEG- 4000、ABA、6BA和NaCl等购自索莱宝科技有限公司(Solarbio)。
从拟南芥数据库(http://www.arabidopsis.org/)获取 AtLPAT4基因序列。然后在Bioinformatics at Geboc数据库(http://122.205.95.67/blast/blast.php/)检索获得白菜(AA)和甘蓝(CC)的同源基因序列以及甘蓝型油菜与 AtLPAT4基因同源的EST序列。用Vector软件拼接获得的油菜EST序列, 并将拼接后的序列与白菜和甘蓝 LPAT4基因序列进行比对, 用Primer 5设计引物(表1)。将上述引物送交北京鼎国昌盛生物技术有限责任公司合成。
| 表1 PCR引物与参数 Table 1 PCR primers and parameters |
在22℃、光周期为16 h/8 h条件下培养至2片真叶, 取幼苗50~100 mg, 加液氮充分研磨后, 按照Trans UP试剂盒提供的方法, 提取总RNA的。总RNA的提取以及第1链cDNA的合成的具体方法, 分别参见TransGen TRIzol RNA提取试剂盒和EasyScript First-Strand cDNA Synthesis SuperMix试剂盒说明书。
以上述cDNA为模板进行PCR扩增。PCR体系含模板1 μL、10 mmol L-1 dNTPs 0.5 μL、2 μmol L-1 LPAT4-Fw 0.75 μL、2 μmol L-1 LPAT4-Rv 0.75 μL、10×反应缓冲液1 μL、HiFi高保真DNA聚合酶0.5 μL和ddH2O 5.5 μL。程序为预变性94℃ 3 min, 94℃ 45 s, 54℃ 45 s, 72℃ 90 s, 35个循环, 72℃延伸10 min。PCR扩增产物经1.5%的琼脂糖凝胶检测, 并回收目标带。将回收产物克隆至pMD19-T载体, 经菌落PCR鉴定后, 挑取10个阳性克隆送北京六合华大分公司测序。
利用NCBI数据库分别对 BnLPAT4-1和 BnLPAT4- 2进行BlastN和BlastP序列比对分析。使用Mega5.2进行油菜、拟南芥、白菜和甘蓝的 LPAT4的相似性以及多态性分析。利用Expasy数据库进行理化性质预测、氨基酸二级结构预测、保守结构域和同源建模分析以及氨基酸功能预测。
将拟南芥、白菜、甘蓝以及甘蓝型油菜的核苷酸序列, 经Mega5.2进行UPGMA聚类。从NCBI数据库中检索其他已知植物的LPAT4氨基酸序列, 与拟南芥LPAT家族氨基酸序列用Mega5.2进行UPGMA分析。
分别提取湘油15开花期植株的根、茎、叶、花以及开花后1、2和3周的胚和果荚的总RNA, 进行半定量RT-PCR分析。以甘蓝型油菜 ACTIN (FJ529167.1)基因为内参进行半定量RT-PCR, 检测甘蓝型油菜 BnLPAT4-1和 BnLPAT4-2基因表达。RT-PCR体系10 μL, 含5 U μL-1DNA聚合酶0.2 μL、10 mmol L-1 dNTPs 0.1 μL、10×PCR缓冲液1 μL、50 ng μL-1模板1 μL、2 μmol L-1正反引物各0.5 μL和ddH2O 6.7 μL。PCR程序为94℃变性3 min, 94℃变性30 s, 复性30 s, 72℃延伸40 s, 循环27~35次, 72℃延伸10 min, 4℃恒温保存。所用引物、退火温度及循环次数信息见表1。
将油菜种于育苗盆中, 待长出4~5片真叶时用于NaCl、PEG-4000、水渍、6BA和ABA处理。分别提取处理后油菜叶片RNA进行半定量RT-PCR分析, 各处理取样时间段分别为处理后0、3、6、12和24 h。PCR体系及条件同1.5。处理方法参照文献[25]、[26]和[27], 略有改变。水渍处理是将育苗钵浸泡至清水中, 水面淹没油菜根部; 干旱胁迫是用20% PEG- 4000溶液喷洒油菜叶面浇灌根部; 盐胁迫是以300 mmol L-1NaCl溶液喷洒叶面和浇灌根部; 植物生长调节剂处理是分别将浓度为0.1 mg L-16BA和3 mg L-1ABA溶液喷洒叶面和浇灌根部。叶面喷洒量为每株2 mL, 根部浇灌量即将育苗钵中土壤浇透, 约每钵50 mL。
以极差比较NaCl、PEG-4000、水渍、6BA和ABA对 BnLPAT4-1及 BnLPAT4-2表达的影响, 极差 = (最大值表达值-最小值表达值)/初始表达值, 进行极差分析前, 将所有处理的初始表达值定义为“1”。
从湘油15幼苗中提取总RNA, 以反转录合成的cDNA为模板, 扩增出长度约为1200 bp的cDNA片段。测序结果显示, 获得2条表达序列(CDS), 长度分别为1143 bp和1140 bp, 并将其分别命名为 BnLPAT4-1和 BnLPAT4-2。
经Blast分析, BnLPAT4-1、 BnLPAT4-2与拟南芥 LPAT4全长CDS (NM_202415.1)的相似度最高, 分别为86%和85%, 序列的覆盖度分别为93%和98%。BlastX分析发现, 氨基酸序列的比对结果与核苷酸序列的比对结果基本相同。BnLPAT4-1与拟南芥LPAT4 (NP_565098.1)氨基酸序列相似度为85%, BnLPAT4-2与拟南芥LPAT4 (NP_565098.1)氨基酸序列相似度为86%。BnLPAT4-1与BnLPAT4-2氨基酸序列的相似度为96%。
以Mega5.2对拟南芥、白菜、甘蓝、 BnLPAT4-1和 BnLPAT4-2比对(图1)表明, BnLPAT4-1与 BolLPAT4-2序列非常相似, 相似度为99.6%, 多态性为0.4%。而 BnLPAT4-2与 BraLPAT4-2序列相似度为99.9%, 多态性为0.1%。 BnLPAT4-1与 BnLPAT4-2的相似度为96.8%, 说明序列具有高度一致, 证明扩增所得的2条CDS为 LPAT4基因, 属于甘蓝型油菜湘油15 LPAT4基因的2个拷贝。
通过Expasy蛋白质数据库(http://www.expasy.org/)对 BnLPAT4-1和 BnLPAT4-2的理化性质预测分析显示, BnLPAT4-1共编码380个氨基酸, 其相对分子质量为43.29 kD, 等电点为8.74。其带正电荷氨基酸为Lys和Arg, 占氨基酸总数的11.1%, 带42个单位的正电荷。带负电的氨基酸为Asp和Glu, 占氨基酸总数的9.4%, 带36个单位的负电荷。 BnLPAT4-2共编码379个氨基酸, 其相对分子质量为43.16 kD, 等电点为8.93。其带正电荷氨基酸为Lys和Arg, 占氨基酸总数的11.3%, 带43个单位的正电荷。带负电的氨基酸为Asp和Glu, 占氨基酸总数的9.2%, 带35个单位的负电荷。这2个基因所编码的蛋白均为不稳定蛋白, 其稳定性在46%左右, 在酵母细胞内的半衰期约为20 h, 在大肠杆菌细胞内的半衰期约为10 h。它们均具有很高的脂肪族性质, 脂肪族指数高达0.97, 同时具有较高的缩水性, 缩水性指数约为0.11。
以SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page/NPSA/npsa_sopma.html)氨基酸二级结构分析工具, 对 BnLPAT4-1及 BnLPAT4-2所编码的氨基酸分析结果如图2所示, BnLPAT4-1所编码蛋白的二级结构中48.95%为α螺旋, 14.47%为β折叠, 4.74%为β转角, 31.83%为无规卷曲。 BnLPAT4-2所编码蛋白的二级结构中, α螺旋、β折叠、β转角以及无规卷曲所占的比例依次为42.22%、15.57%、3.17%和39.05%。
通过NCBI的Blast工具对BnLPAT4-1和BnLPAT4-2蛋白的保守结构域分析显示, 它们均具有LPLAT_LCLAT1样结构域, 属于LPLAT超基因家族。通过Swiss-Model (http://expasy.hcuge.ch/swissmod/SWISS-MODEL.html)同源建模数据显示, BnLPAT4- 1和BnLPAT4-2蛋白均适用溶血磷脂酸酰基转移酶模型。进一步说明 BnLPAT4-1和 BnLPAT4-2是LPLAT基因家族中的2个成员。
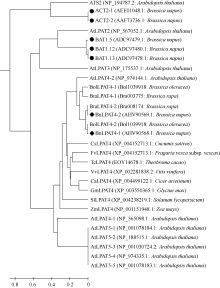
以BnLPAT4-1氨基酸序列为参考序列, 经BlastP, 从数据库中获取其他已知植物的LPAT4氨基酸序列。以Mega 5.2将BnLPAT4-1 (AHV90568.1)和BnLPAT4-2 (KJ184846AHV90569.1)的氨基酸序列同白菜(Bra003775和Bra008174)、甘蓝(Bol1039918和Bol1039918)、鹰嘴豆(XP_004499122.1)、大豆(XP_003550365.1)、玉米(NP_001151948.1)、番茄(XP_004238219.1)、黄瓜(XP_004152713.1)、葡萄(XP_002281838.2)、野草莓(XP_004293226.1)、可可树(EOY14678.1)、甘蓝型油菜已知LPAT (AEE01048.1、AAF73736.1、ADC97479.1、ADC97480.1和ADC97478.1)以及拟南芥LPAT家族[ATS2或LPAT1(NP_194787.2), LPAT2(NP_567052.1), LPAT3(NP_175537.1), LPAT4 (NP_565098.1和NP_974144.1)和LPAT5(NP_ 001078184.1、NP_188515.1、NP_001030724.2、NP_ 974335.1和NP_001078183.1)]的氨基酸序列进行UPGMA聚类分析(图3)。以0.4为节点, 29条氨基酸序列大致可以分成以拟南芥LPAT家族5个成员为代表的5大类。第I类为LPAT1, 包括拟南芥ATS2和油菜ACT2-1和ACT2-2; 第II类为LPAT2, 包括拟南芥LPAT2和油菜BAT1.5、BAT1.12和BAT1.13; 第III类为LPAT3, 仅含拟南芥LPAT3; 第IV类为LPAT4, 包括拟南芥LPAT4-1和LPAT4-2、鹰嘴豆(XP_ 004499122.1)、大豆(XP_003550365.1)、玉米(NP_ 001151948.1)、番茄(XP_004238219.1)、黄瓜(XP_ 004152713.1)、葡萄(XP_002281838.2)、野草莓(XP_ 004293226.1)、可可树(EOY14678.1)、白菜(Bra003775和Bra008174)、甘蓝(Bol1039918和Bol1039918)和甘蓝型油菜(BnLPAT4-1和BnLPAT4-2); 第V类为LPAT5, 主要为拟南芥LPAT5-1至LPAT5-5。BnLPAT4- 1和BnLPAT4-2属于第IV类, 且BnLPAT4-1同BolLPAT4-2亲缘关系较近, BnLPAT4-2与BraLPAT4-2亲缘关系较近, 而BraLPAT4-1和BolLPAT4-1的亲缘关系较近。故而, 从氨基酸聚类上也可认为, BnLPAT4- 1和BnLPAT4-2是甘蓝型油菜LPAT4家族的2个成员。
半定量RT-PCR结果表明, BnLPAT4-1和 BnLPAT4-2在根、茎、叶、花、胚以及果荚中均表达, 并且表达模式不同。其中 BnLPAT4-1在叶中表达量最高, 在茎中表达量次之, 在根中的表达量最低; 而 BnLPAT4-2在胚中的表达量普遍比其他组织中的表达量高, 其中以4周胚中表达量最高, 同样, 在根中的表达量最低。 BnLPAT4-1在胚及果荚中表达量随时间的变化趋势基本相同, 都是先升高后降低, 在胚及果荚中的最大表达值, 均出现在第3周前后。 BnLPAT4-2在胚和果荚中呈现不同的变化趋势, BnLPAT4-2在胚中的表达模式为先降低后升高再降低, 在果荚中却是先升高后降低再升高(图4)。
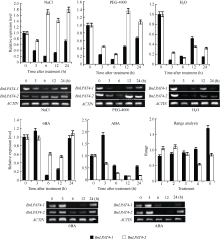
BnLPAT4-1在NaCl、PEG-4000和水渍的处理下, 基本上均呈现出先降低后升高的表达模式, 而在6BA及ABA的处理下却呈现出先升高后降低再升高的表达模式。在上述5种处理条件下, BnLPAT4-1表达的最小值分别出现在6、6、3、6和12 h, 其对应的最小值分别为空白组的0.20、0.12、0.08、0.12和0.17倍。
BnLPAT4-2的表达较 BnLPAT4-1而言, 存在一定的差异。在NaCl及PEG-4000的处理下, BnLPAT4-2呈现先降低后升高再降低, 且最大表达值超过对照组, 其对应的最小值分别出现在3 h和6 h, 且其对应的表达值是对照组的0.74倍和0.25倍。在水渍处理时, 虽与NaCl和PEG-4000处理下呈现相同的趋势, 但其在整个试验过程中表达量却始终低于对照组。在6BA和ABA的处理下, BnLPAT4-2的表达呈现先降低后升高的趋势。相应处理下, BnLPAT4-2的最低表达值均出现在12 h, 其表达量分别为空白组的0.55倍和0.15倍。
利用极差评估NaCl、PEG-4000、水渍、6BA和ABA对 BnLPAT4-1和 BnLPAT4-2表达的影响, ABA对 BnLPAT4-1的影响最大, NaCl对 BnLPAT4-1的影响最小, PEG4000对 BnLPAT 4-2的影响最大, 6BA对 BnLPAT4-2的影响最小。
无论是从核苷酸聚类还是从氨基酸聚类, 都显示出相同的结果, BraLPAT4-1与 BolLPAT4-1的亲缘关系较近, 而 BraLPAT4-2与 BolLPAT4-2亲缘关系较近。这与芸薹属A、B、C染色体组间的异源配对的频率高于每个染色体组内的同源配对频率, 染色体组组间的同源性高于染色体组内的同源性的结论相一致[ 21]。基于A、B、C基因组间亲缘关系存在这样的特点, 所以仅凭一般的聚类和序列分析很难对甘蓝型油菜的A/C基因组分型。通过对 BnLPAT4-1和 BnLPAT4-2所编码蛋白的理化性质预测分析表明, 这2个基因所编码的蛋白均为不稳定蛋白, 其稳定性在46%左右, 在酵母细胞内的半衰期约为20 h, 在大肠杆菌细胞内的半衰期约为10 h。半衰期较短可能是在体外检测不到LPAT4酶活性[ 17]的原因之所在。
对所得的2个CDS分析发现, BnLPAT4-2同A基因组 BraLPAT4-2亲缘关系较近, BnLPAT4-1同C基因组 BolLPAT4-2亲缘关系较近, 说明在油菜中存在2个亲本的基因组。从染色体定位来说, BraLPAT4-1和 BolLPAT4-1分别位于A07和C07染色体, 而 BraLPAT4-2和 BolLPAT4-2分别定位在A02和C02染色体。说明同一物种的2个 LPAT4之间仍具有一定的辨识度。这些结果与基因组原位杂交所得结果一致, 杂交结果显示, 在油菜基因组中仍然保留着亲本的2个基因组, 并且基因组之间没有显著的均一化现象和大规模转座现象发生[ 28]。
时空表达分析表明, BnLPAT4-1和 BnLPAT4-2在根、茎、叶、花、各时期的胚以及果荚中均表达, 说明 BnLPAT4-1和 BnLPAT4-2为组成型表达基因, 结果与文献[4]相同, 并且二者呈现不同的表达谱。 BnLPAT4-1在叶中表达量比较高, 而 BnLPAT4-2在胚中的表达量普遍偏高, 故而推测 BnLPAT4-2可能与油菜含油量有关。本研究 BnLPAT4-1在NaCl、PEG-4000和水渍3个影响渗透压的逆境胁迫下, 其表达被抑制, 而在生长素类似物6BA和ABA的胁迫下, 则促进 BnLPAT4-1的表达。说明 BnLPAT4-1对外界渗透压的抵抗能力比较弱, 而对生长素类似物的影响则比较敏感, 尤其是对ABA的响应。在高盐和干旱胁迫下, BnLPAT4-2的转录水平升高, 但都具有后时性, 结果与文献[21]相同。但在水渍、6BA和ABA的胁迫下, BnLPAT4-2的表达下降, 呈抑制状态。说明在高盐和干旱的胁迫下, 油菜可能通过调控 BnLPAT4-2的表达, 来缓解不利环境对其自身的伤害。ABA严格抑制 BnLPAT4-2的表达, 与 BnLPAT4-1的情况相反。从而进一步说明, 本试验已成功的地区分了甘蓝型油菜 LPAT4的2个拷贝。
从甘蓝型油菜湘油15中分离得到 LPAT4基因的2个拷贝, 分别命名为 BnLPAT4-1和 BnLPAT4-2。分别对其序列特征、遗传进化、时空表达与逆境表达进行了分析。它们属于组成型表达基因, 且 BnLPAT4- 1和 BnLPAT4-2呈现不同的表达模式, 其中 BnLPAT4-2可能与含油量有关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|