* 通讯作者(Corresponding author): 崔党群, E-mail:cdq62@sohu.com, Tel: 0371-63558537
第一作者联系方式: E-mail:chf0088@sina.com.cn, Tel: 0371-63558537
Genes
位于5D染色体短臂上的 puroindoline基因是控制小麦籽粒硬度的主效基因, 主要有 puroindoline a ( Pina)和 puroindoline b ( Pinb) 2个基因组成[ 1, 2, 3, 4]。研究表明, Pina或 Pinb基因发生突变以及 Pina基因缺失均会导致小麦胚乳质地变硬[ 3, 4, 5, 6], 并且已在普通小麦中发现多种 puroindoline基因变异类型[ 1, 2, 3, 4, 7]。另外, puroindoline基因变异对小麦磨粉和食品加工品质也具有重要影响[ 8, 9, 10], 同时该基因的过量表达对增强植株抗病能力有一定作用[ 11]。
随着对小麦 puroindoline基因研究的持续深入, 一组与其相似性很高的类 puroindoline基因在普通小麦cDNA中被发现[ 12]。由于该类 puroindoline基因与 puroindoline b基因相似性高达72%, 因此被命名为 puroindoline b-2 ( Pinb-2)基因。与 puroindoline基因只有一个拷贝不同, Pinb-2基因在普通小麦中至少存在3个拷贝, Wilkinson等[ 12]认为3个拷贝均位于7A染色体上。Chen等[ 13]在一个美国小麦品种中发现了一个新的 Pinb-2基因类型, 将其命名为 Pinb-2v4, 并利用非整倍体对已报道的 Pinb-2基因进行了定位和重新命名, 发现 Pinb-2v1位于7DL上、 Pinb-2v2位于7BL上、 Pinb-2v3位于7B上、 Pinb-2v4位于7AL上; 且 Pinb-2v2和 Pinb-2v3总是互补出现在不同的品种中, 可能互为一对等位基因。Geng等[ 14]进一步证实 Pinb-2基因位于普通小麦第7染色体的不同同源群上, 还利用多个遗传群体进一步证实 Pinb-2v2和 Pinb-2v3互为一对等位基因[ 15]。之后, Chen等[ 16, 17]和Ramalingam等[ 18]分别在普通小麦和硬粒小麦中发现了多种新的 Pinb-2基因变异类型, 但有些类型如 Pinb-2v5和 Pinb-2v6可能只存在于少数品种中。
随着 Pinb-2基因的发现以及该类型基因与小麦籽粒硬度主效基因 Pinb的高度相似性, 有关其功能的研究也逐步开展。研究发现, 软质麦中不同 Pinb-2基因类型间小麦籽粒硬度有显著差异, 而在硬质麦中不同变异类型之间的差异不明显[ 19]; Pinb-2v3基因型的千粒重、粒径和每穗粒重等性状均显著高于 Pinb-2v2基因型[ 20, 21], 但两者的SKCS籽粒硬度间没有显著差异[ 22]。Mohler等[ 23]分析了不同 puroindoline基因和 Pinb-2变异类型的小麦品质性状, 发现 puroindoline基因变异与11个品质性状间具有密切关系, 而 Pinb-2基因位点变异与这11个品质性状没有明显相关性。Ramalingam等[ 18]研究表明, Pinb-2基因具有一定的抗菌功能, 可能在植物防御中起一定作用。
在先前的研究中, 我们发现 Pinb-2v3基因存在3种类型( Pinb-2v3a、 Pinb-2v3b和 Pinb-2v3c), 即普通小麦B基因组上存在4种变异类型, 包括 Pinb-2v2和3种 Pinb-2v3类型; 同时, 我们还发现 Pinb-2基因在小麦根和叶中均有表达, 并非种子特异性表达[ 21]。表达量比较分析表明[ 21], Pinb-2v3b类型表达量显著高于 Pinb-2v3a、 Pinb-2v3c和 Pinb-2v2类型, 而后三者之间没有显著差异。软质麦中 Pinb-2v3b基因型的籽粒硬度显著高于其他基因型[ 21]。本文进一步分析了 Pinb-2基因变异类型与小麦产量相关性状和旗叶大小的关系, 并利用重组近交系群体对位于B基因组上的 Pinb-2基因进行了初步定位, 为深入了解该基因的功能和小麦育种提供一定信息。
2006—2007和2010—2011年小麦生长季, 将来自我国黄淮麦区的普通小麦历史品种、农家品种和当前主栽品种共167份种植于河南农业大学科教示范园区(河南郑州)。每个材料种植2行, 行长2 m, 行间距为23 cm, 完全随机排列, 2次重复。按当地生产进行田间管理, 农家种在抽穗前期采用防倒网支撑以防倒伏, 所有参试小麦品种(系)均未发生倒伏和穗发芽。
收获前每个材料在1 m行长内连续选10株挂牌, 调查小穗数、不孕小穗数、旗叶长和旗叶宽, 并按旗叶长×旗叶最大宽度×0.75[ 20]计算旗叶面积; 收获挂牌株进行考种, 性状包括穗粒数、穗粒重、千粒重、粒长、粒宽和单株粒重。
首先采用Chen等[ 13]设计的特异引物Pinb-2v1 F/R~Pinb-2v4 F/R进行PCR扩增, 以鉴定每份材料A、B和D基因组上的 Pinb-2v4、 Pinb-2v2、 Pinb-2v3和 Pinb-2v1类型。对 Pinb-2v3基因型作进一步鉴定, 先采用Chen等[ 21]设计的Tsp4cI-2v3F/R和DdeI- 2v3F/R引物对(表1)进行扩增, 然后分别用 Tsp4cI和 DdeI进行酶切鉴定 Pinb-2v3b和 Pinb-2v3c基因型, 最后将不属于这两种基因型的材料用全长引物Pinb-2vU (表1)扩增, 并对产物测序以确定其是否属于 Pinb-2v3a类型[ 21]。
PCR反应体积为25 µL, 含1×PCR缓冲液(10 mmol L-1 Tris-HCl, pH 9.0; 50 mmol L-1 KCl; 1.0% Triton X-100), 1.5 mmol L-1 MgCl2, 0.3 mmol L-1 dNTP, 上、下游引物各10 pmol, 模板DNA 200 ng, 0.5 U Taq酶。反应条件为首先94℃变性5 min; 然后94℃变性30 s, 58℃退火30 s, 72℃延伸1 min, 循环35次; 最后72℃延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳分离, 采用缓冲体系为1×TAE溶液, 160 V电压电泳30 min, 溴化乙锭染色后在紫外灯下读取结果。
| 表1 用于鉴定小麦 Pinb-2基因的引物 Table 1 Primers used for identifying Pinb-2 genes in wheat |
以河南农业大学小麦遗传育种课题组组配的豫麦2号和高代品系86-79的F8代重组近交系(350个株系)作为作图群体, 从7B染色体上40对SSR引物中筛选出10对在两亲间有多态性的引物。利用这10对引物在350个株系中扩增, 读取相应条带结果。同时采用 Pinb-2v2和 Pinb-2v3的特异引物 (表1)在该作图群体中扩增, 读取其基因型。PCR扩增条件及其退火温度按Graingenes (http://wheat. pw.usda.gov/cgi-bin/graingenes/browse.cgi?class= marker) 推荐。利用JoinMap 4.1进行遗传连锁图的构建。
用SPSS 19.0和Microsoft Excel 2003计算和统计分析调查数据, 用LSR (Least Significant Ranges)方法比较基因型间的差异显著性。
特异扩增、dCAPS标记和测序鉴定结果表明, 所有材料的A和D基因组均分别含有 Pinb-2v4和 Pinb-2v1, 与先前报道结果一致[ 13, 14, 16]; B基因组存在4种变异类型, 分别为 Pinb-2v2、 Pinb-2v3a、 Pinb-2v3b和 Pinb-2v3c, 其比例分别为22.1% (37/167)、11.4% (19/167)、56.9% (95/167)和9.6% (16/167)。因此, Pinb-2v4/Pinb-2v3b/Pinb-2v1是参试材料中 Pinb-2位点最为常见的基因型组合。
Pinb-2基因不同变异类型间多个产量相关性状均存在着显著差异。在4种不同变异类型中, Pinb- 2v3b基因型的千粒重、籽粒直径、穗粒数、穗粒重和单株粒重均相对较高, 且其单株粒重显著高于其他3种 Pinb-2基因型(表2)。
旗叶面积及是否下垂直接影响小麦群体和光合作用和通风透光, 最终影响籽粒产量。适当的旗叶大小对籽粒灌浆期起重要作用。 Pinb-2位点变异与小麦旗叶大小有一定关系, Pinb-2v3a基因型的旗叶宽度和长度及面积均显著高于其他3种基因型(表2)。
| 表2 不同 Pinb-2等位变异类型之间产量相关性状和旗叶大小比较 Table 2 Comparison of yield-related traits and flag leaf size among cultivars with different Pinb-2alleles |
puroindoline基因是影响小麦籽粒硬度的主效基因, 其编码的蛋白具有两性(amphipathic)分子特征。该基因位于普通小麦5D染色体的短臂上, 存在于小麦及其近缘物种中, 但四倍体硬粒小麦因缺少D基因组而不含 puroindoline基因。该基因除了对小麦籽粒硬度有重要影响外, 对其他小麦磨粉和食品加工品质也具有重要影响。转 puroindoline基因水稻籽粒硬度显著降低, 抗病性显著提高; 转 puroindoline基因玉米的种子油分含量显著提高, 抗病性也显著增强[ 24]。这些证据表明 puroindoline基因具有一因多效功能。 Gsp-1是第1个被发现与 puroindoline高度相似的基因, 且二者均位于 Ha( Hardness)位点, 紧密连锁。然而, 迄今未发现 Gsp-1基因对小麦籽粒硬度有明显调节作用。Gollen等[ 25]认为 Gsp-1基因可能在植物防御过程中起重要作用。 Pinb-2是普通小麦中第2个被发现的类 puroindoline基因, 与 puroindoline基因的种子特异性表达和单拷贝特性不同, Pinb-2能够在小麦根、叶等多种器官中表达[ 21], 且在普通小麦中存在多拷贝, 可能是一个基因家族[ 18, 26], 这为进一步研究该基因的功能增加了难度。尽管有研究表明, 不同 Pinb-2基因型软质小麦的籽粒硬度存在显著差异, 但仍未有充分证据表明 Pinb-2基因与小麦籽粒硬度之间具有密切关系。
与小麦产量相关的主效QTL虽已报道很多, 但仅有极少基因被克隆, 究其原因, 可能是产量相关性状较为复杂, 单个基因效应往往相对较小, 且性状受环境影响较大。本研究表明, Pinb-2基因与产量相关性状之间存在密切关系, 其中 Pinb-2v3b基因型的产量相关性状可能优于其他 Pinb-2基因型, 这为高产小麦新品种培育提供了重要的信息。研究发现, Pinb-2v3b类型的小麦在品种比其他 Pinb-2类型品种具有更好的推广效果[ 21], 暗示该类型品种可能更受欢迎, 这也可能是导致调查品种中 Pinb-2v3b基因型最常见的原因。
对PINB-2蛋白功能域预测发现[ 21], PINB-2蛋白有一个AAI (alpha-amylase inhibitor)功能域, 而该功能域与植株的抗性有密切关系。序列分析发现, 相比 Pinb-2v3a基因型, Pinb-2v3b和 Pinb-2v3c基因型的突变均发生在AAI功能域, 但 Pinb-2v3c突变并未造成氨基酸的变化。因此, Pinb-2v3b类型拥有相对优良的农艺性状可能与其AAI功能域的氨基酸发生变化从而导致植株抗性增加有关, 这与Ramalingam等[ 18]认为 Pinb-2具有一定的抗菌功能的结论相一致。此结果尚需进一步证实。
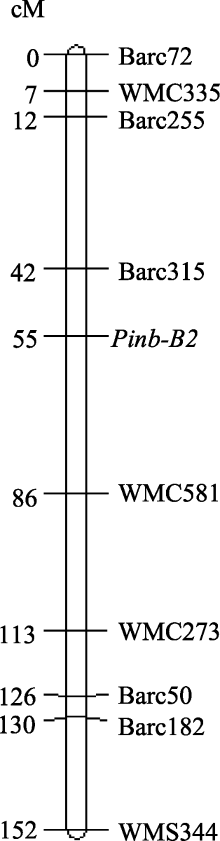
关于 Pinb-2基因的定位存在争议, Wilkinson等[ 12]认为 Pinb-2基因的3个同源基因均位于7A染色体, 而Chen等[ 13, 16]和Geng等[ 14]研究发现, Pinb-2的多个同源基因分别位于7AL、7BL和7DL。本研究对 Pinb-2基因定位后发现, Pinb-2v2和 Pinb-2v3b均位于7B染色体的长臂上, 与SSR标记 Barc315紧密连锁, 遗传距离为13 cM, 这一结果支持 Pinb-2v2和 Pinb-2v3b互为一对等位因子的结论。本研究结果与Chen等[ 13, 16]和Geng等[ 14]的发现一致, 但与Wilkinson等[ 12]的结果不符, 可能是由于Wilkinson等当时未发现 Pinb-2v4基因, 因而所采用的引物并不具有基因特异性。
我国来自黄淮麦区的167份小麦品种(系)中拥有 Pinb-2v3b类型的品种表现高粒重和大粒径的特征, 而拥有 Pinb-2v3a类型的品种表现大旗叶(宽度、长度和叶面积)的特点, 表明 Pinb-2v3b基因型可能拥有相对优良的综合农艺性状。 Pinb-2v2和 Pinb-2v3互为一对等位基因, 位于7BL染色体, 与标记 Barc315连锁。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|