春化基因
黄淮冬麦区是我国最大的小麦主产区。 Vrn-B1基因是控制该麦区小麦品种冬春性的主要春化基因之一[ 1], 与小麦品种的生长发育、早熟性等密切相关。研究春化基因 Vrn-B1不同等位变异的效应及其分布, 对广适高产稳产小麦品种选育和栽培具有重要意义。目前, 已明确的小麦春化基因有 Vrn1、Vrn2、Vrn3和 Vrn4。其中, Vrn1是小麦最主要的, 编码蛋白为MADS转录因子[ 2, 3], 控制小麦从营养生长向生殖生长转化。该基因在普通小麦中有3个等位基因, 分别位于5AL、5BL和5DL染色体, 被命名为 Vrn-A1、 Vrn-B1和 Vrn-D1[ 4, 5, 6, 7, 8, 9]。不同位点存在不同等位变异, 对低温春化处理要求不同, 决定小麦的冬春性也不同。当这3个等位基因中任何一个为显性时, 小麦的生长习性表现为春性或半春性[ 10]。
在 Vrn-A1位点, 与野生型隐性等位变异 vrn-A1相比, 启动子或第一内含子序列发生突变, 小麦就表现为春性[ 10, 11, 12]; 已明确的显性等位变异有 Vrn-A1a和 Vrn-A1b等类型, 显性等位变异 Vrn-A1a的抽穗期一般早于 Vrn-A1b[ 1]。在 Vrn-B1位点, 与野生型隐性等位变异 vrn-B1相比, 第一内含子内的序列发生突变, 小麦就表现为春性[ 13]。在普通小麦中, 已发现 Vrn-B1位点存在3种显性等位变异类型: (1)在第一内含子中发生6850 bp片段缺失的等位变异, 该等位变异类型被定名为 Vrn-B1a[ 13]; (2)与等位变异 Vrn-B1a相比, 在第一内含子的8496~8532 bp处缺失36 bp片段, 该等位变异类型被定名为 Vrn-B1b[ 14]; (3)与等位变异 Vrn-B1a相比, 在第一内含子起始区下游107 bp处缺失820 bp片段, 并在此处插入431 bp片段(位于序列1330~1761 bp处), 该等位变异类型被定名为 Vrn-B1c[ 15]。Shcherban等[ 16]研究发现, 等位变异 Vrn-B1c的抽穗期早于 Vrn-B1a。Fu等[ 13]根据 Vrn-B1位点不同等位变异序列差异, 开发了用于检测显性和隐性等位变异的功能分子标记。最近, Milec等[ 17]又开发了特异性引物, 用于检测显性等位变异 Vrn-B1c。在 Vrn-D1位点, 与野生型隐性等位变异 vrn-D1相比, 第一内含子与启动子序列发生突变, 小麦就表现为春性或半冬性。在普通小麦中, Vrn-D1位点显性等位变异包含2种类型: (1)第一内含子中缺失4235 bp的片段, 该等位变异类型被定名为 Vrn-D1a[ 13]; (2)在等位变异 Vrn-D1a基础上启动子区域CArG-box处再发生C→A的单碱基突变, 该等位变异类型被定名为 Vrn- D1b[ 18]。等位变异 Vrn-D1a抽穗期早于 Vrn-D1b[ 18]。就 Vrn1位点而言, 显性等位变异遗传效应为 Vrn-A1> Vrn-B1> Vrn-D1, 且 Vrn-A1对 Vrn-B1和 Vrn-D1具有上位效应[ 1, 19]。
Vrn3通过促进 Vrn1的转录[ 20], 使小麦抽穗期提前。在普通小麦中有3个等位基因, 被命名为 Vrn-A3、 Vrn-B3和 Vrn-D3, 分别位于7A、7BS和7D染色体[ 21, 22]。在普通小麦中, 已发现 Vrn-B3位点存在两种等位变异。与野生型隐性等位变异 vrn-B3相比, 起始密码子上游591 bp处发生突变, 插入5295 bp的反转座子片段, 该显性等位变异被定名为 Vrn-B3[ 22]。Yan等[ 22]根据 Vrn-B3位点不同等位变异间序列差异, 开发了用于检测显性等位变异 Vrn-B3和隐性等位变异 vrn-B3的功能分子标记。
Iwaki等[ 23]通过对来自中国、日本、朝鲜等东亚地区326个小麦品种春化基因组成的分析, 发现 Vrn-A1、 Vrn-B1和 Vrn-D1位点的显性等位变异在中国春小麦品种中的分布频率不同, 且在中国冬小麦中 Vrn-A1位点的显性等位变异出现的概率极少, 进而认为品种的生长习性与推广地区冬季寒冷的程度有关: 1月平均温度在-7℃以下或4℃以上地区, 主要种植春性品种, 小麦一般春季播种; 相反, 1月平均温度在-7 ~ 4℃之间的地区, 主要种植冬性品种, 秋季播种。杨芳萍等[ 24]通过对来自世界23个小麦主产国的品种研究也得到相似结论, 3个位点的显性等位变异主要分布于中国春麦区和南方冬麦区、加拿大、日本、意大利、印度、智利、阿根廷和澳大利亚等国的小麦; 而在北美和欧洲小麦的频率极低, 其生长习性大多为强冬性或冬性。Zhang等[ 1]进一步研究认为, Vrn-B1基因是决定黄淮冬麦区小麦品种冬春习性的主要春化基因之一。
至今已报道的国内小麦品种在春化基因 Vrn-B1位点仅有1种显性等位变异, 但本课题组最近研究发现, 皖麦33和豫麦34等国内品种在 Vrn-B1基因第一内含子存在序列差异。在此基础上, 本研究利用两品种杂交组合的群体后代分析不同等位变异低温春化处理对抽穗期的影响, 进一步明确黄淮冬麦区小麦品种内 Vrn-B1位点等位变异分布特点, 为该地区引种和培育广适稳产高产品种提供依据。
选取小麦品种皖麦33和豫麦34, 分析其 Vrn-B1位点的等位变异序列; 以豫麦34×皖麦33杂交F2代群体, 分析该位点等位变异对不同时间低温春化处理的反应。我们的前期研究表明[ 1], 皖麦33和豫麦34在春化基因 Vrn-A1、 Vrn-D1和 Vrn-B3位点均由隐性等位变异组成, 在光周期基因 Ppd-D1位点均由显性等位变异 Ppd-D1a组成; 在光周期基因 Ppd-A1和 Ppd-B1位点, 采用Nishida等[ 25]开发的分子标记进行检测, 均由隐性等位变异 Ppd-A1b和 Ppd-B1b组成; 并且, 皖麦33与豫麦34在 Vrn-B1第1内含子存在序列差异, 光周期基因和其他已知春化基因的组成均相同。
选取228个黄淮冬麦区历史上和当前主栽品种, 分析其 Vrn-B1位点不同等位变异的分布特点。这些品种包括山东品种64个, 陕西品种56个, 河南品种49个, 河北品种22个, 山西品种19个, 江苏品种12个, 安徽品种6个。
利用CTAB法[ 26], 提取小麦品种幼苗叶片的基因组DNA, 每个品种至少提取2份DNA作为生物学重复, 以保证结果的可靠性。
采用Fu等[ 13]开发的2对特异性标记, 对 Vrn-B1位点等位变异进行检测。引物对Intr/B/F (5′-CAAGT GGAACGGTTAGGACA-3′)和Intr1/B/R4 (5′-CAAAT GAAAAGGAATGAGAGCA-3′)用于该位点隐性等位变异 vrn-B1的检测, 引物对Intr/B/F和Intr1/B/R3 (5′-CTCATGCCAAAAATTGAAGATGA-3′)用于不同显性等位变异的检测。PCR体系20 μL, 含2 μL 10 × buffer、0.2 μL Taq DNA聚合酶(1 U)、4种dNTP各150 μmol L-1、每条引物10 pmol、模板DNA 100 ng。
PCR程序为94℃预变性10 min; 94℃变性45 s, 58~63℃退火30 s, 72℃延伸45~60 s, 38个循环; 72℃终延伸l0 min。PCR产物经2%琼脂糖凝胶120 V电泳1 h, 及EB染色后照相观察。用引物对Intr/B/F和Intr1/B/R3在皖麦33和豫麦34中扩增出现特异条带, 利用百泰克DNA凝胶回收试剂盒回收目的片段, 连接至PMD-18T载体后送由南京金斯瑞生物科技有限公司测定序列, 通过DNAMAN软件将获得的PCR产物序列与来源于NCBI数据库的 vrn-B1序列(AY747604.1)、 Vrn-B1a序列(AY747603)和 Vrn-B1b序列(FJ766015.1)比对分析, 确定皖麦33和豫麦34的 Vrn-B1位点序列差异和等位变异类型。
为明确低温春化处理对含显性等位变异 Vrn-B1a或 Vrn-B1b的小麦抽穗期影响, 以及满足春化需求的低温处理时间, 以等位变异 Vrn-B1a品种皖麦33与等位变异 Vrn-B1b品种豫麦34为亲本构建杂交组合。在豫麦34×皖麦33的F2群体中, 随机选3个单株, 每株随机取80粒种子, 先用无菌水浸泡, 再于4℃下萌动1 d, 20℃发芽1 d, 然后在4℃培养箱中进行0、5、10、15、20、25、30和35 d共8个低温春化处理, 每处理30粒种子, 每个单株10粒。将处理后的种子移栽至盛有营养土的塑料箱(0.60 m × 0.45 m × 0.10 m)内, 种植密度为0.06 m × 0.05 m, 16℃缓苗1 d后, 于温室中生长。为避免生长过程中低温导致自然春化和其他因素影响, 控制温度为22±3℃, 光周期为16 h (昼)/8 h (夜), 直至抽穗。
用引物Intr/B/F和Intr1/B/R3检测每个单株的等位变异类型, 同时记录群体后代从萌动到抽穗的天数[ 13]。由于春化处理过程中低温使小麦生长缓慢, 会导致移栽时小麦幼苗生长时期不同, 因此利用未经春化处理(0 d)小麦从移栽到三叶期平均天数为标准进行校正[ 27]。利用SPSS17.0对获得的数据进行分析, 确定低温春化处理、等位变异类型以及二者互作对群体后代抽穗期的效应。
利用Fu等[ 13]开发的标记, 按前述方法检测228个品种的 Vrn-B1等位变异, 分析其在不同省份的分布频率。
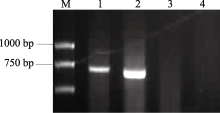
在以分子标记检测小麦 Vrn-B1位点春化基因组成时, 用隐性等位变异引物Intr/B/F和Intr1/B/R4在豫麦34和皖麦33品种中没有扩增出1149 bp特异条带, 说明在该位点由 Vrn-B1显性等位变异组成; 再用显性等位变异引物Intr/B/F和Intr1/B/R3进行扩增, 皖麦33和豫麦34均显示有扩增产物, 但产物大小不同, 说明两品种在 Vrn-B1位点的显性等位变异类型存在序列差异(图1)。
回收皖麦33和豫麦34的扩增产物进行测序, 获得的序列与NCBI数据库(http://www.ncbi.nlm.nih. gov/)中的隐性等位变异 vrn-B1序列(AY747604.1)比对, 皖麦33和豫麦34在第一内含子中1346~ 8190 bp处均有6844 bp片段缺失; 随后, 将皖麦33的PCR扩增的序列与NCBI数据库中 Vrn-B1a序列(AY747603)比对, 序列相似度为100%, 表明皖麦33在 Vrn-B1位点为等位变异 Vrn-B1a类型; 将豫麦34扩增序列与等位变异 Vrn-B1a序列比对, 豫麦34扩增序列在8496~8532 bp处缺失了36 bp片段, 与等位变异 Vrn-B1b (FJ766015.1)序列一致[ 14], 表明豫麦34在 Vrn-B1位点为等位变异 Vrn-B1b类型(图2)。
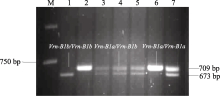
以豫麦34×皖麦33的F2代基因组DNA为模板, 用Intr/B/F与Intr1/B/R3引物对进行PCR扩增, 获得3种条带类型(图3)。其中仅扩增出709 bp特异产物的为 Vrn-B1a类型, 仅扩增出673 bp特异产物的为 Vrn-B1b类型, 同时扩增出两者的为杂合型。
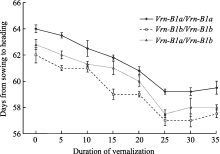
方差分析表明, 3种等位变异组成、8种低温春化处理时间互作对群体后代抽穗期的影响达到显著水平。不同持续时间的低温春化处理, 均可使F2植株的抽穗期提前(图4)。纯合等位变异 Vrn-B1a在不同低温春化处理后均比纯合 Vrn-B1b群体后代的平均抽穗期晚约2 d, 差异显著( P<0.05), 而杂合后代的平均抽穗期介于两纯合等位变异类型之间。
在未经春化处理条件下, 纯合等位变异 Vrn-B1a群体后代的平均抽穗期为64d, 纯合等位变异 Vrn-B1b群体后代的平均抽穗期为62 d, 杂合等位变异 Vrn-B1a/Vrn-B1b群体后代的平均抽穗期为62.8 d。低温春化处理时间从5 d至25 d, F2代3种等位变异组成后代的平均抽穗期均随着春化处理时间延长呈缩短趋势, 在春化处理25 d时抽穗期缩短的程度最大, 即春化的作用最为明显。在低温春化处理0~25 d中, 纯合等位变异 Vrn-B1a群体后代不同春化处理时间的抽穗期均存在显著差异( P<0.05)。春化处理0 d与其他处理相比, 纯合等位变异 Vrn-B1b群体后代抽穗期的差异显著( P<0.05), 但在春化处理5 d与处理10 d、15 d与20 d之间差异不显著; 而杂合等位变异 Vrn-B1a/Vrn-B1b群体后代不同春化处理时间的抽穗期均存在显著差异( P<0.05)。当春化处理超过25 d时, 群体后代的抽穗期均与25 d低温春化处理没有显著差异( P>0.05)。上述分析表明, 等位变异 Vrn-B1a和 Vrn-B1b的群体后代随着低温春化处理时间延长抽穗期明显缩短, 但进一步再延长低温春化处理时间抽穗期不再显著变化, 说明两等位变异完成春化阶段所需的低温处理时间在20~25 d之间。
利用引物Intr/B/F和Intr1/B/R4对228个黄淮冬麦区小麦品种进行PCR扩增, 其中214个品种扩增出1149 bp的条带, 说明这些品种携带隐性等位变异 vrn-B1, 占总品种数的93.9%; 再利用引物Intr/B/F和Intr1/B/R3进行PCR扩增, 共14个扩增出特异性条带的品种(表1), 说明这些品种携带显性等位变异 Vrn-B1, 占总品种数的6.1%。其中6个扩增出709 bp条带, 为等位变异 Vrn-B1a, 占总品种数的2.6%; 8个扩增出673 bp条带, 为等位变异 Vrn-B1b, 占总品种数的3.5%。由此可见, 在黄淮冬麦区小麦品种内, Vrn-B1位点3种等位变异的总体分布不同(表1)。显性等位变异 Vrn-B1a出现在安徽、山西、河北、陕西和河南的小麦品种中, Vrn-B1b主要集中在河南品种中, 而在山东和江苏的品种中均为隐性等位变异 vrn-B1, 说明3种等位变异在黄淮冬麦区不同省份小麦品种中的分布也不同(表1)。
| 表1 Vrn-B1位点等位变异在黄淮冬麦区不同省份分布 Table 1 Distribution of Vrn-B1 alleles in wheat cultivars from different provinces of the Yellow and Huai River Valleys Facultative Wheat Zone |
Vrn-B1位点两种显性等位变异在黄淮冬麦区不同时期的品种间分布比率也不同(表2)。1950—1980年经历了4次品种更换, 但小麦品种 Vrn-B1位点均为隐性等位变异 vrn-B1。1981—1988年是第5次品种更换阶段, 有2个品种检测为 Vrn-B1b型, 豫麦28 为最早审定的 Vrn-B1b品种。1989—2000年, 先后经历过第6和第7次品种更换, 有4个品种为 Vrn-B1a型, 皖麦33是最早育成的该类型品种, 此外, 还有5个品种为 Vrn-B1b型。2001—2006年是第8次品种更换阶段, 发现2个品种为 Vrn-B1a型, 1个品种为 Vrn-B1b型。
Milec等[ 17]研究发现, 在田间自然条件下等位变异 Vrn-B1a与 Vrn-B1b抽穗期之间没有明显差异。本研究在高温长日照可控温室条件鉴定表明, 两者在不同低温春化处理时间条件下抽穗期之间均存在显著差异。这可能是种植环境, 尤其是温度和光照条件不同造成的。小麦抽穗早晚除受春化基因控制外, 也会受到光周期( Ppd)基因和自身生长( Esp)基因的影响[ 4]。本文在研究 Vrn-B1位点等位变异低温春
| 表2 含显性等位变异 Vrn-B1a和 Vrn-B1b品种 Table 2 Wheat cultivars with dominant alleles Vrn-B1aand Vrn-B1b from the YHRVWWZ |
化效应时, 群体后代的两个亲本在已知光周期基因和其他春化基因位点的组成相同, 同时在可控温室进行抽穗期鉴定, 采用长日照(16 h昼/8 h夜)满足了 Ppd基因对光照时间的需求, 排除了光照时间不足对表现鉴定结果影响, 利用较高温度(22±3℃)又避免了生长过程低温自然春化的发生, 长日照和较高温度同时满足了不同 Esp基因型品种对生长光温的需求, 使表型鉴定的结果仅与供试材料的春化基因 Vrn-B1位点有关。在大田对抽穗期或开花期鉴定, 温度较难控制, 夜间出现的较低温度可能会引起小麦自然春化过程而使鉴定结果产生误差; 较短日照、其他春化基因与光周期基因组成的遗传背景差异也会影响抽穗期鉴定结果的准确性。本研究发现, 在不同低温春化处理后, 含等位变异 Vrn-B1a后代的抽穗期比含 Vrn-B1b的晚约2 d; Shcherban等[ 15]研究表明, 含等位变异 Vrn-B1a后代的抽穗期比含 Vrn-B1c的晚约14 d。结合Shcherban等[ 16, 28]与本研究的结果, 推测 Vrn-B1位点等位变异的抽穗期为 vrn-B1> Vrn-B1a> Vrn-B1b> Vrn-B1c。
本研究对两种等位变异序列比对结果与前人研究一致, 即等位变异 Vrn-B1b比 Vrn-B1a在第一内含子中8496~8532 bp处缺失36 bp片段的碱基。已有研究证明, 内含子区域碱基片段的插入或缺失与表型特征密切相关。由于内含子片段的缺失和插入, 造成 Vrn-B1c转录水平提高, 进而引起等位变异 Vrn-B1c比 Vrn-B1a提前抽穗[ 16]。 Vrn-B1b等位变异作用可能与之类似, 由于内含子部分碱基的缺失, 可能造成转录水平提高进而积累产物超过阈值引起提前抽穗。对等位变异 Vrn-B1b的研究, 需要进一步分析与小麦阶段发育的关系, 并利用qRT-PCR等技术分析基因在各时段的表达情况, 进而从基因表达水平揭示等位变异 Vrn-B1b的分子机制。
小麦春化基因组成在不同国家和地区的差异, 反映了不同环境对品种的要求不同, 是小麦环境适应性的分子基础[ 29, 30]。合适的春化基因组成, 对秋播冬小麦抗寒和高产尤为重要[ 31, 32]。春化基因控制小麦生长发育进度, 防止小麦秋季播种后遇到持续高温或暖冬引起发育提前甚至冬前拔节而遭遇冬季低温受冻, 从而确保小麦经过冬季低温完成春化阶段后来年抽穗开花。冬小麦品种春化基因的组成和分布与推广地区冬季寒冷程度有关, 尤其与1月平均温度等因素有直接联系[ 23, 24]。根据中国气象局网(http://www.cma.gov.cn/2011qxfw/2011qsjcx/)数据, 1997—2006年黄淮冬麦区各省份1月平均最低温度为山西<河北<陕西<河南, 而等位变异 Vrn-B1a在各省份比例为山西>河北>陕西>河南, 表明4个省份1月平均最低温度与等位变异 Vrn-B1a分布比率呈相反趋势; 相反, 随着省份1月平均最低温度降低, 等位变异 Vrn-B1b的分布比例随之降低。山西、河北、陕西和河南主要属于大陆性气候, 冬季寒冷干燥; 而安徽和江苏属于温带向亚热带过渡的地区, 气候温暖湿润, 冬季1月平均温度较高; 山东地处沿海全省温暖湿润, 形成暖温带季风气候, 冬季温差明显小于大陆性气候, 因此, 山东、安徽和江苏省份显性等位变异 Vrn-B1a和 Vrn-B1b分布不符合上述4个大陆性气候省份的特点。
黄淮冬麦区小麦品种冬春习性的变化, 随着历史进程中当地气候条件等因素的演变呈现规律性变化[ 33, 34]。总体说来, 随着黄淮冬麦区8次品种更换, Vrn-B1位点显性等位变异频率随该地区小麦品种生长习性呈现出先升高后降低的变化特点(表2)。1950—1962年, 绝大部分品种为农家品种, 多为冬性或半冬性, 均含有隐性等位变异 vrn-B1。1963—1980年, 春性及弱冬性品种逐渐增多。1981—1988年第5次更换的品种中, 改良品种占主导地位, 加之耕作制度变化, 对品种的早熟性提出了较高要求, 选育推广品种的春性逐渐增强; 在该阶段出现 Vrn-B1位点显性等位变异 Vrn-B1b类型的品种“豫麦28”, 这是由优质红粒春小麦品种“中作8131-7”中选出的白粒早熟品种。1989—2000年, 我国北方冬季气候变暖, 进一步促使选育偏春性特性的品种增多, 因而黄淮冬麦区第6和第7次更换的品种中, 品种冬性逐渐减弱, 弱冬性、春性品种比重上升[ 34], 此时携带 Vrn-B1位点显性等位变异的小麦品种比率增加, 并且对低温春化处理要求较弱的等位变异 Vrn-B1b比例明显高于对低温春化处理要求较强的等位变异 Vrn-B1a。近年来, 倒春寒频繁发生, 在小麦育种工作中又开始重视抗寒防冻特性品种的选育[ 33, 34], Vrn-B1位点携带显性等位变异品种的平均比率降低, 使得等位变异 Vrn-B1a在显性等位变异内相对比例又逐步提高。综合等位变异 Vrn-B1a和 Vrn-B1b的效应、气候变化及黄淮冬麦区小麦品种更换的规律分析, 在未来该地区选育和推广中含有 Vrn-B1位点显性等位变异品种比例会逐渐减少, 而等位变异 Vrn-B1a在显性等位变异内的相对比例可能逐步高于 Vrn-B1b; 育种工作者在选用亲本时, 选育抗寒防冻品种可以考虑选择冬性更强的等位变异 Vrn-B1a品种, 而缩短品种生育期可以选择等位变异 Vrn-B1b。本研究只针对 Vrn-B1位点等位变异 Vrn-B1a和 Vrn-B1b的春化作用效应和在黄淮麦区推广品种中的分布, 还需要进一步选择相关品种和亲本, 开展两种等位变异来源的系谱分析, 揭示等位变异的来源和育种利用价值; 同时, Vrn-D1也是黄淮冬麦区的主要春化基因之一, 进一步研究 Vrn-D1位点等位变异效应及两位点的互作与分布特点, 有助于揭示黄淮冬麦区小麦春化基因的分布特点。
不同低温春化处理均可促进显性等位变异 Vrn-B1a和 Vrn-B1b小麦的抽穗, 两者的抽穗时间不同, 完成春化阶段的低温处理时间为20~25 d。在黄淮冬麦区小麦品种的春化基因 Vrn-B1位点中, 存在显性等位变异 Vrn-B1a和 Vrn-B1b, 两者在该麦区各省份品种中的分布不同。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|



 UTR compared with the winter allele. The Vrn-A1b allele was found in both tetraploid and hexaploid accessions but at a relatively low frequency. Among the tetraploid wheat accessions, we found two additional alleles with 32 bp and 54 bp deletions that included the HDD region. We found no size polymorphisms in the promoter region among the winter wheat varieties. The dominant Vrn-A1 allele from two spring varieties from Afghanistan and Egypt (Vrn-A1c allele) and all the dominant Vrn-B1 and Vrn-D1 alleles included in this study showed no differences from their respective recessive alleles in promoter sequences. Based on these results, we concluded that the VRN-1 genes should have additional regulatory sites outside the promoter region studied here.
UTR compared with the winter allele. The Vrn-A1b allele was found in both tetraploid and hexaploid accessions but at a relatively low frequency. Among the tetraploid wheat accessions, we found two additional alleles with 32 bp and 54 bp deletions that included the HDD region. We found no size polymorphisms in the promoter region among the winter wheat varieties. The dominant Vrn-A1 allele from two spring varieties from Afghanistan and Egypt (Vrn-A1c allele) and all the dominant Vrn-B1 and Vrn-D1 alleles included in this study showed no differences from their respective recessive alleles in promoter sequences. Based on these results, we concluded that the VRN-1 genes should have additional regulatory sites outside the promoter region studied here.