第一作者联系方式: E-mail:lijianbo199061@163.com
小麦新种质CH7124由八倍体小偃麦TAI8335与高感白粉病小麦品种晋麦33杂交后代衍生而来, 在苗期对白粉病菌株E09、E20、E21、E23、E26、Bg1和Bg2表现免疫或高抗, 抗病表现与TAI8335及其野生亲本中间偃麦草相似。基因组原位杂交未检测到CH7124含有外源染色体信号。利用CH7124与感病亲本SY95-71和绵阳11的杂交群体接种鉴定和遗传分析证实, CH7124成株期对E09的抗性由1对显性核基因控制, 暂命名为 PmCH7124。采用分离群体分组分析法(bulked segregant analysis, BSA) 对SY95-71/CH7124的F6群体进行SSR标记扫描, 发现抗性基因 PmCH7124与5对SSR标记连锁, 与两翼邻近标记 Xgwm501和 Xbarc101的遗传距离分别为1.7 cM和4.5 cM。利用中国春缺体-四体和双端体材料, 将 PmCH7124及其连锁标记定位在小麦2B染色体长臂上。通过分析2BL上其他抗白粉病基因的抗谱、抗性来源、物理图谱位置以及连锁标记在 PmCH7124作图群体中的多态性, 认为 PmCH7124不同于2BL上已知的抗白粉病基因 Pm6、 Pm33、 PmJM22、 MlZec1、 MlAB10和 MlLX99。
Wheat introgression line CH7124 derived from a cross between wheat- Thinopyrum intermedium line TAI8335 (resistant to powdery mildew) and common wheat variety “Jinmai 33” (susceptible to powdery mildew) exhibits immunity to Blumeria graminisf. sp. tritici ( Bgt) pathotypes E09, E20, E21, E23, E26, Bg1, and Bg2 at the seedling stage. The Bgt resistance in CH7124 is similar to that in TAI8335 and its wild parent Th. intermedium. However, no Th. intermedium chromatin has been detected according to genome in situ hybridization (GISH) assay. In this study, we determined the single dominant Bgt resistance gene in CH7124, tentatively designated PmCH7124, using populations derived from SY95-71/CH7124 (F6) and CH7124/Mianyang 11 (F1 and F2). Five SSR markers ( Xgwm47, Xgwm120, Xwmc332, Xgwm501, and Xbarc101) were identified to be codominant with PmCH7124 according to bulked segregant analysis, and the closely flanking markers were Xgwm501 and Xbacr101with genetic distances of 1.7 cM and 4.5 cM, respectively. The target resistance gene was chromosomally located on 2BL with Chinese Spring nulli-tetrasomicand ditelosomic lines. We primarily consider that PmCH7124is a new Bgt resistance gene because its resistance spectrum, origin, chromosomal location, and linked markers are different from those of the known Bgt resistance genes, such as Pm6, Pm33, PmJM22, MlZec1, MlAB10, and MlLX99.
小麦白粉病是由Blumeria graminis f. sp. tritici (Bgt)引起的世界性小麦病害, 在我国各小麦主产区常年发生, 随着小麦品种矮化、种植密度加大和生产条件的改善, 小麦白粉病危害日趋严重。发掘抗病基因、培育和推广抗病品种是减少白粉病损失最经济有效的方法[1]。迄今为止, 国内外已在小麦基因组的46个基因座(Pm1~Pm50、Pm18= Pm1c、Pm22 = Pm1e、Pm23 = Pm4c、Pm31 = Pm21)鉴定出60多个正式命名的抗白粉病基因[2], 其中, Pm6[3]和Pm33[4]被定位在小麦染色体2BL上。此外, PmJM22[5]、MlZec1[6]、MlAB10[7]和MlLX99[8]等抗白粉病基因也被定位在2BL上。一些抗白粉病基因, 如Pm2、Pm4a、Pm8和Pm21, 已成功应用于小麦育种和生产。然而, 由于小麦白粉病病原菌致病型多, 毒性基因变异快, 大多数抗病品种在推广应用3~5年即开始丧失抗性[9]。因此, 持续发掘和利用小麦品种及其近缘种属中的抗白粉病新基因尤为重要。
中间偃麦草(Thinopyrum intermedium, 2n = 42, JJJsJsStSt)是多年生小麦野生近缘植物, 对小麦白粉病、锈病等病害表现免疫或高抗[10]。近几年, 已从普通小麦与中间偃麦草的杂交后代中获得抗白粉病的小偃麦异附加系、异代换系、易位系[11, 12], 并从普通小麦与中间偃麦草的杂交后代中鉴定出抗白粉病新基因Pm40[13]、Pm43[14]和pmCH83[15]。CH7124是八倍体小偃麦TAI8335与感白粉病的普通小麦品种晋麦33杂交、再与冀麦26回交得到的新品系[12], 经温室接种鉴定, 对白粉病表现免疫。本研究旨在通过遗传分析、原位杂交及分子标记定位, 确定CH7124所含外源染色体片段的大小及其抗白粉病基因所在染色体位置, 为更好地利用该抗源种质提供理论依据。
苗期抗性鉴定材料包括中间偃麦草Z1141和八倍体小偃麦TAI8335 (晋春5号/中间偃麦草//晋麦33)、CH7124 (晋麦33/TAI8335//冀麦26* 2)及其小麦亲本, 感病小麦品系SY95-71和感病对照品种京双16。利用SY95-71/CH7124 F6群体(单粒传后代)、CH7124/绵阳11的F1和F2群体进行抗病性遗传分析和抗病基因定位。CH7124、中国春和中间偃麦草用于细胞学鉴定。上述材料均由山西农业科学院作物科学研究所提供。另外, 用于分子标记的中国春缺体-四体材料和双端体材料均由美国堪萨斯州立大学小麦遗传资源中心提供。
苗期抗性鉴定所用白粉病菌株为E09、E20、E21、E23、E26、Bg1和Bg2, 成株期抗性遗传分析所用白粉菌株为E09。其中E09、E20、E21、E23和E26由中国农业科学院植物保护研究所段霞瑜研究员提供, Bg1和Bg2由中国农业科学院作物科学研究所李洪杰研究员提供, 均在本实验室保存。
将种子置培养皿中, 在22℃培养箱中萌发, 待根长1~2 cm时剪取根尖, 放入冰水中预处理24 h, 然后用卡诺氏固定液(无水乙醇∶ 冰醋酸=3∶ 1)固定24 h, 在45%醋酸中压片, 液氮冷冻揭片, 放入80℃超低温冰箱保存备用。参照Chang等[16]描述的方法进行基因组原位杂交(GISH)。用缺刻平移法标记Fluorescent-12-dUTP的中间偃麦草基因组总DNA作为探针, 用普通小麦中国春(CS)基因组DNA作为封阻; 杂交液中探针、封阻DNA的浓度比率为1∶ 120, 用碘化丙啶(PI)复染杂交后的载玻片, 用抗退色剂(antifading agent)封片, 用莱卡RA-2型荧光显微镜(Leica Microsystems, 德国)观察杂交信号并拍照。
1.3.1 苗期鉴定 将中间偃麦草、TAI8335、CH7124及各小麦亲本分别播于纸杯内, 放在长70 cm、宽50 cm、高20 cm的塑料盒中, 罩上透明塑料棚以防交叉污染, 在自然光照、温度15~22℃下待小麦植株生长至第1片叶完全展开后, 用扫拂法充分接种白粉菌菌株E09、E20、E21、E23、E26、Bg1和Bg2的分生孢子, 每个塑料盒接种一个菌株。7~ 10 d后当感病对照京双16充分发病时, 采用0~4级标准调查第1片叶的反应型[17], 其中0级为免疫, 0; 级为近免疫, 1、2、3和4级分别代表高抗、抗、感和高感类型。
1.3.2 群体成株期鉴定 2013年在温室内, 对SY95-71/CH7124的F6群体, 以及CH7124/绵阳11的F1和F2群体接种白粉病菌株E09, 鉴定成株期抗性。于11月上旬单粒播种供试材料, 行长1.2 m, 行宽25 cm, 每隔10行设置一行感病对照(京双16), 每隔15行设置一行诱发材料(SY95-71)。从拔节期开始, 在感病对照和诱发材料上接种E09。
当病菌大量繁殖后, 采集菌种抖洒在待鉴定材料叶片上, 同时借助诱发行诱发感染。按叶部病害0~9级法进行抗病性分级, 在小麦抽穗期和开花期各调查一次, 以发病最重的一次作为最终抗性评价依据。其中0级为免疫, 0; 级为近免疫, 1~2级为高抗, 3~4级为中抗, 5~6级为中感, 7~8级为高感, 9级为极感。将0~4级记为抗病, 5~9级记为感病[18]。根据F1、F2和F6家系植株的抗性表现和分离比例, 确定CH7124中所含抗白粉病基因的数目和显隐性, 用SAS8.0作卡方适合性检测。
在三叶期剪取SY95-71/CH7124 F6单株及其亲本的叶片, 采用SDS法提取基因组总DNA。采用分离群体分组分析法(bulked segregant analysis, BSA)在F6群体中随机选取来自不同家系的10株抗病植株和10株感病植株, 分别将其DNA等量混合建立抗病池和感病池。
根据GrainGenes (http://www.wheat.pw.usda.gov/)公布的引物序列, 选取569对分布于小麦21条染色体的SSR引物[19]先后在亲本材料和抗感池间筛选多态性。根据初筛结果, 增补差异标记所在染色体上的其他多态性SSR引物, 利用作图群体进行目标基因的连锁分析。根据初步定位结果, 利用作图群体的亲本和抗感池, 对目标基因所在染色体臂上的已知抗白粉病基因的连锁标记进行多态性鉴定。
PCR总体系为20 μ L, 含2 μ L 10× buffer (10 mmol L-1 Tris-HCl, pH 8.3, 50 mmol L-1 KCl, 1.5 mmol L-1 MgCl2)、0.2 mmol L-1 dNTP、1 U Taq酶、0.25 μ mol L-1引物(由北京华大基因公司合成)和100 ng模板DNA。反应扩增程序为94℃变性5 min; 94℃变性45 s, 50~60℃ (因引物不同而异)复性45 s, 72℃延伸 1 min, 共35个循环; 72℃延伸10 min。对扩增产物用8%非变性聚丙烯酰胺凝胶(Acr与Bis质量比为29∶ 1)电泳, 经硝酸银染色后观察照相。
用Kosambi函数计算分子标记与目标基因的遗传距离(cM), 使用JoinMap 4.0软件构建遗传连锁图谱。
野生亲本中间偃麦草和TAI8335对所有菌株表现免疫(IT=0)或近免疫(IT=0; ), CH7124的抗病表现与TAI8335和中间偃麦草相似(表1)。CH7124对E09、E21、E23、E26、Bg1表现免疫或近免疫, 对Bg2表现高抗(IT=1); TAI8335和CH7124的3个小麦亲本晋春5号、晋麦33、冀麦26均感白粉病(IT = 3~4)。
| 表1 供试材料苗期对7个小麦白粉菌菌株的抗性反应 Table 1 Seedling infection types in selected donor lines, parents and the controls to seven Bgtpathotypes |
以中间偃麦草基因组DNA为探针、中国春基因组DNA为封阻, 对CH7124根尖细胞的染色体进行基因组原位杂交。共观察到42条蓝色的完整染色体, 并未发现黄绿色的中间偃麦草染色体或片段。
| 表2 小麦CH7124/绵阳11杂交组合不同世代群体对白粉菌菌株E09的成株期抗性分离 Table 2 Segregation of resistance to Bgt pathotypes E09 in different populations derived from the CH7124/Mianyang 11 cross |
CH7124/绵阳11的F1植株在成株期对白粉病菌株E09免疫或近免疫, 且具有与其抗病亲本CH7124相似的侵染型(IT=0或0; )。在CH7124/绵阳11的F2群体中, 抗病(免疫、近免疫、高抗和中抗)个体为91株, 感病(高感和极感)个体为31株, 经卡方测验, 抗、感分离比符合3∶ 1的理论比例(χ 2=0.01, P> 0.05)。另外, 在SY95-71/CH7124的F6群体中, 抗感分离比为59R:53S, 卡方测验符合1∶ 1的理论比例(χ 2=0.16, P> 0.05)。上述结果表明, CH7124对白粉菌E09菌株的成株抗性由1对显性核基因控制, 暂将其命名为PmCH7124。
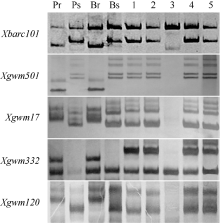
在所选的569对SSR引物中, 174对(30.6%)在亲本CH7124和SY95-71间存在多态性, 其中只有位于2B上的Xgwm47、Xgwm120和Xwmc332在抗、感池间呈现多态性。再利用2B染色体上的其他53对SSR引物进一步筛选, 发现Xgwm501和Xbacr101在抗、感亲本和抗、感池间有多态性。这5个SSR多态性标记在中国春缺体-四体材料N2A-T2B、N2D-T2A和双端体材料Dt2BL中均能扩增出预期条带, 但在N2B-T2A中无目标产物, 证实与PmCH7124连锁的SSR标记位于2BL上(图1)。
利用上述5个连锁标记对SY95-71/CH7124 F6群体的112个单株进行DNA扩增, 其中抗病单株与抗病亲本和抗病池带型一致, 感病单株与感病亲本和感病池带型一致(图2), 抗、感带型比例符合1∶ 1的分离模式(χ 2=0.11, P> 0.05)。通过连锁分析, 将PmCH7124初步定位于2B染色体长臂(图3)。PmCH7124两侧临近标记为Xgwm501和Xbarc101, 遗传距离分别为1.7 cM和4.5 cM (图3-a)。
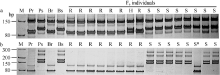 | 图2 PmCH7124侧翼SSR标记Xbarc101 (a)和Xgwm501(b)在SY95-71/CH7124 F6群体中的扩增图谱Fig. 2 Amplification profiles of Xbarc101 (a) and Xgwm501(b), the flanking SSRs of PmCH7124 in SY95-71/CH7124 F6 population |
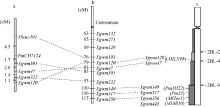 | 图3 PmCH7124的遗传定位(a)及其与已有SSR标记图谱(b)[19]和物理图谱(c)[8]的比较Fig. 3 Genetic mapping of PmCH7124(a) and comparison with genetic map with SSR markers (b) and physical maps (c) |
选取小麦2BL染色体上的已知抗白粉病基因Pm6、Pm33、PmJM22、MlZec1、MlAB10和MlLX99的连锁标记进行多态性鉴定显示, 与Pm6紧密连锁的标记XCINAU123和XCINAU127[20]在群体亲本SY95-71和CH7124间存在差异, 但在抗、感池中无多态性(表3)。此外, Xwmc317 (Pm33) [4]、Xwmc149 (PmJM22) [5]、Xwmc356 (MlZec1) [6]和Xwmc445 (MlAB10) [7]在亲本和抗、感池间均无差异, 与PmCH7124不连锁。而在MlLX99的5个连锁标记中, Xgwm120和Xgwm47与PmCH7124连锁。Xgwm120、Xgwm47与MlLX99的遗传距离分别为2.9 cM和16.6 cM [8], 在本实验中与PmCH7124的遗传距离分别为6.2 cM和3.7 cM (图3-a)。
| 表3 小麦2BL上其他抗病基因连锁标记在SY95-71/CH7124 F6作图群体中的多态性 Table 3 Polymorphism of SSR markers associated with known Bgt resistance genes on chromosome 2BL in the SY95-71/CH7124 F6 mapping population |
由于小麦白粉病病原菌致病型多、变异快, 大多数小麦抗病品种在推广应用3~5年即开始丧失抗性。曾被广泛应用的Pm8在20世纪80年代丧失抗性, 对E09、Bg1、Bg2、E23、E26等菌株均感病; Pm4a也逐渐开始对E20、E21、E26等菌株感病[4, 21]。目前抗谱较广且抗性最稳定的Pm21, 也有可能由于广泛用于育种而导致新型致病菌菌株的出现。
CH7124是以八倍体小偃麦TAI8335为抗病亲本与普通小麦杂交、回交选育的品系, 具有与普通小麦一致的染色体数目, 细胞学稳定性强, 其所含的抗白粉病基因PmCH7124对E09、E20、E21、E23和E26菌株均表现免疫, 对Bg1和Bg2表现近免疫或高抗, 因此可作为一个白粉病新抗源用于小麦品种改良或抗病种质创新。但由于单基因遗传行为及其所具有的垂直抗性极有可能被以后新的致病类型菌株所克服, 因此在利用PmCH7124时应考虑与其他有效抗病基因相结合, 以便延长该基因资源的使用寿命。
八倍体小偃麦TAI8335 (ABD+J+Js+St)的外源基因组包含其野生亲本中间偃麦草(JJJsJsStSt)的所有染色体类型[16], 其中, St组染色体上可能不含抗白粉病基因[22]。抗谱鉴定表明, CH7124与TAI8335及中间偃麦草具有相似的侵染型, 而其所有小麦亲本均高感白粉病, 表明抗白粉病基因很可能来自异源六倍体中间偃麦草Z1141的J组或Js组染色体。但是在CH7124中并未检测到外源杂交信号, 这可能由于中间偃麦草的J/Js基因组与小麦染色体存在较高的同源性[23], 加之偃麦草染色体携带的促配基因[24], 使得在导入外源基因的过程中, J/Js组染色体与小麦染色体之间能发生高水平的染色体配对, 并使重组后的染色体在结构上更接近于小麦, 导致对外源片段往往难以用细胞学方法识别。类似结果也曾被报道过[25, 26, 27]。我们曾利用PmCH7124两侧的连锁标记Xbarc101和Xgwm501对Z1141和TAI8335进行DNA扩增, 未观测到一致的抗性带型, 因此, PmCH7124的来源还需进一步证实。
本研究利用分子标记将PmCH7124定位于小麦的2B染色体长臂上。迄今, 小麦2BL染色体上的已知抗白粉病基因有Pm6、Pm33、PmJM22、MlZec1、MlAB10和MlLX99。其中, Pm6来源于提莫菲维小麦(T. timopheevii), 对白粉菌菌株Bg1、Bg2和E23表现感病[17], 而PmCH7124则对Bg1、Bg2和E23分别表现近免疫、高抗和免疫; 而且Pm6的连锁标记XCINAU123和XCINAU127与PmCH7124不连锁, 说明PmCH7124与Pm6不是同一基因。Pm33来源于波斯小麦(T. carthlicum), 对白粉菌菌株Bg2和E20表现感病[8, 28], 而PmCH7124对Bg2和E20分别表现高抗和免疫; Pm33的连锁标记Xwmc317与PmCH7124不连锁, 所以二者也不相同。来源于普通小麦(T. aestivum)品种济麦22的PmJM22和来源于野生二粒小麦(T. dicoccoides)的MlZec1、MlAB10均被定位在2BL-6-0.89-1区间, 与Pm6和Pm33位于同一区段[5, 8](图3-c)。根据分子标记鉴定结果, 这3个基因的连锁标记均不与PmCH7124连锁, 因此PmCH7124也不同于PmJM22、MlZec1和MlAB10。
MlLX99来自普通小麦品种良星99 (济91102/鲁麦14//PH85-16), 被定位于2BL2-0.36-0.50区间[8], 已被正式命名为Pm52 (李洪杰, 私人通讯, 2014)。分子鉴定表明, MlLX99的2个连锁标记Xgwm120、Xgwm47与PmCH7124连锁, 遗传距离分别为6.2 cM和3.7 cM。由于PmCH7124与MlLX99的抗性来源不同, 因此, 推测两者可能为1对等位基因, 但需要通过等位性分析予以验证。
总之, 从抗病基因的抗谱、抗性来源、物理图谱位置和连锁标记分子鉴定等方面来看, PmCH7124不同于2BL上的Pm6、Pm33、PmJM22、MlZec1、MlAB10和MlLX99, 很可能是MlLX99的等位基因。
小麦-中间偃麦草渗入系新种质CH7124对白粉病菌E09免疫, 成株期抗性表现受1对显性核基因PmCH7124控制。该基因被初步定位在小麦2B染色体长臂上, 位于SSR标记gwm501和barc101之间, 遗传距离分别为1.7 cM和4.5 cM, 并且不同于2BL上已报道的其他白粉病抗病基因。
致谢: 山西省农业科学院植物保护研究所原宗英研究员对抗性鉴定给予大力帮助和指导, 谨致谢忱。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|