气孔是植物叶片表面控制大气与植物间气体交换的孔状结构, 对于生态系统碳、水循环过程的调节起着非常重要的作用。本文利用典型农田生态系统实验增温平台, 研究了未来气候变暖对玉米叶片的气孔特征(包括气孔频度、气孔开口大小和形状以及气孔分布格局)和气体交换过程的影响。结果表明: (1)尽管增温并没有改变气孔密度( P>0.05), 但却由于表皮细胞数目的减少导致气孔指数显著增加12% ( P<0.05); (2)增温使气孔开口的长度显著减小18% ( P<0.01), 宽度增加26% ( P<0.01), 面积和周长分别增加31% ( P <0.01)和13% ( P<0.05); (3)实验增温还使单个气孔之间最近邻域的平均距离显著增加, 表明气孔在玉米叶片上的分布变得更加均匀; (4)增温导致玉米叶片的净光合反应速率( Pn)、气孔导度( Gs)和蒸腾速率( Tr)分别增加52% ( P<0.05)、163% ( P<0.001)和81% ( P<0.05); 与此相反, 玉米叶片的暗呼吸速率( Rd)却显著降低24% ( P<0.01)。增温没有对细胞间CO2浓度( Ci)和水分利用效率(WUE)产生显著的影响( P>0.05)。本研究结果表明, 未来全球气候变暖可能通过改变玉米叶片的气孔频度、气孔开口大小和形状及其在叶片上的空间分布格局来改变其气体交换过程。
Stomata are the pores on leaf surfaces controlling gas exchanges, mainly CO2 and water vapor, between the atmosphere and plants, and thus regulate carbon and water cycles in various ecosystems. This study investigated the effects of experimental warming on the stomatal frequency, stomatal aperture size and shape, and stomatal distribution pattern, and their relationships with the leaf gas exchange rates of maize ( Zea may L.) leaves through a field manipulative warming experiment with infrared heaters in a typical agriculture ecosystem in the North China Plain. Our results showed that experimental warming had little effect on stomatal density, but increased stomatal index by 12% ( P<0.05) due to the reduction in the number of epidermal cells under the warming treatment. Warming also decreased stomatal aperture length by 18% ( P<0.01) and increased stomatal aperture width 26% ( P<0.01). As a result, experimental warming increased the average stomatal aperture area by 31% ( P<0.01) and stomatal aperture circumference by 13% ( P<0.05), and resulted in a more regular stomatal distribution on both the adaxial and abaxial surfaces in leaves with an increased average nearest neighbor distance between stomata. In addition, experimental warming also affacted the gas exchange of maize leaves. Experimental warming significantly increased net photosynthetic rate ( Pn), stomatal conductance ( Gs), and transpiration rate ( Tr) by 52% ( P<0.05), 163% ( P<0.001), and 81% ( P<0.05), respectively. Meanwhile, experimental warming decreased the leaf dark respiration ( Rd) by 24% ( P<0.01), but had no significant effects on intercellular CO2 concentration ( Ci) and water use efficiency (WUE; P>0.05). In conclusion, the experimental warming may affect the gas exchange of maize leaves through the changes of the stomatal traits including stomatal frequency, stomatal aperture size and shape, and stomatal distribution on leaves.
气孔是植物叶片表面控制大气与植物间进行CO2、水蒸气等气体交换的孔状结构[1, 2], 对于调节生态系统碳、水循环过程起着非常重要的作用[3, 4, 5]。就全球范围而言, 通过这种叶片与大气之间的气体交换过程植物每年大约在光合作用中固定440× 1015 g CO2和蒸发32× 1018 g H2O[6, 7]。植物叶片通过改变气孔频度(气孔密度及气孔指数)、气孔开度、气孔大小和气孔空间分布格局等特征来最优化其气体交换效率。植物叶片的气体交换效率量化的气孔导度来表征, 这主要由气孔大小、形状、频度以及空间分布格局所决定[8]。然而, 目前有关增温对叶片气孔频度及大小等方面特征的影响尚无定论。有些研究发现, 增温对植物叶片气孔密度和气孔指数均没有影响[9, 10, 11, 12]; 然而, 还有一些研究却发现增温可能导致气孔密度和气孔指数的减少或增加[13, 14, 15, 16, 17]。另据报道, 增温还能改变单个气孔的大小和形状[14, 18]。例如, Ferris等[14]的研究结果显示, 增温显著增加了多年生黑麦草(Lolium perenne)叶片的气孔长度; 然而, 张立荣等[18]的研究却发现增温使我国青藏高原4种亚高山草甸物种的叶片气孔长度减小。除了叶片气孔的数量、大小和形状之外, 增温还可能通过对细胞分裂和分化过程的影响来改变气孔在叶片上的空间分布格局[19, 20, 21]。同时, 细胞的分裂及分化过程也会受到遗传信号[22, 23]以及环境因素[24, 25]的调控和影响。另外, 气孔在植物叶片上的空间分布格局在物种间也呈现出较高的变异性[14, 15]。气孔在植物叶片上空间分布格局的变异性通常表现在多个尺度上, 例如近/远轴面的比例、同一叶面不同部位的变异、同一叶片单个气孔的变异[19, 20, 21]。早期的研究报道叶片近轴面和远轴面的气孔密度显著不同[14, 15, 19, 21, 26, 27, 28]; 气孔的空间分布格局在同一叶片的不同部位也呈现出较高的变异性[14, 16, 29, 30, 31, 32, 33]。此外, 叶片近轴面和远轴面的气孔密度也存在着显著的差异[14, 15, 19, 26, 27, 28]。
华北平原是我国最重要的粮食产区之一, 种植制度以玉米和小麦轮作系统为主, 每年全国大约50%的小麦和30%的玉米产自该区[34]。值得关注的是, 许多气候模型已经证实我国的气候正在逐渐呈现变暖的趋势, 特别是自从20世纪70年代以后我国北部地区(如华北平原)的气候呈现出年平均气温升高的特征[35]。这种区域甚至全球范围内的气候变暖势必改变粮食作物的蒸散和水分利用效率[36], 并进一步改变农作物的生长速率和粮食产量[37]。此外, 近年来的许多研究结果还表明, 全球变暖也会通过改变农作物的生长季而对其物候期产生深远的影响。例如, Tao等[38]的研究表明, 全球气候变暖导致作物产量形成的重要生长阶段(从开花到成熟)呈现延长的趋势[38]。Hou等[39]在华北平原的增温实验研究发现, 气候变暖将会缩短小麦的生长季, 但并不改变其生育期, 最终导致小麦产量减少。同样, 以往的研究结果已经发现气候变暖导致全球许多地区玉米产量的减少[40]。由此看来, 气候变暖对农作物产量的影响将会直接关系到未来区域/全球粮食供应的安全问题。然而, 目前全球气候变暖对作物产量产生影响的机制还不清楚。此外, 由于植物叶片表面分布的气孔是植物与大气之间进行气体交换的重要器官[1, 2], 它不仅控制着植物的光合、呼吸及蒸腾等关键的生理过程[3, 4, 5], 而且还最终决定着农作物的产量[37]。因此, 深入探讨作物叶片气孔结构特征及其气体交换过程对实验增温的响应有助于全面理解未来全球变暖对作物产量影响的潜在机制。
本研究通过开展野外增温控制实验, 利用光学显微镜、扫描电镜、空间分析技术等手段, 研究实验增温对华北平原重要作物玉米叶片的气孔特征(气孔频度、气孔开口大小和形状以及气孔的空间分布格局)及其气体交换过程的影响。这将对深入理解实验增温对玉米气孔特征影响机制具有重要的理论意义, 为预测未来气候变暖对农田生态系统结构和功能的影响提供重要的数据和理论支持。
中国科学院禹城综合试验站(36° 57′ N, 116° 38′ E, 海拔23.4 m)位于山东省禹城市, 属大陆性季风气候暖温带地区。年平均气温13.1℃, 1月平均温度-3℃, 7月平均温度26.9℃; 年平均降水量610 mm, 降水季节分配不均匀, 3月至5月平均降水量75.7 mm, 占年的12.4%, 6月至8月降水量平均为419.7 mm, 占年的68.8%。该实验站土壤质地以粉沙和轻壤为主; pH值为7.9~8.0; 土壤有机质含量较低, 为0.6%~1.0%; 全氮含量为0.050%~0.065%。从土壤自然条件看, 该站在华北平原具有典型代表性, 当地种植制度以冬小麦-夏玉米轮作为主。
在2009年9月份, 随机选取试验区内6个2 m × 3 m的样方用以布置增温实验。随机选取其中的3个样方作为增温组, 另3个样方为对照组。选取的3个增温样方从2009年11月18日开始利用悬挂于样方正上方距离地表2.25 m高度的MSR-2420型红外发射器(165.0 cm × 1.5 cm, Kalglo Electronics Inc., Bethlehem, PA)进行全天24 h不间断的连续增温处理(图1)。每个对照样方内同样在距离地面2.25 m高度处悬挂一个相同大小和形状的“ 伪” 红外增温装置模拟红外发射器对下方土壤产生阴影的效果。为了避免红外增温装置影响到对照样方, 增温样方和对照样方相距约5 m。于2011年6月24日将玉米种子(Zea may L. cv. Zhengdan 958)分别播种到增温和对照样地, 同时进行连续不间断的增温处理(全天24 h增温处理), 利用PT100热电偶系统(Unism Technologies Incorporated, Beijing, China)自动记录每小时2.25 m高度处的空气温度和5 cm深处的土壤温度。另外用红外温度计(FLUKE 574, Fluke Inc., USA)测量玉米冠层叶片表面的温度。在整个玉米生长季从2011年6月24日到10月7日, 相对于对照样地, 增温样地的空气温度和土壤温度在日间分别增加了(1.42± 0.18)℃和(1.68± 0.90)℃; 同时在夜间分别增加了(1.77± 0.24)℃和(2.04± 0.16)℃。增温样地的灌层温度相对于对照样地在日间增加(2.08± 0.72)℃。为避免干旱胁迫对玉米植株生长的影响, 在整个生长季利用地下水对增温和对照的各个样地内植株定期灌溉。同时, 利用FDS100土壤湿度传感器(Unism Technologies Incorporated, Beijing, China)监测样方内0~10 cm深度土壤湿度的变化状况。在整个监测时期, 对照样地10 cm深处土壤湿度为26%, 而增温样地10 cm深处土壤湿度为25%[39]。
为了确定玉米叶片最大的气孔开度, 气孔印迹样品的采集工作在气孔开张的最适环境条件下开展。2011年8月24日上午10:30— 11:00的天气晴朗, 空气温度约为32℃, 其自然环境条件对于气孔的开张是最理想的, 有理由认为此刻气孔具有最大的开张度。从3个对照样地和3个增温样地中各随机选取5棵玉米植株采样。由于玉米的穗位叶主要决定着玉米的产量, 本研究从上述选定的10株玉米中随机选取1片穗位叶(10个叶片)利用透明无色的指甲油分别从近轴面和远轴面的3个不同部位(基部、中部和尖部)采集面积为5 mm × 15 mm的气孔印迹样品, 共60个样品(10个叶片 × 3个部位 × 2个不同叶面 = 60个)用于气孔特征的观察和分析。
将上述叶片印迹玻片在装备有照相机(DFC 300-FX, Leica Corp, Germany)的莱卡光学显微镜(DM2500, Leica Corp, Germany)下观察并拍照。随机选择5个视野, 每个视野拍3张照片, 即在玉米叶片远轴面和近轴面的不同部位分别得到15张气孔的显微照片(面积为0.30 mm × 0.45 mm)。然后从其中随机选取5张计算气孔密度、表皮细胞密度及气孔指数, 即分别从玉米叶片的近轴面和远轴面得到75个气孔印迹显微照片(面积为0.30 mm × 0.45 mm)。再将照片综合到一起, 探讨增温对整个叶片气孔特征的影响。气孔和表皮细胞的密度用单位叶面积内气孔和表皮细胞的个数来表示。气孔指数=气孔数/(气孔数+表皮细胞数)× 100%。另外, 分别在上述每张照片上选取6个气孔和6个表皮细胞(共计为75个照片× 6个气孔/表皮细胞=450个气孔或表皮细胞), 利用Image J分析软件(NIH, USA)分别测量气孔和表皮细胞的长度、宽度、周长及面积[50, 51]。分别将这些数据综合在一起来研究叶片近轴面和远轴面气孔和表皮细胞特征对增温响应的差异。此外, 利用上述叶片近轴面和远轴面气孔和表皮细胞数据的平均值来代表整个叶片气孔和表皮细胞的特征。
从上述每个处理叶子的中部采集3个2 mm × 2 mm的叶片用于气孔及表皮细胞特征的扫描电镜观察。野外采集下来的玉米叶片立即利用2.5% (v/v)的戊二醛(0.1 mol L-1磷酸缓冲液, pH 7.0)固定样品, 放到4℃环境下冷藏保存, 并迅速将样品运回实验室, 再用相同浓度的磷酸缓冲液冲洗6次, 并在室温环境下用1% (v/v)锇酸固定3 h, 用同样的磷酸缓冲液冲洗干净。将该叶片组织经一系列浓度的酒精梯度脱水, 进行临界点干燥, 固定在观察台上, 利用高压涂膜装置喷金处理。最后, 用Quanta 200扫描电子显微镜(FEI Corp, USA)观察和照相。
分别从增温及对照叶片的扫描电镜照片中各随机选取3张(放大100倍)用于研究增温对叶片气孔空间格局的影响。在本项分析中, 认为每一个气孔都是玉米表面上分布的单点, 气孔开口的最中间位置是该单点的位置。首先利用空间分析软件ArcGIS 10.0 (ESRI Inc. USA)将所选的显微照片在相同的坐标系下进行数字化处理, 得到这3个叶片近轴面和离轴面上每一个气孔的坐标。然后, 利用空间统计分析方法Ripley’ s K-function对数字化后表征气孔分布状况的点进行空间分析[41]。Ripley’ s K-function是一个分布累加函数, 该函数利用所有单点距离的二阶矩阵探究这些点在不同尺度上的两维分布格局。分析结果由L(t)值来表达。
L(t)= 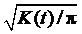
当该分布格局为泊松随机分布时, 所有的t值到L(t)的距离均相等。为了确定95%的可信任区间, 采用蒙特卡洛算法模拟随机分布点1000次。假如叶片表面的气孔在给定尺度t下为随机分布, 则计算出来的L(t)值应该位于95%可信任区间之内。假如L(t)值大于95%可信任区间, 则气孔在该尺度下为簇状分布。若L(t)值小于95%可信任区间时, 气孔在该尺度下为规则分布。
利用Li-6400便携式光合测定系统(LI-COR Inc. Lincoln, Nebraska, USA)测定玉米叶片的净光合速率、气孔导度和蒸腾速率等气体交换参数。该测定系统配套使用的2 cm × 3 cm标准气室能独立控制光合光量子通量密度(Photosynthetic Photon Flux Density, PPFD)、CO2浓度、叶片温度及气室湿度。测量时设定叶室内的光照强度为1500 μ mol m-2s-1光合有效辐射(Photosynthetically Active Radiation, PAR), 水蒸汽压亏缺(Vapor Pressure Deficit, VPD)控制为2.0 kPa, CO2浓度为380 μ mol mol-1, 叶片温度为25℃。
利用单因素和多因素方差分析方法分析增温对气孔特征的影响, 再用Duncan’ s multiple range test比较处理间的显著性差异(P< 0.05)。本研究中的统计分析均利用SPSS 13.0 (Chicago, IL)统计软件完成, 利用软件Sigmaplot作图。
增温显著增加了叶片的气孔指数(P< 0.05), 但并没有改变气孔密度(表1)。增温增加叶片气孔数约5%, 即由单位叶面积上67个增加为70个。然而, 增温环境下的气孔指数显著高于对照12% (P< 0.05)。
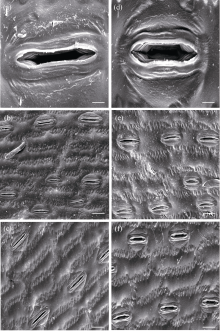
实验增温不但影响气孔密度和指数, 还影响气孔的张开度。增温显著减小气孔长度, 但增加气孔宽度。由于温度的升高叶片气孔长度显著减小了18% (P< 0.01; 表1); 而气孔宽度却显著增加了26% (P< 0.01; 表1)。上述结果同直接观察的结果相一致。通过光学显微镜和扫描电镜观察到增温条件下的玉米叶片与对照叶片相比具有更短、更宽的气孔开口(图2和图3)。另外, 增温分别增加了气孔的面积和周长31% (P< 0.01)和13% (P< 0.05), 还导致气孔面积指数(单位叶面积上的总气孔面积)显著升高40%, 但是对于气孔的形状指数没有显著的影响(P> 0.05; 表1)。
| 表1 增温对玉米叶片气孔结构特征的影响 Table 1 Effects of experimental warming on stomatal traits of maize leaves |
 | 图2 玉米叶片气孔和表皮细胞的光学显微照片 a: 对照; b: 增温; 标尺: 100 μ m。Fig. 2 Optical microscopic photographs of stomata and epidermal cells in maize leaves a: control; b: warming; Bar: 100 μ m. |
增温几乎没有对气孔密度的近轴面/远轴面比例产生影响(对照与处理的近轴面/远轴面气孔密度比例分别为0.72和0.73), 但却导致气孔指数的近轴面/远轴面比例约12%由0.71显著增加到0.80 (表1)。另外, 增温对玉米叶片不同部位(尖部、中部和基部)的气孔特征也产生了影响, 增加了近轴面基部和远轴面尖部的气孔密度(P< 0.05; 表2)。同时, 增温却显著减少了近轴面基部和中部以及远轴面中部的表皮细胞密度(P< 0.05)。因此, 相对于对照, 增温使近轴面基部和中部气孔指数分别增加约40%和25%, 远轴面中部气孔指数约增加10% (P< 0.05)。另外, 增温还分别使近轴面尖部和远轴面中部的气孔长度减小约30%和35% (P< 0.05)。相对于对照组, 增温分别导致叶片近轴面尖部和中部气孔宽度增加20%和40% (P< 0.05)。相似地, 增温也同时分别使远轴面尖部和中部的气孔宽度增加约30% (P< 0.05)。对于近轴面, 增温使叶片中部和基部的气孔面积显著增加34%和33%及气孔面积指数增加了28%和61% (P< 0.05)。增温分别使远轴面尖部、中部及基部的气孔面积增加43%、40%、30%以及使气孔面积指数增加61%、44%、32% (P< 0.05)。另外, 多因素方差分析的结果显示, 增温和叶片位置显著改变了玉米叶片的气孔密度、气孔指数、气孔长度、气孔宽度、气孔面积及气孔面积指数(P< 0.05)。
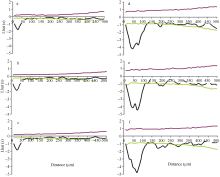
无论是对照还是增温环境条件下玉米叶片近轴面和远轴面气孔均在小尺度范围内为规则分布(< 140 μ m), 而在大尺度范围内呈随机分布特征(图3和图4)。然而, 远轴面的气孔分布比近轴面的气孔分布更加规则, 因为在相同尺度下远轴面的L(t)值更小, 尤其是在对照条件下(图4和图5)。对照温度下玉米叶片气孔最规则的分布格局发生在尺度约25 μ m处, 此时近轴面平均的最小L(t)为-1.81, 而远轴面平均的最小L(t)为-3.25。增温使玉米叶片近轴面和远轴面气孔的分布格局更加规则, 这主要体现在增温环境下玉米叶片的L(t)值比对照环境变得更小, 即近轴面平均的最小L(t)从-1.81减小为-4.43 (图4), 远轴面平均的最小L(t)从-3.25减小为-4.80 (图5)。另外, 增温还增加了玉米叶片气孔规则分布的尺度范围, 最规则分布的尺度约为60 μ m, 而对照条件下仅为25 μ m。
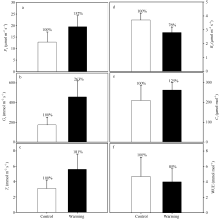
实验增温不仅改变了玉米叶片的气孔特征, 还对其气体交换过程产生了显著的影响(图6)。增温导致玉米叶片的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)增加, 同时使玉米叶片的暗呼吸速率(Rd)降低, 但却并没有改变叶片的细胞间CO2浓度(Ci)和水分利用效率(WUE)。实验增温使玉米叶片的净光合速率(Pn)增加约50% (P< 0.05), 气孔导度(Gs)和蒸腾速率(Tr)分别增加163% (P< 0.001)和81% (P< 0.05), 而使暗呼吸速率(Rd)降低约25% (P< 0.01)。此外, 实验增温增加玉米叶片的细胞间CO2浓度(Ci) 25% (P> 0.05)和降低叶片水分利用效率(WUE) 15% (P> 0.05), 但是该影响并没有达到显著水平。
| 表2 增温对玉米叶片上不同位置气孔特征的影响 Table 2 Effects of warming on the stomatal traits among different sections of maize leaves |
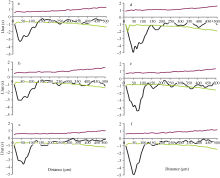 | 图5 玉米叶片远轴面气孔空间格局分析 对照环境下玉米叶片1、叶片2、叶片3远轴面(图4-a~c)气孔的空间格局; 增温环境下玉米叶片1、叶片2、叶片3远轴面(d~f)气孔的空间格局。 上、下2条包迹线代表95%的置信区间。Fig. 5 Spatial distribution pattern in the abaxial surface of maize leaves Point pattern analyses of stomata on the abaxial surface (a-c) in leaf 1, leaf 2, and leaf 3 of maize plants grown at ambient temperature and on those (d-f) at elevated temperature, respectively. The dotted lines give a 95% confidence envelope for complete spatial randomness. The data were given for three leaves from three ambient or warmed plots. |
气孔密度和气孔指数是确定叶片气体交换有效面积关键的生理生态参数, 直接决定着叶片潜在的最大气孔导度[1]。许多研究发现增温显著改变了气孔的密度, 但不影响气孔指数[13, 15, 16, 17]。然而, 另一些研究的结果显示增温并没有影响气孔密度, 却由于表皮细胞密度的变化而改变了气孔指数[14]。另外, 还有一些研究发现增温既不影响气孔密度也不改变气孔指数[9, 10, 11, 12]。本研究的结果表明, 增温主要是通过减少表皮细胞的数目而增加玉米叶片的气孔指数, 并不是直接影响单位叶面积内的气孔数目。另外, 增温导致玉米叶片表皮细胞密度减少9% (P< 0.05), 而表皮细胞面积增加35% (P< 0.01)直接支持了上述结论(表3)。此外, 扫描电子显微镜观察的结果也显示增温条件下玉米叶片表皮细胞与对照相比体积更大、数目更少(图2)。综上所述, 尽管全球变暖不会显著影响气孔数目, 但可能会通过直接影响表皮细胞的分化和扩展而进一步影响气孔的指数。
以往的研究发现, 拟南芥保卫细胞的长度由其基因组的大小决定, 并且不受CO2浓度、干旱胁迫、相对湿度、辐射强度、紫外线以及病原体侵染等环境因素的影响[42]; 但不幸的是该研究并没有涉及到温度对保卫细胞长度的影响。然而, 有趣的是本研究的结果显示, 增温显著减小了保卫细胞的长度, 从而导致气孔长度的减小。本研究结果也直接支持了张立荣等[18]的研究结果, 该研究在对青藏高原上亚高山草本植物进行增温实验时也同样发现了增温显著降低该区域内4种草本植物叶片的气孔长度。然而, 值得注意的是增温使气孔长度减小的同时也导致了气孔宽度的增加, 以至于增温显著增大了气孔的面积和气孔面积的指数(P< 0.01; 表1)。由于叶片气孔导度和蒸腾速率通常与气孔指数、气孔密度及气孔开度大小呈正相关[2, 3], 本研究的结果表明, 增温增加了玉米叶片的气孔导度和蒸腾速率。同时, 对于叶片气体交换参数直接测量的结果也支持了上述结论。因此, 未来气候变暖不仅可能增加玉米叶片气孔指数和气孔开度大小, 而且在一定程度上导致叶片气孔导度和蒸腾速率的增加。
许多的研究结果显示, 玉米叶片的背腹面(近轴面/远轴面)极性在其分生组织阶段就已经建立起来, 并在随后整个叶片发育的阶段始终维持这种极性[23]。本研究发现增温没有改变气孔密度的近轴面/远轴面比例, 表明玉米叶片的背腹面极性确实是受基因控制的, 并不受外界环境温度的影响。另外, Driscoll等[28]也报道了相似的研究结果, 他们发现玉米气孔的背腹面极性不受CO2浓度的影响。然而, 增温却显著增加了玉米叶片气孔指数的近轴面/远轴面比例, 这种结果可能主要是由于叶片背腹面表皮细胞减少的比例不同而造成的。上述的研究结果表明, 玉米响应未来全球变暖可能会通过改变近轴面/远轴面表皮细胞比例来影响气孔在叶片背腹面的分布。除了植物叶片不同的叶面外, 气孔在同一叶片的不同部位也呈现出较高的变异性[14, 16, 29, 30, 31, 32, 33]。本研究的结果也显示, 增温不仅影响玉米近轴面和远轴面的气孔频度, 而且还改变玉米同一叶面上不同部位(即尖部、中部及下部)的气孔频度, 表明未来气候变暖不仅导致玉米叶面间的高变异, 还会引起玉米叶面内不同部位的变异。相似的研究结果也同样在两个常绿草本物种黑麦草(Lolium perenne)[14]和羊草(Leymus chinensis)[16]中发现。然而, 以往多数的研究在探讨增温对植物叶片气孔特征的影响取样时仅考虑在叶片远轴面的中间部位取样[10, 11, 13, 17], 这种取样方法不够全面。因此, 今后在对植物叶片气孔研究的取样方法上应该改进, 至少在取样时应该考虑整个叶片多点采样。另外还应该注意的是, 尽管本研究中的样品叶是同一位置的, 但增温还可能会显著提前生育进程。所以即使是同一个位置的叶片, 其生育日龄也可能存在显著的差异, 进而其叶的气孔特征也可能发生显著变化。因此, 增温导致叶片生育进程的不同, 也可能对叶片气孔特征产生潜在的影响。
以往的研究结果对于叶片光合对增温的响应还存在较大的争议[9, 43]。本研究发现: (1)增温显著增加了叶片的气孔指数(P< 0.05; 表1), 使玉米叶片上气孔和表皮细胞的比例改变, 即气孔在叶片上所占的比例增大; (2)增温还增加了玉米叶片气孔开口的面积(P< 0.01; 表1), 即气孔的开张度更大; (3)增温也同时增加了气孔面积指数(P< 0.01; 表1), 即单位叶面积上气孔的总面积。这些参数的增加可能在一定程度上有利于大气CO2更加顺利地通过气孔进入叶片的内部, 并扩散到相应的光合作用位点, 从而提高玉米叶片的净光合速率。更为有趣的是增温导致玉米叶片气孔的分布更加规则(图4和图5)。气孔在玉米叶片上的分布越规则, 叶片的气体交换效率就越高, 因为假如气孔在叶片上随机或簇状分布的话, CO2分子经过气孔扩散到叶片内部的有效面积减小, 即气体交换的有效面积减小。该结果表明增温可以改变叶片气孔的分布格局使更多CO2分子更容易通过气孔扩散到叶片内部, 从而有利于玉米叶片净光合速率的增加。
| 表3 增温对玉米叶片表皮细胞和保卫细胞特征的影响 Table 3 Effects of experimental warming on the characteristics of epidermal and guard cells of maize leaves |
未来全球气候变暖并不会对我国华北平原玉米叶片的气孔密度产生直接的影响, 但却可能通过改变表皮细胞的数目来影响气孔指数。同时, 未来气候变暖还会显著减小气孔开口的长度, 增加气孔开口的宽度, 从而增加气孔开口的面积和周长。另外, 全球气候变暖还可能使气孔在玉米叶片上的分布格局变得更加均匀。这些特征参数的改变导致华北平原玉米叶片气体交换过程显著变化, 从而可能最终影响到玉米的品质和产量。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|