第一作者联系方式: E-mail: tzj861@163.com
以综合性状优良的烤烟种质Y3为轮回亲本, 抗烟草黑胫病(0号和1号生理小种)和赤星病的雪茄烟种质Beinhart 1000-1及优质烤烟品种K326为供体亲本, 连续回交并结合分子标记辅助选择, 构建国内外第一套由256个具有烤烟Y3遗传背景并渐渗有Beinhart 1000-1和K326染色体片段株系代换系群体。该群体携带377个代换片段, 分布于烟草24条连锁群上。每个株系携带1~5个代换片段, 代换片段长度介于0.05~36.88 cM, 平均长度7.75 cM。代换片段重叠累加总长度为2922.57 cM, 是烟草基因组总长度的2.61倍。代换片段覆盖总长度为1114.32 cM, 烟草基因组覆盖率为99.45%。本研究构建的片段代换系可用于烟草基因定位、复杂性状的QTL分析和标记辅助选择育种。
A set of chromosome segment substitution lines (CSSLs) of tobacco ( Nicotiana tabacum L.) were first developed by molecular marker assisted selection (MAS) and successive backcrossing with Y3, the flue-cured tobacco germplasm with comprehensive traits as the recipient parent, and two common tobacco cultivars Beinhart1000-1 and K326 as the donor parents. The cigar tobacco cultivar Beinhart 1000-1 carries a variety of resistance traits including black shank (race 0 and race 1) and brown spot resistance, while the flue-cured tobacco K326 is a commercial cultivar with high quality. In 256 CSSLs, a total of 377 substituted segments derived from donor Beinhart 1000-1 and K326 with genetic background of Y3 distributed on 24 linkage groups. Each CSSL contained only 1-5 substituted segments and the length of substituted segments ranged from 0.05 to 36.88 cM with an average of 7.75 cM. The total length of the overlapped substituted segments was 2922.57 cM, which was 2.61 times of the whole tobacco genome length. And the CSSLs covered length was 1114.32 cM, with a covered ratio of 99.45% in the recurrent tobacco genome. The CSSLs constructed in this study are excellent genetic materials for gene mapping, QTL analysis of complicated traits, and developing varieties by marker assisted selection in Nicotiana tabacum L.
烟草是我国重要的经济作物之一, 其品种的选育虽取得了一定成绩, 但与K326等国外引进的优良品种相比仍有一定差距, 无法完全满足国内烟叶生产对品种的需求[1]。烟草的产量、品质和抗性等重要育种目标性状绝大部分为多基因控制的数量性状, 遗传方式复杂, 受多基因位点和环境的共同影响, 且数量性状位点(QTL)的鉴定难度较大[2, 3, 4, 5, 6]。利用传统的分离群体, 因为数量性状本身的复杂性, 及分离群体遗传背景的复杂性, 很难取得QTL定位的满意结果。染色体片段代换系(chromosome segment substitution lines, CSSL)是在受体的遗传背景中代换入某个或某些供体亲本的染色体片段, 并利用回交和分子标记辅助选择(MAS)技术建立的覆盖作物整个基因组的一系列近等基因系[7, 8, 9]。与分离群体相比, 其遗传背景简单、群体遗传稳定、QTL定位及遗传效应分析准确, 在番茄[10, 11, 12]、油菜[13]、莴苣[14]、大麦[15]、小麦[16]、棉花[17]、黄瓜[18, 19, 20]、水稻[21, 22, 23]等作物中得到了广泛应用, 同时, 也是QTL的精确定位、挖掘和利用新基因资源、实现分子标记技术和作物育种链接的理想材料[24]。
迄今, 国内外烟草染色体片段代换系的相关研究尚未见报道。虽然烟草基因组测序为构建高密度烟草分子标记遗传图谱奠定了基础[25, 26, 27, 28], 但因其遗传基础狭窄, 栽培品种间多态性低[29, 30, 31, 32, 33], QTL定位等基础研究相对落后; 目前仅有的少数QTL定位[2, 3, 4, 5, 6, 34]主要基于初级定位群体, 其结果无法直接应用于育种研究。鉴于此, 本研究利用优质烤烟品种K326和抗烟草黑胫病(0号和1号生理小种)、赤星病的雪茄烟种质Beinhart 1000-1为供体亲本, 优良烤烟品种Y3为受体亲本, 经多代回交、自交, 并结合SSR标记辅助选择构建一套烟草染色体片段代换系, 对K326和Beinhart 1000-1中优良品质和抗病的QTL (基因)定位和转育、烤烟品种改良及促进烟草分子育种具有重要意义。
供试的三份烟草材料均由云南省烟草农业科学研究院提供(表1)。受体亲本Y3是从津巴布韦引进的烤烟种质资源, 该资源生育期适中、株型优良、节距较大、叶数多且宽、鲜烟叶柔软, 但叶片较薄、香气质中等、香气量欠足且易感烟草黑胫病和叶斑病害(如赤星病等)。供体亲本K326香气质好、香气量足、燃烧性强, 是目前世界上种植区域最广、种植面积较大的烤烟品种; 供体亲本Beinhart 1000-1是叶片肥厚且抗烟草黑胫病0、1号生理小种和烟草赤星病的雪茄烟种质。
| 表1 用于构建染色体片段代换系的亲本来源及类型 Table 1 Origin and type of parents used for development of CSSLs |
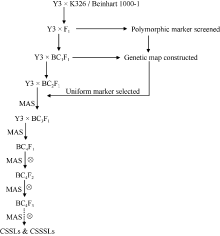
如图1所示, 2013年在云南省烟草农业科学研究院研和试验基地(云南省玉溪市)温室, 以烤烟种质Y3为受体亲本, 与烤烟品种K326和雪茄烟种质Beinhart 1000-1分别杂交获得F1, 再以Y3为轮回亲本回交, 获得2个分别含300个单株的回交一代群体。从2014年1月(BC2F1)开始对导入的供体片段筛选。即在前期已构建的两张烟草遗传图谱的24个连锁群上每10~20 cM选取一个标记, 共计100个SSR标记(表2), 对2个群体中的各单株分别进行代换片段的追踪和检测。仅含有1个代换片段的单株直接自交纯化建立单片段代换系, 而含有多个供体染色体片段( > 5个片段)的单株继续回交并结合MAS进行前景和背景筛选。2014年6月, 将从BC2F1挑选出的240个株系(每个群体120个株系)播种组成1200株BC3F1群体。2014年12月, 从1200个BC3F1株系中筛选出240个株系并种植成1200株BC4F1群体。2015年3月, 利用已构建的2张烟草图谱中共有的416个SSR标记对1200株BC4F1单株进行代换片段的追踪和检测。至2015年12月, 筛选获得256个含有1~5个供体片段的烟草染色体片段代换系并分别自交得到BC4F2群体。2016年2月, 再利用416个标记对2560个BC4F2单株(每个株系随机选10株)进行供体片段的追踪和检测, 直至筛选获得稳定、纯合的烟草染色体(单)片段代换系。
| 表2 受体与供体亲本间的烟草SSR标记多态性 Table 2 Polymorphism between the recipient and donors detected by tobacco SSR markers |
取烟草幼嫩叶片, 提取基因组DNA参考Maguire等[35]的方法略作修改。参照Tong等[2, 3, 28]的SSR标记分析及非变性聚丙烯酰胺凝胶电泳检测方法。为了构建烟草染色体片段代换系, 前期利用公共数据库NCBI上公开的普通烟草基因组序列数据[Nicotiana tabacum(K326), http://www.ncbi.nlm. nih.gov/Traces/wgs/?val=AWOJ01]开发了13 645对烟草SSR标记[27, 28]; 并以K326、Beinhart 1000-1为供体亲本与受体亲本Y3组配的BC1F1为作图群体, 构建了2张分别包含626个和562个标记位点的SSR标记遗传图谱(数据尚未公开), 2张图谱中共有SSR标记416个, 且较均匀分布于24个连锁群上(表2)。
根据已构建的烟草遗传图谱上SSR标记间的遗传距离来估算染色体片段长度, 若标记的相邻基因型相同, 则忽略相邻标记区间的双交换事件, 两标记间的区段为相同的标记基因型; 若标记的相邻基因型不同, 则无多态性的标记与有多态性标记的中点为染色体代换片段的末端, 即认为这2个标记基因型分别组成这个区间的1/2, 代换片段的长度按已构建的遗传图谱中的遗传距离来计算[36]。
利用MapChat 2.20软件构建全基因组的图示基因型, 直观显示代换片段的位置和大小, 并分别累计来自供体亲本Beinhart 1000-1和K326的染色体片段总长度, 计算其占受体基因组的比例。
以已构建的2张遗传图谱为基础, 每隔10~20 cM左右选择1个SSR标记, 共选择了100个SSR标记, 在BC2F1和BC3F1世代中进行供体片段的追踪和检测。其中, 第5、第14、第17和第18连锁群上标记最少, 有3个标记。第2、第13、第19和第22连锁群上标记最多, 有11个标记。SSR标记间最小距离为0.76 cM, 最大距离为41.03 cM, 平均距离为11.89 cM。从BC4F1开始, 利用两张图谱中共有的416个标记进行代换片段的检测与筛选。其中, 第5连锁群上标记最少, 有7个标记; 第2连锁群上标记最多, 有35个标记。SSR标记间最小距离为0.05 cM, 最大距离为36.88 cM, 平均距离为7.75 cM。
通过3个世代(BC2F1、BC3F1和BC4F1)的分子标记辅助选择, 筛选出由256个单株组成的一套分别含有烤烟K326和雪茄烟Beinhart 1000-1导入片段的烤烟染色体片段代换系(图2)。其中, 含有K326片段的代换系有131个株系, 含有Beinhart 1000-1片段的代换系有125个株系。在筛选出的256份BC4F1单株中, 单片段代换单株有31个, 2~4片段代换单株有183个, 5片段代换单株有42个。其中, 具有烤烟K326片段的代换系中, 单片段代换单株有17个, 2~4片段代换单株有95个, 5片段代换单株有19个; 具有雪茄烟Beinhart 1000-1片段的代换系中, 单片段代换单株有14个, 2~4片段代换单株有88个, 5片段代换单株有23个。
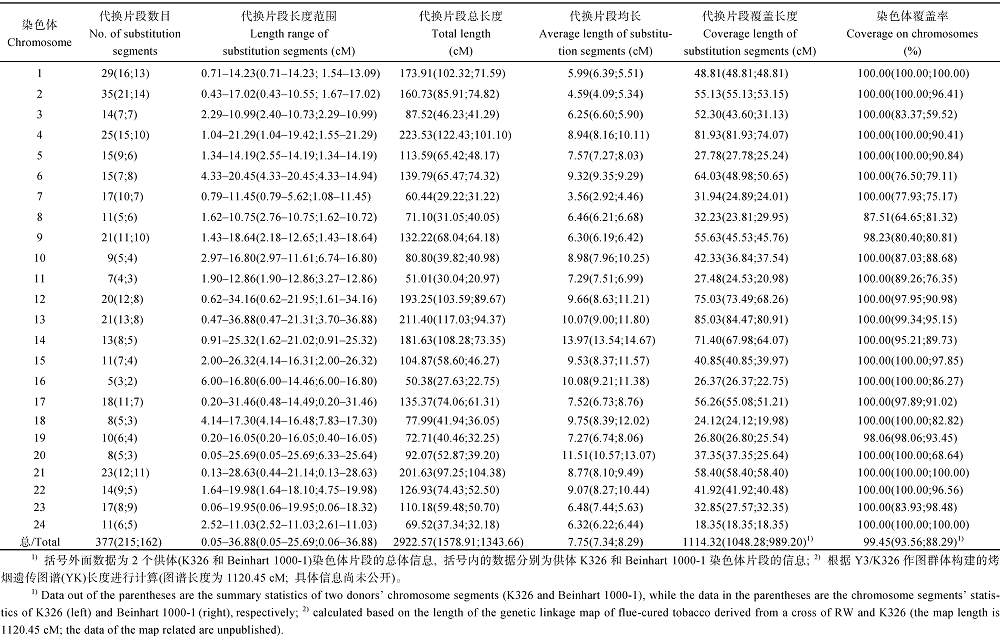
从表3和图2可看出, 烟草基因组导入的377个代换片段总长度为2922.57 cM, 长度范围为0.05~ 36.88 cM, 平均长度为7.75 cM, 最长的代换片段位于第13连锁群上, 最短的代换片段位于第20连锁群上的中下部。其中, 第4连锁群代换片段的总长最大, 为223.53 cM; 第16连锁群代换片段的总长最小, 为50.38 cM。具有烤烟K326片段的代换系中导入的215个代换片段总长度为1578.91 cM, 长度范围为0.05~25.69 cM, 平均长度为7.34 cM。具有雪茄烟Beinhart 1000-1片段的代换系中导入的162个代换片段总长度为1343.66 cM, 长度范围为0.06~36.88 cM, 平均长度为8.29 cM。
| 表3 烟草染色体片段代换系的遗传评价 Table 3 Genetic evaluation of chromosome segment substitution lines in tobacco (Nicotiana tabacum L.) |
377个代换片段在烟草24条连锁群上的分布不等, 各连锁群平均导入15~16个片段。其中, 第2连锁群的代换片段数最多, 为35个, 其次是第1连锁群的29个片段; 第16号连锁群代换片段数目最少, 为5个。215个具有烤烟K326片段的代换系中, 第2连锁群的代换片段数最多, 为21个, 其次是第1连锁群的16个片段; 第16连锁群代换片段数目最少, 为2个。162个具有雪茄烟Beinhart 1000-1片段的代换系中, 同样是第2连锁群的代换片段数最多, 为14个, 其次是第1连锁群的13个片段; 第16连锁群代换片段数目最少, 仅有2个。
代换片段在烟草基因组24条连锁群上覆盖了1114.32 cM的距离, 覆盖率为99.45% (1114.32/ 1120.45)。各连锁群覆盖率虽有不同, 但均在87.5%以上。其中, 有21条连锁群上的代换片段重叠后覆盖率为100%, 而3个第8、第9和第19连锁群上分别存在12.49% (4.60 cM)、1.77% (1.00 cM)和1.94% (0.53 cM)的区域未被覆盖(表3)。具有烤烟K326片段的代换系中, 导入的供体片段覆盖烟草基因组长度为1048.28 cM, 覆盖率为93.56%。其中, 有11条连锁群上的代换片段重叠后覆盖率达100.00%, 剩余的13条连锁群中的覆盖率范围为64.65%~ 99.34%。具有雪茄烟Beinhart 1000-1片段的代换系中, 代换片段覆盖烟草基因组长度为989.20 cM, 覆盖率为88.29%。其中, 代换片段重叠后覆盖第1、第21和第24连锁群100%, 未能达到全覆盖的21条连锁群上代换片段覆盖率范围为59.52%~98.48% (表3)。
在染色体片段代换系构建过程中, 亲本选择十分重要, 一般要选择遗传背景差异较大的[7]。已有的研究中的亲本的选择主要分为两类, 一类是选择供体亲本与受体亲本间亲缘关系较远、遗传背景差异较大且双亲(或其中之一)与生产应用品种间存在较大的性状差异, 此类染色体代换系群体较为适用于遗传学研究, 但不易用于育种实践[10, 11, 12, 14, 15, 18]。另一类则是供体与受体亲本间亲缘关系较近且双亲均为当前大面积推广应用的主栽品种, 此类代换系群体虽可较容易选择出具有优良代换系株系、并直接供育种实践应用, 但双亲间因亲缘关系较近而不易筛选获得足够量的分子标记, 从而影响代换系群体构建的质量[8, 9, 21, 22, 23]。本研究为获得既有较高质量又易于烤烟育种实践应用的烟草染色体片段代换系, 在亲本的选择上兼顾了以下3点。首先, 选择的亲本材料具较多优点, 没有突出或致命的缺点, 且在主要育种性状上优缺点能形成互补。受体亲本(轮回亲本) Y3是综合性状优良但香气量欠足、易感烟草黑胫病和叶斑病害的烤烟种质, 供体亲本则分别具有优良品质、高抗烟草黑胫病和赤星病。其次, 亲本(或亲本之一)是能适应当地生态条件且综合性状较好的推广品种。本研究的3个亲本中, 受体亲本Y3经引种试验, 证明其在我国的西南地区(尤其云南)具有较强的适应性且综合性状优良。供体亲本K326是目前世界上种植区域最广、面积较大且深受我国卷烟企业喜好的烤烟品种。供体亲本Beinhart 1000-1具有较高的烟草黑胫病(0号和1号生理小种)和赤星病抗性。最后, 亲本间的遗传差异较大。本研究所选用的3份亲本材料的生态类型差异较大, 亲缘关系相对较远。从地域上看, 亲本K326和Beinhart 1000-1来源于美国, 亲本Y3来源于津巴布韦。从烟草类型上看, 亲本Y3和K326属于烤烟, 而亲本Beinhart 1000-1属于雪茄烟(表1)。因此, 亲本间的多态率及共显性多态标记数目均较其他烤烟品种间高(表2)。
由于CSSLs与其轮回亲本(受体)间只存在代换片段的差异, 而遗传背景与受体亲本一致, 可将复杂性状分解为单个孟德尔因子, 对代换区段中的QTL分析时遗传背景干扰小, 因而受到研究者的重视[22, 24]。Eshed和Zamir等[10]最早建立了以栽培番茄为遗传背景、含有野生番茄单片段的代换系群体, 该群体含有50个单片段代换系, 可以覆盖野生番茄的全基因组。张桂权等[37]利用优良水稻品种华粳籼
74为受体, 以来源于世界各地的26个品种(包括14个籼稻和12个粳稻)为供体, 通过回交和分子标记辅助选择方法建立了目前世界上规模最大、质量最好的水稻单片段代换系文库。该文库共有1529个染色体单片段代换系(CSSSL), 代换片段的平均长度为18.8 cM, 代换片段总长度达28 700 cM, 相当于约18.8倍的水稻基因组长度。通过对代换片段的基因鉴定和定位, 筛选获得了包括植株形态、稻米品质、产量、抗病性、生育期等重要性状共2000多个优良基因(QTL)。本研究已获得了以烤烟Y3为遗传背景的256个含有1~5个供体片段的烟草染色体片段代换系。其中, 含有K326片段的代换系有131个株系, 含有Beinhart 1000-1片段的代换系有125个株系。获得的代换系中代换片段重叠后总长度为2922.57 cM, 相当于烤烟全基因组总长的2.61倍(本研究中以Y3和K326为作图亲本构建的烤烟SSR标记遗传图谱全长为1120.45 cM), 代换片段覆盖烟草基因组的长度为1114.32 cM, 总覆盖率高达99.45%。因此, 与其他作物相关研究比较, 本研究构建的烟草CSSLs质量总体上还不高, CSSL所包含株系的数量、受体携带代换片段的数目、代换片段的大小(长度)及代换片段在基因组的覆盖率等方面均不能完全满足烟草育种的要求。究其原因, 可能是: (1)烟草育种过程中, 过度依赖极少数的主体亲本而使得许多非育种目标的多样化性状丢失, 导致烟草(尤其是烤烟)品种间的亲缘关系较近、遗传基础狭窄、遗传多样性降低。(2)烟草基础研究相对薄弱。虽然近些年随着烟草基因组计划的开展, 基础研究在分子水平有了质的提升, 但起步较晚, 与其他作物仍有相当大差距。基于此, 导致烟草CSSL在构建过程中既受材料(亲本)的限制又受手段(研究基础)的制约。目前, 本研究获得的代换系尽管不是覆盖烟草全基因组的单片段代换系, 但正在对BC4F1继续进行代换片段的追踪和检测, 直至获得一整套覆盖烟草全基因组的CSSSLs, 为复杂性状QTL分析及有效转育供体亲本K326和Beinhart 1000-1中优质和抗病性状的QTL/基因到其他烤烟品种提供理想材料。
以综合性状优良的烤烟种质Y3为轮回亲本, 以抗黑胫病0号、1号生理小种和抗赤星病的Beinhart 1000-1及优质品种K326为供体亲本, 经杂交、回交、自交, 结合分子标记辅助选择建立了国内外首套烟草染色体片段代换系群体。该群体由256个不同代换系株系组成, 且每个代换系株系中仅含有1~5个代换片段。通过对Y3遗传背景中的Beinhart 1000-1和K326染色体导入片段的分析, 筛选染色体单片段代换系, 为复杂性状QTL分析、分子标记辅助选择育种等研究提供材料。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|