第一作者联系方式: 朱亚军, E-mail: zhuyajunstar@163.com; 孙强, E-mail: jlsunqiang@126.com
稻瘟病是水稻生产中危害最为严重的病害之一, 种植抗病品种是抵御稻瘟病危害的有效措施。本研究利用吉粳809的2个亲本材料吉粳88与93072配制的回交分离群体进行稻瘟病人工接种, 采用抗、感极端分池法定位双亲的稻瘟病抗性基因, 结合基因型分析, 推断吉粳809的抗性基因组成。结果表明, 回交群体对强致病菌GD9-1表现为4个主效抗病基因 Pi-2(t)、 Pi-7-1(t)、 Pi-7-2(t)和 Pi-11(t)分离, 对弱致病菌GD19-1表现单个主效抗病基因 Pi-2(t)分离, 其中 Pi-2(t)基因同时抗2个菌株。除 Pi-2(t)位点抗性等位基因来自吉粳88, 其余3个位点的抗性等位基因均来自93072。比较基因组研究表明, Pi-2(t)可能与 Pi-b等位, Pi-11(t)可能与 Pi-47(t)或 Pik等位, 而 Pi-7-1(t)和 Pi-7-2(t)是2个新的抗性位点, 分别与RM21260和RM8037连锁, 遗传距离为0.11 cM和6.97 cM。利用与上述4个抗病位点紧密连锁的SSR标记和来自3000份水稻种质资源重测序开发的56K芯片鉴定抗性位点吉粳809与双亲基因型的异同, 推断吉粳809抗性基因组成, 发现吉粳809携带轮回亲本吉粳88的 Pi-2(t)和来自供体亲本93072的 Pi-11(t) 2个基因, 合理地解释了吉粳809抗性明显好于吉粳88的原因。对如何通过不同主效抗性基因聚合特别是充分利用原来抗病品种中“丧失”抗性残效基因来改良品种的稻瘟病抗性进行了讨论。
Blast is one of the most hazardous diseases in rice production. Planting resistance variety is an effective solution to control the disease. In this study, a backcross population derived from two parents, Jijing 88 and 93072, was selected to identify blast resistance genes using bulked extremes and recessive class under artificial inoculation and further to deduce the composition of resistance genes in Jijing 809 developed from Jijing 88 and 93072. Four major resistance genes, i.e., Pi-2(t), Pi-7-1(t), Pi-7-2(t), and Pi-11(t), were responsible for segregation of resistance to the strong virulent strain GD9-1, and only one resistance gene Pi-2(t) for segregation of resistance to the weak virulent strain GD19-1. Among them, Pi-2(t) was effective to both strains. The favorable alleles at all loci were from 93072 except for the allele at Pi-2(t) from Jijing 88. According to genomic comparison, Pi-2(t) was deduced to be allelic to Pi-b, and Pi-11(t) to Pi-47(t) or Pik; whereas Pi-7-1(t)and Pi-7-2(t) were two novel resistance genes, which were linkages to SSR markers with RM21260 (0.11 cM) and RM8037 (6.97 cM). Genotypes on the four above-referenced loci were compared between Jijing 809 and its parents by using closely linked SSR markers and a set of 56k gene chip developed from re-sequenced data of 3000 accessions of rice germplasm. The results indicated that the resistance genes in Jijing 809, Pi-2(t) and Pi-11(t), were inherited from the recurrent parent Jijing 88 and the donor parent 93072, respectively, which reasonably explained the higher blast resistance in Jijing 809 than in Jijing 88. Finally, we discussed how to pyramid different known major resistant genes, especially to make full use of the ‘defeated’ resistance gene in the original resistant variety to improve blast resistance in rice.
由真菌Magnaporthe oryzae引起的稻瘟病严重危害水稻的生产, 每年造成全球水稻产量损失高达18%[1]。在我国, 稻瘟病在南北稻区每年均受到不同程度的危害, 一般减产10%~20%, 严重的达40%~50%, 局部田块甚至颗粒无收[2], 且在过去20年有增长的趋势[3]。据全国农作物重大病虫害预警, 2012年稻瘟病在中国的发病面积约为553万公顷, 较2011年增加20%[4]。稻瘟病不仅威胁世界粮食的安全, 同时还导致稻米品质下降[5]。实践证明, 通过遗传育种手段培育优良抗病品种是防治稻瘟病和解决粮食安全的最有效途径之一[6], 而抗病基因的发掘与利用是抗病育种的基础和核心工作[7]。
基于快速发展的分子生物学和相应的分子标记技术, 目前至少已报道了86个主效稻瘟病抗性基因, 350个微效QTL [8, 9]。这些抗性位点分布于水稻的12条染色体上, 其中第7染色体上分布最少, 仅Pi17一个, 第11染色体上最多, 达17个位点, 24个基因[10]。遗传分析揭示, 这些抗性位点中45%来自粳稻, 51%来自籼稻, 剩余4%来自野生稻, 绝大部分位点的抗性基因呈显性遗传[11, 12]。迄今已有24个主效基因被成功克隆, 但尚没有微效QTL被克隆的报道[10]。
吉粳88是吉林省农业科学院水稻研究所采用地理远缘奥羽346为母本与长白9号杂交选育成的首个粳稻超级稻品种, 表现高产、优质、抗病, 2005年先后通过吉林省、辽宁省、国家品种审定, 在吉林省内外累计种植面积达40万公顷以上[13]。该品种仅2006年在吉林省种植面积就达到30万公顷, 占水田面积的40%[13]。由于大面积集中种植单一品种, 吉粳88的稻瘟病抗性近年来基本丧失, 在生产上成为感病品种。
吉粳809是中国农业科学院作物科学研究所和吉林省农业科学院水稻研究所合作以吉粳88为母本、籼稻93072为父本, 杂交并经2次回交, 经系谱法选育成的优质、高产、抗稻瘟病粳稻品种[14]。2013年通过吉林省农作物品种审定委员会审定, 2014年通过国家农作物品种审定委员会审定。田间鉴定试验表明, 吉粳88感稻瘟病, 93072抗稻瘟病, 吉粳809对苗瘟表现为抗病, 叶瘟和穗瘟均表现为中抗, 稻瘟病综合评价指标为中抗以上, 抗性显著好于吉粳88。为了揭示93072稻瘟病的抗性遗传机制, 挖掘其潜在的抗性基因, 鉴定与抗性基因紧密连锁的分子标记, 本研究通过对吉粳88与93072配制的回交群体人工接种稻瘟病, 采用极端分离群体分池法分析抗性位点, 定位93072的抗性基因, 获得与之紧密连锁的SSR标记, 并结合系谱分析, 推断吉粳809的抗性基因, 为今后抗稻瘟病品种培育和抗病品种合理布局提供科学依据。
吉粳88为吉林省农业科学院选育的吉林省首个大面积推广的国审超级稻品种[15], 近年来稻瘟病抗性减弱, 逐年丧失稻瘟病抗性, 成为感病品种; 93072为全球分子育种材料, 表现优质、抗旱和抗稻瘟病。以吉粳88为轮回亲本与稻瘟病抗源品种93072杂交和回交, BC1F1代随机选25个单株回交, 从BC2F2群体中逐株收获少量种子形成混合分离的BC2F3群体, 用于抗性鉴定和筛选。吉粳809是以吉粳88为母本与93072杂交后经2次回交结合系谱法选育成的优质粳稻品种, 其稻瘟病综合评价为中抗以上。
委托广东省农业科学院植物保护研究所, 参照杨健源等[16]描述的接种方法进行苗期稻瘟病接种试验。水稻种子经催芽后穴播于30 cm× 20 cm× 5 cm规格的搪瓷盆, 供试亲本、抗病对照Tetep和感病对照丽江新团黑谷各播种1行, 每盆播品种材料24个, 每行播量为8~10粒种子。将回交群体一分为二, 定名为A群体和B群体, 分别用于接种G1小种的强致病菌GD9-1和弱致病菌GD19-1。每群体各3500粒, 播2盆。采取旱育秧, 长至一叶一心期施硫酸铵, 每盆施0.5 g, 接种前共施3次。待稻苗长至3.5~4.0叶龄, 用配制好的孢子液人工喷雾接种, 每盆接种菌液量为20 mL。接种后于遮光密闭的培养箱中25℃保湿24 h, 之后置温室, 在25~28℃下保湿培植至稻苗发病, 接种7 d后进行调查。
由广东省农业科学院植物保护研究所和吉林省农业科学院水稻研究所提供的16个籼型小种和14个粳型小种的品种抗谱测定菌株, 分别来自广东省和吉林省各地区, 包括14个B群小种、2个C群小种、1个E群小种、5个F群小种和8个G群小种(表1)。品种抗谱测定设2个重复, 按国际水稻研究所稻瘟病圃苗瘟分级标准调查病级, 0~3级为抗病、4~9级为感病[17]。
| 表1 吉粳809及其双亲对30个稻瘟病菌株的抗性反应 Table 1 Reaction of resistance to 30 Magnaporthe oryzae strains for Jijing 809 and its parent |
采用CTAB法提取单株的基因组DNA[18]。基于回交群体接种后的抗性评价选株构建抗感池。从群体A中选择17个抗病单株(0级)和17个极端感病单株(9级)提取DNA构建群体A的抗、感池, 分别记作A-R和A-S; 从群体B中选15个抗病单株(0级)和15个极端感病单株(9级)提取DNA构建群体B的抗、感池, 即B-R和B-S。用于抗病池构建的抗病株是从被四周感病植株包围的抗病株中选择, 以排除由于接种因素而导致的不发病造成的抗病假象。
首先利用常用的535对均匀分布于水稻12条染色体上的SSR引物对双亲进行多态性筛选, 进一步利用双亲间多态标记对A和B群体的抗感池进行基因型鉴定, 初步确定与抗性基因连锁的标记位点。依据初步定位获得的与抗性基因连锁的位点, 从SSR引物数据库中有针对性地从该连锁位点两侧选更多的引物, 逐一鉴定抗感池和双亲的多态性, 从而在每个抗性位点附近获得一组多态标记。筛选的多态性标记对A和B群体中鉴定出来的更多感病株进行基因型鉴定, 通过以下公式估算各标记位点与抗性基因位点的重组值, 实现对抗性基因的进一步精细定位。
重组率 = (N1+N2/2)/N, 其中N1为各标记带有抗病亲本纯合基因型的个体数, N2为带有双亲杂合基因型的个体数, N为感病群体的总株数。
试验过程中PCR反应采用20 µ L总体积的常规反应体系, 以8%的聚丙烯酰氨凝胶电泳对每个PCR产物进行基因型分型。
首先以与抗性基因紧密连锁的多态性标记对93072、吉粳88和吉粳809分型, 分析吉粳809抗性基因的遗传组成。进一步利用56K高通量基因芯片对吉粳88、93072和吉粳809进行全基因组基因型扫描, 分析吉粳809与双亲的多态性尤其是抗性位点附近的多态性。比较SNP基因型揭示的差异区段与抗性基因SSR标记定位结果, 验证抗性位点的可靠性, 并推断吉粳809带有的抗性基因。56K SNP芯片是基于3000份全球水稻核心种质重测序数据开发的[19], 包括55 312个SNP位点, 这些位点均匀分布于水稻12条染色体, 平均间距为6.84 kb。委托北京博奥晶典生物技术有限公司完成3个样本的SNP芯片基因型分型。
采用Microsoft Excel整理数据、统计分析和计算遗传重组率。
采用从我国广东省和吉林省分别收集的15个籼型和粳型优势致病菌株, 接种吉粳809和其双亲吉粳88和93072, 轮回亲本吉粳88对稻瘟病的抗性频率仅为46.7%, 属于感病品种, 93072抗性频率为73.3%, 属中抗品种(表1)。由吉粳88和93072杂交衍生出来的吉粳809的抗性频率介于双亲之间, 为66.7%, 属中抗类型, 表明吉粳809的抗性来自93072的抗性基因。分析3个品种对30个籼、粳菌株的抗性表明, 双亲对57-2、13-284和2013-1-1均表现抗病, 但吉粳809对这些菌株则表现感病; 相反, 双亲对13-466均表现感病, 而吉粳809则表现抗病。表明籼、粳杂交后代分离群体发生基因重组时可能产生新的等位基因, 这些等位基因的抗性反应完全不同于双亲。
利用均匀分布于水稻12条染色体上的553对SSR引物对抗、感亲本进行多态性分析, 获得13对多态性标记。进一步利用筛选到的多态性标记, 分别对接种强致病菌GD9-1的A群体和接种弱致病菌GD19-1的B群体建立的抗、感池分析, 从A群体的抗、感池获得7对多态性标记, 分别是第2染色体的RM208、RM406、RM266, 第7染色体的RM427、RM214、RM542和第11染色体的RM254; 从B群体的抗、感池获得3对多态性标记, 分别是第2染色体的RM208、RM406和RM266, 其中第2染色体的3个引物(RM208、RM406和RM266)在2个群体的抗、感池中都表现出多态性(表2)。
| 表2 抗性基因的初步定位 Table 2 Preliminary mapping for resistance genes |
利用隐性集团分析法估算各多态标记位点与抗性基因位点之间的重组率。A、B群体各接种3500株苗, 分别分离出感病单株882和922株。结果在A群体定位到4个抗性基因, 其中Pi-2(t)被定位到第2染色体长臂末端, 与RM208紧密连锁, 遗传距离为3.75 cM; Pi-7-1(t)和Pi-7-2(t)都被定位到第7染色体上, 分别与RM427和RM214连锁, 遗传距离分别是12.24 cM和9.69 cM; Pi-11(t)被定位在第11染色体长臂末端, 与RM254紧密连锁, 遗传距离为2.15 cM (表2)。在B群体定位到1个抗性基 因, 与第2染色体上的RM208紧密连锁, 遗传距离为3.15 cM (表2)。除Pi-2(t)位点的抗性基因来自吉粳88外, 其余3个抗性位点的有利等位基因均来自供体亲本93072。
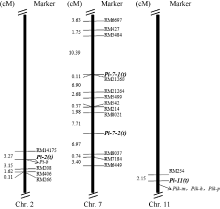
在初步定位结果的基础上, 在上述3条染色体上鉴定到与抗性基因连锁的位点两侧, 选择更多的SSR标记鉴定双亲和抗、感两池的多态性, 又鉴定出10个新的SSR多态性标记, 包括第2染色体上的1个(RM14175), 第7染色体上的9个(RM6697、RM3484、RM21260、RM21264、RM5499、RM8021、RM8037、RM7184和RM6449), 而第11染色体上RM254位点附近没有筛选到新的多态性标记。利用位于RM208上游约55 kb的多态性标记RM14175对B群体的感病单株进行PCR检测表明, Pi-2(t)与RM14175紧密连锁, 遗传距离为3.27 cM。综合上述定位结果, Pi-2(t)最终被定位到分子标记RM14175与RM208之间(图1)。由于Pi-7-1(t)和Pi-7-2(t)仅在A群体中定位到, 因此利用9对新筛选的位于第7染色体上的多态性标记对A群体的感病单株进行基因型鉴定, Pi-7-1(t)与RM21260紧密连锁, 922个单株中仅出现1个交换单株, 遗传距离约为0.11 cM; Pi-7-2(t)位于分子标记RM8021与RM8037之间, 与后者遗传距离较小, 约6.97 cM (图1)。
抗性基因定位结果证实, RM208、RM21260、RM8037和RM254分别与4个定位到的抗性基因紧密连锁, 因此利用这4个分子标记对93072、吉粳88和吉粳809进行基因型分型。结果发现吉粳809在RM254位点上扩增出与供体亲本93072相同大小的片段(表3), 在其余3个位点上扩增出与吉粳88大小相同的片段, 表明吉粳809携带了第2染色体上的Pi-2(t)基因和第11染色体上的Pi-11(t)2个抗基因, 其中前者有利等位基因来自亲本吉粳88, 后者的有利等位基因来自93072。
| 表3 吉粳809在与4个抗性基因紧密连锁的位点上的基因型 Table 3 Genotyping for Jijing 809 using seven linkage markers of four resistance genes |
进一步利用56K基因芯片来验证SSR分析结果。56K基因芯片总计包括55 312个SNP位点, 删去双亲和吉粳809中杂合和缺失的位点, 剩余52 921个SNP, 其中亲本间没有多态的位点43 808个, 有多态的位点9113个。对于3个抗性基因Pi-2(t)、Pi-7-1(t)和Pi-7-2(t), 以与抗性基因紧密连锁的左右两侧标记为界, 分析两侧标记内吉粳809与双亲的基因型, 结果表明, Pi-2(t)定位区间内有10个SNP在双亲间有多态性, 且吉粳809在这10个多态性SNP位点上的基因型和母本吉粳88一致(表4); Pi-7-1(t)和Pi-7-2(t)定位区间内分别有13和33个多态性SNP, 吉粳809在这些多态性SNP位点的基因型和母本吉粳88一致; 对于Pi-11(t), 仅检测到RM254与其紧密连锁, 因此以包括RM254 (24 230 491 bp)在内上下游各10 kb的范围对吉粳809与父母本基因型一致性进行分析, 发现55K芯片在该区间共有5个SNP位点, 其中4个在亲本间表现出多态性, 吉粳809在这些多态性SNP位点的基因型与父本93072基因型一致(表4)。表明SNP基因型分析结果与SSR完全一致, 证实吉粳809确实携带了2个抗性基因, 即保留自轮回亲本吉粳88的Pi-2(t)和来自供体亲本93072的Pi-11(t), 该结果合理地解释了吉粳809抗性好于吉粳88的原因。
| 表4 利用56K芯片验证吉粳809所携带的抗性基因 Table 4 Verification of blast resistance genes carried by Jijing 809 using 56K chip |
迄今, 已报道了86个主效稻瘟病抗性基因和350个微效QTL [8, 9]。在本研究中, 鉴定到Pi-2(t)、Pi-7-1(t)、Pi-7-2(t)和Pi-11(t)4个抗性基因。Pi-2(t)位于第2染色体长臂, 与SSR标记RM208紧密连锁, Pi-7-1(t)和Pi-7-2(t)位于第7染色体, 分别与RM21260和RM8037连锁; Pi-11(t)位于第11染色体长臂末端, 与RM254紧密连锁。将与4个抗性基因紧密连锁的4个标记锚定到日本晴参考基因组上, 与已经定位和克隆的主效抗性基因比较发现, RM208位于已克隆主效抗性基因Pib上游约29.9 kb处。多个文献也指出RM208与Pib共分离, 可用于稻瘟病分子辅助改良研究[20, 21, 22, 23], 这表明Pi-2(t)很可能是Pib或其等位基因。Pi17是迄今第7染色体上唯一被定位到的主效抗性位点, 与同工酶基因Est9连锁, 位于染色体长臂73.3 cM处[24]。与Pi-2(t)不同, Pi-7-1(t)和Pi-7-2(t)是2个新的抗性位点, 抗性等位基因均来自供体亲本93072, 前者位于染色体短臂, 后者位于着丝粒区附近, 均位于Pi17上游且距离较远。分析表明, Pi-11(t)位于第11染色体末端的抗性基因富集区域, 且有2个抗性位点与其邻近或可能存在关联, 如Pik位于Pi-11(t)下游约1 Mb处, Pik的复等位基因Pik-m与RM254紧密连锁, 遗传距离为13.4 cM [25]; Pi-47(t)被定位于分子标记RM206和RM224之间(22 480 961~27 673 251 bp)[26], 该区间覆盖Pi-11(t)和Pik。56K芯片数据表明, 在第11染色体上, 吉粳809在染色体末端24~26 Mb范围内仅渗入了93072的2个小片段, 其中1个小片段恰好覆盖Pik(未给出详细数据)。因此, 我们推断Pi-11(t)可能是Pi-47(t)或Pik的等位基因。鉴于Pik-m和Pi-47(t)是2个重要的广谱抗病基因[2], 携带3个抗性基因的93072 [Pi-7-1(t)、Pi-7-2(t)和Pi-11(t)]比携带2个抗性基因的吉粳809 [Pi-2(t)和Pi-11(t)]具有更强的抗性, 因此后续我们将对Pi-7-1(t)、Pi-7-2(t)和Pi-11(t)进行进一步的定位和克隆, 阐明其抗性特征, 明确Pi-11(t)与Pi-47(t)和Pi-km的确切关系, 加快其在稻瘟病抗性改良中的应用。
籼粳亚种间存在隐秘的染色体结构差异, 由于染色体重排和基因重组, 籼粳交后代将产生丰富的遗传变异[27], 这一现象在水稻全球分子育种计划的回交育种实践中得到证实。Zhang等[28]从黄华占与国际水稻研究所品种PSBRC66和PSBRC28的杂交和回交的后代, 从双亲感病的回交后代筛选到一批对白叶枯病广谱抗病的株系, 遗传分析证实其携带一个新的白叶枯病抗性基因Xa39, 揭示了籼籼交后代染色体重组也会产生新的有利变异。本研究中, 利用15个籼型和15个粳型优势致病菌株, 对吉粳88、93072和吉粳809进行抗性评价, 结果发现接种多数致病小种后, 吉粳809与2个亲本的抗感反应一致, 但有少数菌株接种后, 吉粳809与2个亲本的抗感反应不一致, 抗感完全相反, 如接种57-2、13-284和2013-1-1后, 双亲均表现抗病, 但吉粳809表现出感病; 相反, 接种13-466后双亲均表现感病, 但吉粳809却表现出抗病特征(表1)。因此, 我们推测吉粳809在培育过程中, 籼粳染色体发生重组而产生了新的有利变异, 而且这些等位基因的效应可能完全不同于双亲。这一现象启示我们, 在籼粳交或遗传距离较远的籼籼交甚至粳粳交后代, 加强选择有可能筛选出双亲不具备的有利性状。
大多抗病品种在生产上推广数年后, 由于抗病基因相对单一, 稻瘟病菌群体中的毒性小种逐渐成为优势小种, 最终导致抗病品种的抗性丧失, 造成病害流行。这迫使育种家通过聚合多个抗性基因来延长品种的抗性寿命[29]。研究表明, 持久抗性与多个抗病, 基因的协同作用密切相关。一些优异的稻瘟病抗源, 如Moroberekan、Tetep、三黄占等, 都具有多个抗病基因[30]。近年来, 采用定向回交育种和分子标记辅助选择技术相结合策略, 选育出一批优异的水稻抗病改良株系, 如Hittalmani等[31]将Pi1、Piz5和Pita聚合到水稻品系BL125中, 显著提升了BL125的抗性水平和抗谱; 柳武革等[32]聚合Pi1和Pi2基因育成广谱抗稻瘟病两系不育系GD-7S; 李洪亮等[33]把Pi1和Pi2基因聚合到水稻品种空育131中, 培育出了广谱、 持久抗稻瘟病的寒地优质水稻品种; 王军等[34]将稻瘟病抗病基因Pi-ta和Pi-b和条纹叶枯病抗病基因Stv-bi聚合, 选育出高产、优质、多抗水稻新品系74121; 向小娇等[35]将稻瘟病抗性基因Pi9、Pigm和pi21导入感稻瘟病的京作1号背景, 培育出不同单基因和多基因聚合的抗病新品系。
本研究表明, 吉粳88带有Pi-2(t)基因, 该基因与Pi-b可能等位, 在品种育成之初具有较好的稻瘟病抗性。由于该品种在吉林省大面积集中种植, 其携有的Pi-2(t)基因在推广数年后丧失抗性。程芳艳等[36]也证明了Pi-b基因在黑龙江省无效, 建议在北方粳稻育种中不宜单独利用。抗源供体93072对强致病菌株GD9-1带有3个抗性基因, 即Pi-7-1(t)、Pi-7-2(t)和Pi-11(t), 前2个是本研究发现的新基因, Pi-11(t)可能与Pi-47(t)或Pik等位, 具有较广的抗谱。因此, 将93072的Pi-11(t)导入吉粳88, 与原有的Pi-2(t)聚合, 增强了育成品种吉粳809的抗性水平。Li等[37]发现来自特青的抗白叶枯病Xa-4位点的等位基因Xa-4T对白叶枯病菌CR4和CXO8表现为1对显性主基因抗性, 但其抗性被CR6小种克服, 表现为1个具显著残余效应的隐性QTL, 认为白叶枯病持久抗病品种可以通过聚合多个基因或QTL, 包括表现残余效应的QTL来实现抗性累加。吉粳809中来源于吉粳88的抗性“ 丧失” 的Pi-2(t)基因与来自93072的Pi-11(t)抗性基因之间是否存在抗性协同作用还有待进一步验证。稻瘟病持久抗性品种的培育, 除聚合不同的主效抗性基因外, 是否可以通过聚合感病品种中已有抗性“ 丧失” 的残余效应基因与外来导入的抗性基因来提高抗性水平, 值得进一步深入研究。
定位到4个主效抗病基因, 其中Pi-2(t)同时抗2个菌株。Pi-2(t)可能与Pi-b等位, Pi-11(t)可能与Pi-47(t)或Pik等位, Pi-7-1(t)和Pi-7-2(t)是2个新的抗性位点, 除Pi-2(t)位点的抗性等位基因来自吉粳88外, 其余3个位点的抗病等位基因均来自93072。吉粳809携带来自受体亲本吉粳88的Pi-2(t)和来自供体亲本93072的Pi-11(t) 2个抗性基因, 合理地解释了吉粳809抗性明显好于吉粳88的原因。
致谢: 感谢广东省农业科学院植物保护研究所朱小源研究员提供苗期稻瘟病接种帮助。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|