第一作者联系方式: E-mail:olytianyu@163.com
对水稻叶色进行表型分析与基因定位, 可为图位克隆该类基因和研究水稻光合系统功能奠定基础。利用甲基磺酸乙酯(ethyl methanesulfonate, EMS)诱变的方法, 从籼稻品种“南京11”(简称NJ11)中获得温敏黄化突变体 dy1; 与野生型相比, dy1在自然环境下, 从苗期至成熟期始终表现叶片黄化, 透射电镜显示 dy1类囊体结构异常; 同时株高、分蘖数、结实率等农艺性状也表现出极显著的差异; 实验室光照培养箱条件下, dy1苗期在20℃下表现白化, 在25℃表现黄化, 在30℃下为浅绿的表型; 遗传分析表明水稻温敏黄化突变体 dy1的表型是由1对隐性基因控制; 将突变体与粳稻广亲和品“02428”杂交, 构建F2群体, 从中选出隐性极端个体, 通过基因定位, 将控制黄化的基因限定在第1染色体长臂上标记Y-4和Y-35之间的115 kb的区间内, 含有16个开放阅读框(ORF), 测序发现, dy1中编码尿嘧啶核苷酸激酶的基因 LOC_Os01g73450的第4个内含子与第5个外显子交界处存在单碱基替换, 拟作为候选基因; 且叶绿体合成相关基因表达量显著降低, 猜测该基因可能参与了叶绿素合成途径。
Phenotypic analysis and gene mapping of rice leaf color could lay a foundation for map-based cloning of related genes and the function research of rice photosynthetic system. Leaf yellow mutant dy1 was obtained from rice cultivar “Nanjing 11” (abbreviated as NJ11) mutated by ethyl methanesulfonate (EMS). The mutant dy1 showed leaf yellowing at seedling stage and maturity stage in natural environment, with an abnormal structure of thylakoids under TEM, and significant differences in plant height, tiller number, seed setting rate and so on. The mutant dy1 showed albinism in 20°C, etiolation in 25°C and virescence in 30°C. The rice leaf yellow mutant dy1 was controlled by a single recessive gene. F2 population was constructed by crossing the mutant with “02428”, and the mutant phenotypes of extreme individuals were selected to map gene dy1. The gene was located in the 115 kb region of the long arm of chromosome 1, and contained 16 ORFs. Sequencing analysis showed that LOC_Os01g73450 controlling a uracil nucleotide kinase, with a single base substitution in the junction of the fourth intron and the fifth exon in dy1, might be a candidate gene. And the expression of genes related to chloroplast synthesis was significantly decreased, indicating dy1 may involve in the chloroplast synthesis
水稻叶色突变多发生在苗期, 包含白化、黄化、浅绿、绿白、白翠、黄绿、绿黄、条纹8种表现类型[1, 2]。水稻叶色突变经常表现为叶绿素合成或者降解过程受阻, 进而影响光合作用, 最终造成植株长势减弱、减产甚至死亡。随着功能基因组学的不断发展, 叶色突变体在研究植物光合作用机制、明确叶绿体的结构功能和阐明遗传调控机制上, 以及作为标记性状在简化良种繁育和杂交制种过程中均有重要应用价值[3, 4]。迄今为止, 利用水稻叶色突变体已成功定位到约100个水稻叶色相关基因, 其中, 大部分是与叶绿素代谢和叶绿体发育相关的。例如, 从水稻黄绿叶突变体中图位克隆到OsYGL1基因, 编码叶绿素合成酶, 该基因突变后, 叶绿素合成酶活性降低, 叶绿素合成受抑制, 导致叶片黄化[5]。编码叶绿素a氧化酶的OsPGL基因突变影响叶绿素合成和叶绿体超微结构, 使叶片早衰, 间接影响水稻产量和品质[6]。Chl1和Chl9基因分别编码镁螯合酶的ChlD和ChlI亚基, 在叶绿体发育与质-核信号转导途径中发挥重要作用, 在chl1和chl9突变体中, 叶片表现出浅黄绿色表型[7]。水稻叶色白化突变体Oschr4, 叶绿体的结构异常, 导致叶片近轴一侧出现白化表型, OsCHR4编码一类染色质重组因子, 主要调节水稻幼叶早期叶绿体的合成[8]。此外, 多个白化转绿基因的功能也被发掘出来。V3基因编码一个核苷酸还原酶, 调控DNA的合成和修复[9]。基因SGR的过量表达能够促进叶绿素的分解, 减少叶片当中类囊体片层数目, sgr突变后导致类囊体膜上的捕光叶绿素结合蛋白(LHCP)复合体稳定性降低, 造成叶片的滞绿[10]。虽然水稻全基因组测序完成, 越来越多调控水稻叶色的基因逐渐被发掘出来, 但是叶绿素的合成和降解机制仍未全面揭示。
本研究利用化学诱变的方法, 得到了一个温敏黄叶突变体dy1, 该突变体在自然条件下从苗期至成熟期一直表现出黄叶的表型, 实验室光照培养箱条件下表现出低温白化的表型。与野生型NJ11相比, 突变体株高变矮, 单株产量降低, 分蘖数减少, 每穗粒数减少, 且抽穗期延迟。透射电镜观察发现突变体dy1的叶绿体结构明显受损, 类囊体片层排列疏松无序。遗传分析表明黄化叶色表型是受隐性单基因控制。选取与突变体表型一致的800个极端个体, 利用SSR和InDel多态性标记, 最终将其定位在第1染色体标记Y-4与Y-5之间的115 kb区间内, 包含16个ORF, 测序发现, 突变体中一个编码尿嘧啶核苷酸激酶的基因LOC_Os01g73450存在单碱基替换, 初步确定为候选基因。
温敏黄叶突变体dy1是从籼稻品种“ 南京11” (简称NJ11)通过化学试剂EMS诱变获得的, 经过南京和海南陵水试验基地多代自交繁殖, dy1的表型和其他农艺性状均已稳定遗传。在海南陵水试验基地, 将突变体dy1和野生型NJ11正反交配组, 用于构建遗传分析群体, 将突变体dy1和“ 02428” (江苏省农业科学院选育的广亲和粳型种质)杂交, 用于构建基因定位群体, 所得F1均种植于南京土桥试验基地, 得到F2种子。
将突变体dy1和野生型NJ11室温浸种48 h、催芽12 h之后播种于南京农业大学土桥试验基地, 自然条件下生长。在成熟期, 调查野生型和突变体的株高、千粒重和结实率等主要农艺性状。利用万深SC-G自动考种分析仪测定千粒重, 重复3次, 随机取20株测定株高等农艺性状, 利用t测验分析统计结果差异的显著性。
突变体和野生型种子室温下浸种48 h, 30℃催芽12 h, 分别播种于为20℃、25℃、30℃的GXZ智能光照培养箱内, 每天光照12 h, 培养2周后取第2叶0.05 g, 剪成0.5 cm长的小块, 黑暗条件下浸泡在5 mL 96%乙醇溶液的离心管中48 h, 期间多次轻柔摇晃, 吸取上清液100 μ L, 利用多功能酶标仪Sp470ectra MaxM3 microplate reader, 测定波长在665、649和470 nm下的吸光值。根据Lichtenthaler[11]的方法, 计算单位质量叶绿素a (Chl a)、叶绿素b (Chl b)含量。在自然条件下, 用同样方法, 测定抽穗期突变体和野生型剑叶的叶绿素含量。
自然环境下, 在抽穗期选取野生型和突变体剑叶, 将其切成长宽为5 mm × 2 mm的条状小块, 浸泡在2%的戊二醛和0.2 mol L-1 pH 7.2 Na2HPO4- NaH2PO4缓冲液中, 固定24 h。随后用不同梯度(30%、50%、70%、80%、90%、100%)的乙醇溶液逐级脱水, 用环氧树脂包埋, LKB-V型切片机制片, 最后用醋酸铀染色, 在Hitachi H-7650 (日立)透射电镜下观察并照相。
将定位群体播种在南京土桥试验基地, 2周后选取与突变体表型一致的极端个体800株。利用稍加修改的CTAB法提取叶片DNA, 首先取新鲜叶片1 g, 剪成0.5 cm的小段于2.0 mL离心管中, 于液氮中冷冻15 min, 用高速打样器研磨至粉末状; 随后加入65℃水浴过的DNA提取液(100 mL Tris-HCl, pH 8.0, 40 mL EDTA, pH 8.0, 20 g CTAB, 81.9 g NaCl溶解到1 L水中) 600 μ L, 65℃水浴30 min; 之后加入三氯甲烷与异戊醇混合液(24∶ 1) 600 μ L, 轻微混匀, 变为乳白色; 4℃下13 800× g离心, 吸取上清液200 μ L于新的1.5 mL离心管中, 向其中加入120 μ L异丙醇, -20℃冷冻30 min, 出现白色絮状物, 13 800× g离心, 倒掉离心管中液体; 加入400 μ L 70%的酒精溶液, 轻微摇晃, 4℃下13 800× g离心, 倒掉离心管中液体, 自然吹干, 残留固体即为所需DNA; 最后加入适量的TE溶液溶解, 测定DNA浓度(NanoDrop2000分光光度计, Thermo公司), 储存于-20℃备用。
利用实验室已有的分子标记筛选突变体与杂交亲本之间多态性, 选出均匀分布于12条染色体且多态性良好的分子标记150对, 利用F2群体中10株极端个体进行初步连锁分析。根据定位区间, 利用Primer 5.0加密区间内的标记, 同时增加极端单株800株用于精细定位。精细定位引物序列见表1。
| 表1 用于精细定位的多态性标记 Table 1 Molecular markers used in fine-mapping of the dy1 locus |
分别取20℃和30℃GXZ智能培养箱中培养2周的突变体和野生型的幼苗第2叶, 使用RNA Prep Pure Plant Kit试剂盒(天根生化有限公司)提取RNA。取2 μ g RNA作为模板, 经SuperScript II Kit试剂盒(TaKaRa公司)反转录为cDNA。利用实时荧光定量PCR分析上述样品中叶绿素合成相关基因的表达水平。本文中涉及的基因有谷氨酰-tRNA还原酶(HEMA)、谷氨酰-1-半醛转氨酶(HEML)、胆色素原合酶(HEMB)、羟甲基后胆色素原合酶(HEMC)、尿卟啉原脱羧酶(HEME)、粪卟啉原脱羧酶(URO-D)、粪卟啉原III氧化酶(HEMF)、镁螯合酶D亚基(CHLD)、镁螯合酶H亚基(CHLH)、镁螯合酶I亚基(CHLI)、镁原卟啉IX甲基转移酶(CHLM)、镁原卟啉IX单甲酯环化酶(CRD)、二乙烯还原酶(DVR)、NADPH原叶绿素酸酯氧化还原酶(POR)和叶绿素合成酶(CHLG), 内参基因为水稻Actin基因[12, 13, 14]。按照95℃ 30 s、95℃ 5 s、60℃ 30 s, 40个循环的程序在7500 Real-time PCR仪(Applied Biosystems公司)上扩增, 利用自带软件分析CT值, 计算出目的基因的表达量。参照刘喜等[12]叶绿素合成相关基因定量引物。
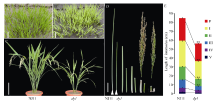
调查南京正季自然环境下的表型, 发现突变体dy1在自然环境下苗期和成熟期均为黄化表型, 且突变体株高显著降低, 第1、第2、第3节间均比野生型显著缩短, 分别只为野生型的67.4%、56.6%和53.8% (图1)。同时突变体分蘖数减少, 穗长变短, 只为野生型的77.8%, 单株产量显著降低, 但在籽粒大小和千粒重方面, 野生型和突变体无显著差异(表2)。
| 表2 野生型NJ11和突变体dy1的农艺性状 Table 2 Agronomic traits of the wild type NJ11 and dy1 mutant |
温度处理表明, 突变体对温度敏感, 在20℃低温环境下表现白化, 在25℃下表现黄化, 在30℃下表现为淡绿(图2)。对三叶期叶绿素含量测定发现, 不同温度下dy1幼苗叶片中叶绿素a、叶绿素b含量均极显著低于野生型, 叶绿素a分别为野生型的81.3%、53.1%和30.8%, 叶绿素b分别为野生型的76.6%、55.8%和31.5% (表3)。
| 表3 3种温度下野生型NJ11和dy1三叶期幼苗叶片中叶绿素含量 Table 3 Chlorophyll contents in leaves of dy1 and NJ11 seedlings at 3-leaf stage under the three temperature conditions |
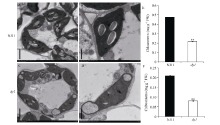
对自然条件下生长至抽穗期的NJ11和dy1剑叶中叶绿体超微结构的观察表明, 野生型中叶绿体发育正常, 结构完整, 类囊体片层清晰(图3-A, B), 突变体叶片中叶绿体的发育受到明显影响, 类囊体结构异常(图3-C, D)。同时该时期突变体中叶绿素含量显著低于野生型(图3-E, F)。
突变体dy1与亲本NJ11正反交, 后代F1在自然条件下生长, 叶片颜色正常, 说明该表型受到隐性核基因控制。在南京土桥试验基地自然田间条件下播种, 并统计F2群体中正常叶色幼苗与黄叶幼苗数, 分析表明, 绿叶幼苗∶ 黄叶幼苗的株数分离比符合3∶ 1, 说明该表型受到1对隐性基因控制(表4)。
| 表4 dy1基因的遗传分析 Table 4 Genetic analysis of the dy1 gene |
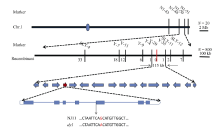
从dy1和“ 02428” 杂交得到的F2群体中, 随机选10株极端个体, 提取DNA, 并选取150个在两亲本间多态性良好且均匀分布于12条染色体的SSR和InDel标记, 进行连锁分析, 将突变基因初步定位在第1染色体标记N1-48与N1-50之间, 物理距离约为1876 kb, 进一步增加极端个体数量至800株, 同时加密区间内的标记, 最终精确定位在标记Y-4与Y-35之间, 物理距离约为115 kb, 且与Y-20标记共分离。区间内共包含16个开放阅读框(ORF, 图4), 测序分析发现突变体dy1中, 一个编码尿嘧啶核苷酸激酶的基因LOC_ Os01g73450, 在第4个内含子与第5个外显子连接处存在单碱基差异(图4), 推测其内含子在剪切的时候发生错误, 造成突变体的表型, 拟将其作为候选基因。
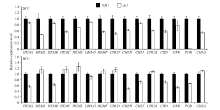
突变体dy1在20℃时叶片表现白化, 叶绿素含量显著降低, 30℃时表现淡绿, 因此, 对20℃和30℃条件下dy1及其野生型幼苗的第2叶(在培养箱中培养2周)中叶绿素合成相关基因的表达进行实时荧光定量PCR分析。结果表明, 与野生型相比, 在20℃时dy1幼苗中叶绿素合成相关基因的表达水平普遍降低, 尤其是羟甲基后胆色素原合酶(HEMC)、镁离子螯合酶H亚基(CHLH)、原叶绿素酸酯氧化还原酶A(POR)、谷氨酰-1-半醛转氨酶(HEML)等基因(图5-A)。30℃时, dy1幼苗中大部分基因表达量与野生型差异并不明显, 但镁离子螯合酶H亚基(CHLH), 联乙烯还原酶(DVR), 原叶绿素酸酯氧化还原酶A (POR)基因的表达量仍明显低于野生型(图5-B)。
为解决愈发严峻的粮食安全问题, 作为主要产量来源的光合作用成为科研的重点, 叶色突变体的作用也越来越重要, 通过不断深入研究, 发现叶色突变体可以应用于多个方面, 如作为标记性状应用于杂交水稻制种; 常绿突变体可延缓叶片衰老, 最终提高产量, 为高产育种提供基因资源; 叶色突变发生较为频繁, 目前在玉米、高粱、大豆等很多作物上均已报道过叶色基因, 可作为研究光合作用机制、叶绿素相关基因的调控作用模式的良好材料[14, 15]。叶色突变体包含一类温敏型突变体。迄今, 低温敏感叶色突变体已有5个基因被克隆, 即virescent-1 V1 (V1virescent1)[16]、virescent-2 (v2) [17]、OsV4[18]、TCD9[19]和WLP1[20]。V1 (virescent1)基因编码一个定位在叶绿体的假定蛋白, C端结构与细菌中的抗终止子NusB (N utilization substance protein B)高度相似, 命名为NUS1蛋白, NUS1蛋白在新叶中特异表达, 且低温下积累增多, 突变体v1在20℃时为黄化表型, 在30℃时为正常绿叶表型, 是因为NUS1蛋白参与调控叶绿体RNA的代谢, 叶绿体内的蛋白翻译机制遭到破坏时无法正常形成叶绿体, 从而形成白化的叶片[17, 21, 22]。OsV4编码一个定位在叶绿体内部的三角状五肽重复区蛋白(PPR), 参与植物细胞器中转录本的修饰[18], 突变体在低温下白化表型一直持续到四叶期, 之后逐渐转绿, 而在高温环境下突变体并无白化表型, 可见OsV4在水稻早期叶绿体发育中起重要作用。TCD9编码一个叶绿体伴侣蛋白α 亚基, 在叶片发育早期促进叶绿体的发育。在拟南芥中伴侣蛋白有很多报道, 但在水稻中并不多见, 在低温下tcd9突变体幼苗的叶绿素含量降低, 叶绿体结构异常, 类囊体片层减少, 但是在高温下突变体呈现正常的绿色[23]。WLP1编码叶绿体核糖体大亚基(50S)蛋白, 是合成蛋白质的细胞器的组成部件, 在低温环境下, wlp1为白叶白穗表型, 而且开花延迟, 株高变高[20]。通过对温敏型叶色突变体基因的定位可以更好地阐释温度对叶色的影响机制, 为实现更高效的光合效率提供重要帮助。
本研究通过EMS诱变得到温敏黄化突变体dy1, 在低温下表现白化, 高温下表现淡绿, 与野生型相比在株高、分蘖数等农艺性状上差异显著。利用dy1/“ 02428” 的F2群体, 将突变基因定位在第1染色体长臂标记Y-4和Y-35之间, 拟作为候选基因进一步研究, 该基因编码一个尿嘧啶核苷酸激酶, 催化尿嘧啶(UMP)形成二磷酸尿核苷(UDP), 在嘧啶合成中起到重要作用, 该基因的突变引起叶绿素合成相关基因表达的显著下调, 推测该基因有可能参与叶绿素的合成途径(图5)。在拟南芥中, 发现一个UMP激酶缺失型突变体dpt1 (defect in psaA/B transcript accumulation 1), 表现幼苗叶片黄化, 该基因可以调节拟南芥光合效率, 并参与光合系统I叶绿素脱辅基蛋白A/B (psaA/B)的转录过程[24, 25], 而本研究的突变体表型与拟南芥dpt1表型不同, 在不同温度下, 呈现不同的叶色, 暗示该基因在水稻中的作用机制更为复杂。本文突变体dy1将为揭示UMP激酶功能和叶绿素合成机理之间的关系提供宝贵材料。
通过化学诱变的方法得到一个温敏黄化突变体dy1, 与野生型相比, dy1株高和分蘖数明显降低, 抽穗期推迟1周。dy1在水稻生长的整个生育期均表现黄化, 且叶片叶绿体结构异常, 叶绿素含量显著降低。dy1突变是由1对隐性基因控制, 被定位在第1染色体Y-4与Y-35之间, 共包含16个ORF, dy1突变体中基因LOC_Os01g73450存在单碱基差异, 拟作为候选基因, 有待进一步分析。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|