第一作者联系方式: E-mail: liuhongyan@caas.cn
表型性状标记在作物遗传育种中具有重要的应用价值。在芝麻地方种质“庙前芝麻”中发现了能够稳定遗传的黄化突变体YL1, 对该突变体的叶片解剖特征、光合特性及农艺性状的比较分析表明, 突变体YL1黄化心叶和平展叶在各个发育时期的叶绿体结构均与同时期野生型存在明显差异, 下表皮气孔保卫细胞数是正常叶的2倍左右。YL1的叶绿素 a、总叶绿素、类胡萝卜素含量均只有同时期正常含量的30%~40%, 叶绿素 b含量只有正常叶的20%; 光合速率在初花期及以前均显著低于同期正常叶, 但到终花期与正常叶相当; YL1的生育期和初花期显著推迟, 株高和单株蒴果数明显降低, 每蒴粒数和千粒重略微降低。显微观察表明, YL1的叶绿体形态结构发育不规则, 基粒和基粒片层数目明显少于野生型, 使得叶绿素含量过低, 属于叶绿体发育异常导致的叶绿素缺少型突变体。
Phenotypic markers play an important role in crop breeding and genetic studies. A yellow leaf 1 (YL1) mutant has been found from sesame landrace “Miaoqian Zhima”, which can be inherited stably. In this study, we compared YL1 mutant and its wild type (WT) in leaf anatomical structure, photosynthetic characteristics and biological traits. The structures of chloroplast in both top leaf and expanded leaves of YL1 were greatly different from those of WT at various development stages. The stomatal guard cell number in abaxial epidermis in YL1 was twice that in WT. In addition, the contents of chlorophyll a, total chlorophyll and carotenoid in YL1 were 30%-40% of that in WT, and the chlorophyll b content in YL1 even as low as 20% of that in WT. At early flowering stage, YL1 showed significantly lower photosynthetic rate than WT, but the difference was not significant at end flowering stage. Compared with WT type, YL1 had significantly longer growth duration, delayed initial flowering time and shorter plant height, but capsules per plant and thousand-seed weight was slightly reduced. The microscopic observation revealed that YL1 is the chlorophyll deficiency mutant due to chloroplast defect, which was characterized with irregular chloroplast structure and reduced grana and granum lamella.
叶片是植物进行光合作用的最重要器官, 其形状、大小、直立的角度、颜色的深浅都会影响光合作用的效率进而影响产量, 因此叶型和叶色变异方面的研究受到遗传学家和育种学家的高度重视[1]。叶色变异发生的频率较高、变异类型较为丰富、表型直观, 在高等植物中发现得较多[2], 它主要是通过基因突变直接或间接地影响叶绿素的合成和降解, 进而导致细胞色素含量、组成和比例发生改变[3, 4]。叶绿素出现缺陷的可能原因有两种, 一是催化叶绿素合成酶的基因突变, 造成叶绿素合成受阻和叶绿体结构发育异常; 二是编码叶绿体结构蛋白的基因突变, 导致叶绿体结构发育受阻, 叶绿素合成减少[5]。叶色突变的种类很多, 按苗期表现, 可分为白化、黄化、浅绿、斑点、条纹等类型[6]; 按叶色变异后能否转绿则可分为转绿和非转绿两种类型[2]。这些突变性状在生产上可能具有重要的应用潜力, 如可将突变材料作为形态标记应用于农作物遗传改良, 尤其是应用于杂交制种时显著提高除杂效率, 确保种子纯度[7, 8]。因此研究叶色突变体的细胞学结构、生理生化特性和光合特性之间的关系具有十分重要的现实意义。叶色突变方面的研究早在20世纪30年代就有报道[9], 在大豆[10]、小麦[11]、烟草[12, 13]、拟南芥[14]、菊花[15]等很多物种中都有发现, 且对发现的叶色突变体的叶绿体超微结构、光合色素含量组成及光合特性也都进行了相应的报道。研究表明, 叶绿素缺陷型突变分为总叶绿素缺陷和叶绿素b缺陷两种[16], 与正常野生型相比, 它们的光合色素含量偏低, 叶绿体数目减少, 叶绿体内部基粒数减少, 基粒片层垛叠数减少, 基粒排列不整齐[17], 或未分化出基粒和基粒片层, 光合膜系统发育程度低[18]; POD活性和MDA含量显著高[19]; 光合速率大多明显低[20, 21], 但也有相反的报道[22, 23]。尽管前人对已发现的叶色突变体进行了形态结构、显微结构、光合特性、生理特性、生化特性等方面的研究, 但结果也千差万别。2010年本课题组在湖北武汉及河南正阳试验基地的地方种质“ 庙前芝麻” 中发现了黄化苗突变体, 该突变体终身黄化, 长势明显比野生型差, 开花期和生育期明显晚于野生型, 其他农艺性状基本与野生型相同。目前关于芝麻黄化苗突变体的研究还未见报道。本研究在参考前人研究的基础上, 对芝麻黄化叶突变体的农艺性状、光合色素含量及组成、叶绿体细胞学结构、气孔特征参数、光合特性、生化特性等进行研究与剖析, 旨在明确该突变材料的黄化机制, 为芝麻育种和生产应用提供理论依据。
为芝麻地方种质“ 庙前芝麻” 及由其自发突变的黄化突变体YL1。YL1经多代隔离繁殖后性状稳定, 与庙前芝麻配制不同分离群体, 初步遗传分析表明, 该黄化性状受1对隐性基因控制(另文发表)。将材料种植于中国农业科学院油料作物研究所武昌试验基地, 共20行, 行长2.40 m, 行距0.40 m, 株距0.15 m, 三至四叶期定苗, 每行13株, 常规管理。
2014年夏季, 在生育后期至成熟期测定叶片长度、叶片宽度(最宽处)、株高、单株蒴果数、每蒴粒数、千粒重, 每性状测5株, 求平均值。
参照Arnon 的方法[24]分别于苗期、初花期、盛花期测定叶绿素含量。从每材料取样5株, 每株取中部全展叶, 用打孔器沿主叶脉两侧快速打数量相等的小圆片(直径为1 cm ), 快速称重后放到事先准备好的提取液(50% 丙酮: 50% 无水乙醇=1︰1)中, 在常温(25~35℃)遮光条件下充分提取约24 h。用Beckman DU 650紫外-可见分光光度计测定波长645 nm 和663 nm 下浸出液的光密度值, 再用修正的Arnon 公式[24]计算出叶绿素a、b及总叶绿素(a+b)的含量[25]。
在苗期和盛花期, 分别选取长势基本一致的突变体和野生型植株各5株, 利用Li-COR-6400便携式光合作用测定仪测定植株中部全展叶光合作用相关参数, 设置LED红蓝光源, 光强800 µ mol m-2 s-1, 叶室温度25℃, CO2浓度400 µ mol m-2 s-1。测定仪软件自动计算得到净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等光合作用相关参数。选晴朗天气, 在上午9:00— 11:00测定, 3次重复, 在读数稳定后读取数值, 取3次平均值为一个观测值。
在六对真叶期, 分别取突变体和野生型植株的心叶和中部全展叶各5片, 在叶片中部, 用尖头镊子撕取下表皮, 立即放入事先滴有1~2滴1% I2-KI溶液的载玻片上染色3~5 min, 再用Olympus BX61光学显微镜观察气孔(10× 、20× 和40× ), 测量气孔大小并照相。每叶片观察4个视野, 统计视野内气孔数。
在初花前分别取突变体和野生型的心叶和六叶期平展叶, 于叶片中部避开叶脉切取长5 mm、宽5 mm的小片, 立即投入FAA固定液固定24 h以上, 用真空泵抽真空, 常规石蜡切片法包埋, LKB超薄切片机切片, 厚度1.5~2.0 µ m, 甲基蓝染色, 加拿大树胶封片, Olympus BX61显微镜下观察并照相。
在苗期、初花期、终花期分别取突变体和野生型植株中部全展叶, 于叶片中部避开叶脉切取长5 mm、宽5 mm的小片, 每材料剪取20片, 立即投入2.5%的戊二醛固定液固定24 h以上, 以真空泵抽气消除气泡使固定液渗入。先用0.1 mol L-1 磷酸缓冲液(pH 7.2)连续冲洗6次, 每次2 h, 再用1%饿酸固定4 h。乙醇系列梯度脱水, 环氧丙烷过渡2次, Epon812树脂包埋, 最后制成超薄切片, 在JEM-2000EX透射电子显微镜下观察并照相[26]。
用SPSS6.0软件进行方差分析, LSD法进行多重比较, Microsoft Excel作图。
芝麻黄化突变体YL1从出苗开始子叶即表现黄化, 之后长出的每片真叶也都表现出明显的黄化, 且终身黄化(图1); 突变体的茎秆、蒴果均出现不同程度的黄化现象; 突变体还表现出株型变小、生长缓慢, 初花期滞后16 d左右, 花期短、开花时间集中, 生育期变长的现象; 突变无致死效应, 能正常开花结实, 但种子千粒重略微降低, 主要经济性状比野生型差。野生型叶片、蒴果、茎杆全生育期为正常绿色(表1和图1)。
| 表1 黄化突变体与野生型主要农艺性状的比较 Table 1 Comparison of agronomic traits between yellow leaf mutant and wild type |
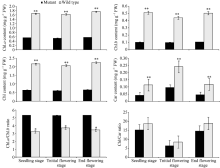
在芝麻整个生育期内, 突变体YL1的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量一直低于同期野生型(图2)。其中叶绿素a含量在苗期、初花期和终花期, YL1分别比野生型低66.46%、67.46%和67.41%; 叶绿素b分别低79.88%、77.50%和78.97%; 总叶绿素含量分别低69.69%、69.60%和70.00%; 类胡萝卜素含量分别低62.61%、59.50%和61.34%, 表明该突变体是叶绿素缺乏突变体, 光合色素含量比野生型低60%~80%。
突变体YL1在苗期和初花期Pn显著低于同期野生型, 分别低45.91%和51.19%, 但在终花期却差异不大; Gs在初花期显著低于野生型(低25.00%), 但在其他时期均差异不显著; 胞间CO2浓度在苗期和初花期均显著高于野生型, 分别高10.49%和6.59%, 但在终花期却差异不大; Tr在初花期显著低于野生型(28.34%), 但在苗期和终花期却差异不明显。由此可见, YL1与野生型在生育早期光合特性存在显著差异, 且在初花期差异最大, 到终花期时突变体光合功能增强, 与野生型没有明显差异。
2.4.1 芝麻黄化突变体的叶片解剖结构 突变体YL1的叶片和叶脉的显微结构与野生型在心叶期无较大差异。野生型最外层的叶脉表皮细胞排列整齐而紧密, 且呈现出规则的圆形, 中部皮层由多层细胞构成, 最里面的维管束组织结构较为发达(图3-A1), 突变体YL1的叶脉表皮细胞与野生型基本相同(图3-B1)。野生型叶片较厚, 上下表皮细胞排列较为紧密, 下表皮的气孔较多, 气孔结构明显, 栅栏组织细胞排列整齐而又紧密, 呈规则的长圆柱形, 海绵组织发育良好, 排列相对较为疏松, 输导组织通畅且清晰(图3- A2, A3, A4); 而突变体YL1叶片厚度减小, 海绵组织排列更为紧密, 无通畅的输导组织(图3-B2, B3, B4)。
突变体YL1平展叶的叶片和叶脉的显微结构与同期野生型相比表现出较大的差异。野生型和突变型YL1的平展叶叶脉表皮细胞与同材料心叶比均无变化, 但突变型YL1的维管束细胞层数更少(图3-C1, D1); 野生型栅栏组织、海绵组织、输导组织与心叶比也无明显的变化, 但突变型YL1的上下表皮细胞呈不规则形, 排列不整齐, 结构松散(图3-D2, D4), 没有明显的一层上下表皮细胞结构(图3-C2, C4), 少量输导组织开始出现(图3-D3)。
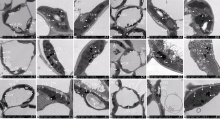
2.4.2 芝麻黄化突变体的叶绿体超微结构观察 野生型苗期叶绿体细胞紧贴细胞壁内侧分布, 发育较为成熟, 呈明显的纺缍形或梭形(图4-A1), 中间稍微膨大, 其中的基粒、基粒片层、基质片层清晰, 基粒片层数较多, 垛叠较高, 基粒之间有较多的基质片层相连, 淀粉粒较大(图4-A2, A3), 过氧化物体体积较大, 呈规则的圆球形(图4-A3)。突变体苗期叶绿体细胞数目与野生型基本无差异, 但大多为不正常细胞, 细胞瘦小(图4-B1)或呈圆形(图4-B3), 细胞之间没有清晰的界线(图4-B1)。叶绿体大多能紧贴细胞壁分布(图4-B1), 少数叶绿体游离分布于细胞内侧, 片层结构明显, 但片层数量明显比同期野生型少(图4-B2); 在初花期, 野生型叶绿体发育良好, 与前期相比, 叶绿体数目基本维持不变(图4-C1)。此期基粒片层垛叠层数较多, 且分布较为均匀(图4-C2, C3), 淀粉粒大小不一, 结构清晰(图4-C2)。与前期相比, 突变体叶绿体数目基本维持不变(图4-D1), 叶绿体中的基粒片层结构清晰, 但片层数量明显变少, 且排列不规则, 无淀粉粒形成(图4-D2, D3), 周围的杂质较多(图4-D2); 在终花期, 野生型叶绿体与前期相比, 数目没有明显的变化, 但淀粉粒明显变多(图4-E1), 少数淀粉粒体积明显变大(图4-E3), 但基粒片层与基质片层的数量及体积却无明显变化(图4-E2)。突变体叶绿体与前期相比, 叶绿体数目似有减少的趋势, 但不明显(图4-F1), 淀粉粒数量明显减少(图4-F3), 基粒与基质片层无明显的变化(图4-F3)。但突变体与野生型相比, 基粒和基质片层的数量明显少得多, 淀粉粒数量也明显偏少。
植物黄化突变的来源广泛, 但它们大多与叶绿素含量和叶绿体形态结构变化有关。目前已发现的叶色突变体种类繁多, Falbel等[16]按叶绿素a/b比值将叶绿素突变体分为两类, 一类完全不含叶绿素b, 如拟南芥突变体[27]、大麦突变体chlorina f2[28]; 另一类总叶绿素及叶绿素b合成减少, 目前报道的突变体多为此类。比如肖华贵等[18]发现, 甘蓝型油菜黄化突变体NY的叶绿体数目和基粒片层数减少是导致叶色黄化的主要原因; 董遵等[29]用氮离子处理获得了一株失绿黄化而后复绿的甘蓝型油菜突变体, 该黄化突变体叶绿体数量少, 膜结构解体, 无类囊体。本研究发现的黄化突变体YL1属于后者, 在芝麻中未见类似报道。YL1来源于自然变异, 从出苗开始即表现黄化, 一直持续到成熟期, 叶绿体数量始终变化不大, 但形态和结构发生了不同程度的改变, 基粒片层数的明显减少, 直接导致叶绿素含量大幅度降低, 叶片黄化。由于黄化持续时间长, 植株的生长发育和农艺性状受到较大影响, 主要表现为生育期推迟, 产量相关性状变差, 这与很多作物突变体特性相似[18, 30, 31]。但该黄化性状稳定, 容易辨认, 可作为标记性状在芝麻杂种优势中加以利用。
关于植物的黄化机制, 不同学者有不同发现。Von Wettstein 等[32]指出, 高等植物叶绿素合成途径中的任何一个步骤出现问题都会导致叶绿素合成受阻。李燕群等[33]研究表明, 水稻黄绿叶突变体507ys中叶绿素含量大幅度降低, 编码叶绿素酸酯α 加氧酶OsCAOI的基因发生突变, 导致突变体黄化; 该突变体在OsCAOI编码区的碱基序列中一个G突变为A, 使谷氨酸突变为赖氨酸, 导致叶绿素酸酯a加氧酶失活, 叶绿素b合成受阻。崔海瑞等[34]发现水稻黄化突变体W1的黄化是叶绿素合成受阻造成的, 受阻部位发生在由PBG转变为Urogen III的过程中。本研究中, 芝麻叶色黄化突变体材料YL1在整个发育过程中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均基本稳定, 比同期野生型低60%~80%, 叶绿素a/b比值明显高于野生型, 而总叶绿素/类胡萝卜素比值却略低于同期野生型。根据高等植物叶绿素合成途径, 初步推测造成芝麻黄化突变体材料YL1叶片黄化的主要原因是在叶绿素a合成之前就出现了异常, 而叶绿素a在向叶绿素b转化过程中也受到了不同程度的阻碍。这一推论有待进一步验证。另外, YL1在不同发育时期类胡萝卜素的含量始终只有正常的40%左右, 有可能是乙酰丙酸途径异常造成的[35]。
气孔是植物进行光合作用和呼吸作用时与外界气体交换的通道, 它同时影响着蒸腾作用、光合作用和呼吸作用等过程。本研究中, 突变体YL1平展叶中气孔保卫细胞的数量远高于野生型, 但各发育时期心叶气孔数量却无显著差异, 这可能是因为黄化突变体叶片较薄, 上表皮接收阳光强烈, 水分易蒸发, 为了减少蒸腾作用锁住水分, 气孔向下表皮移动, 导致下表皮气孔数量大量增加。在光合特性上, 不同时期叶片的净光合速率表现出先升后降的趋势, 其中突变体YL1苗期和初花期平展叶的净光合速率显著低于野生型, 分别为同时期野生型的54.09%和48.81%, 但到终花期时2种基因型的光合速率相近。这是因为进入终花期后芝麻叶片开始衰老, 光合速率明显下降(表2), 而且野生型下降更快, 因而与突变体持平, 在后续的生长发育中部分光合作用将由蒴果完成。突变体YL1的胞间CO2浓度在苗期和初花期均显著高于同时期的野生型, 但气孔导度除初花期达到显著水平外, 其他两个时期均与野生型差异不大。结合气孔数量及光合测定结果, 初步推测气孔数量不是导致黄化突变体YL1光合速率降低的主要原因, 其主要因素可能与叶肉细胞光合活性降低有关。黄化苗叶片中叶绿体结构明显异于正常绿叶, 叶绿体基粒数目和基粒片层数目明显少于同期正常绿叶, 叶绿素含量只有正常绿叶的30%左右, 因此导致叶绿素在捕捉光能时效率低下, 光能转化为化学能时效率也降低, 最终光合速率降低。
| 表2 不同发育时期突变体与野生型叶片的光合作用相关参数比较 Table 2 Photosynthesis indexes of mutant and wild type at different growth stages |
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|