第一作者联系方式: 陈林波, E-mail: chenlinbo2002@sina.com; 夏丽飞, E-mail: xialif@163.com
茶树每年都要开花结实, 消耗大量的养分, 导致茶树鲜叶产量减少和品质降低。了解茶树的不育机制有助于培育茶树不育品种。本研究以福鼎大白茶(父本)、佛香2号(母本)及其杂交后代(不育)茶树花为材料, 利用数字基因表达谱技术对3个茶树花的cDNA文库进行差异基因表达谱分析。筛选出在父本花与子代不育花、母本花与子代不育花之间共有而在父本花与母本花之间没有的差异表达序列1219条,被认为是茶树不育性候选基因。GO功能显著性分析表明, 这些基因功能中代谢过程、催化活性、水解酶活性表现为富集; KEGG代谢分析表明, 差异表达基因涉及氨基酸、糖、次生代谢、植物信号传导途径以及能量代谢等过程。以植物激素信号转导通路分析发现, 16个与生长素信号途径相关基因中, 除5个ARF家族基因在子代不育花中上调表达外, 其他的基因均下调, 推测生长素信号转导是茶树花不育的重要因素。随机抽取5个基因进行实时荧光定量PCR验证, 其结果与测序结果一致。本研究发现的不育候选基因可用于茶树花不育机制的深入研究和不育基因的筛选。
Tea tree ( Camellia sinensis) blossoms every year and a lot of nutrients are consumed by itself during blooming and fruiting, resulting in decreased yield and quality of fresh tea leaf. In the present study, the flowers of Fuding Dabaicha (male parent), Foxiang 2 (female parent) and their hybrid (sterile flowers) were used to construct cDNA libraries and the gene expression profiles were analyzed by Solexa sequencing technology. A total of 1219 candidate sterility genes were identified according to their differential expression between the male/female parent and the hybrid but identical between the two parents. These sterility gene were subject to GO analysis, and metabolic process, hydrolase activity and catalytic activity were enriched. KEGG pathway analysis showed that the sterility genes were involved in biosynthesis of amino acids and carbohydrate, second any metabolism, plant hormone signal transduction, and energy metabolism. In the function group of plant hormone signal transduction, 16 annotated genes were involved in the auxin signal transduction pathway, including five up-regulated AFR genes in the hybrid and 11 down-regulated genes. Thus, we speculate that auxin signal transduction might regulate the flower sterility in tea tree. Five sterility genes were selected randomly for qRT-PCR assay and the result was consistent with that of Solexa sequencing. The candidate sterility genes found in this study are worthy of sterile mechanism research in tea plant and sterility gene screening.
茶树是重要的叶用经济作物, 茶树栽培的目的是收获其营养器官— — 芽叶。因此, 茶树枝叶生长繁茂是茶园高产、稳产的前提, 人们总希望其营养生长旺盛。然而在茶树的生长过程中生殖生长期长, 从当年的花芽分化和花器官发育到下一年的茶果生长成熟, 要花费1年半的时间, 在此期间将消耗大量的营养物质, 从而影响了茶叶的营养生长[1, 2, 3]。对于利用芽叶的茶树来说, 培育不结实的茶树品种是实现高产、优质的关键。因此, 对茶树花的不育机制研究是茶树不育品种培育的理论基础。
植物不育是自然界中的一种普遍现象, 发生的原因复杂, 内源激素失衡[4]、活性氧的积累[5]、物质发生紊乱[6]、能量代谢异常、细胞程序性死亡以及环境条件的改变都会导致植物的不育[7]。目前研究表明不育与内源激素失衡有着密切的关系, 汤继华等[8]对玉米花药中吲哚乙酸IAA含量的分析表明不育系比可育系低, 达到显著水平。解海岩等[9]研究表明棉花3种可育材料(保持系、恢复系和杂种F1)花药中(IAA)均呈先升后降的变化趋势, 且都显著高于对应时期的不育花药。同样, 在其他雄性不育系研究中得到了类似的结果[10]。生长素还调控心皮边缘的轴向对称、胎座框发育, 从而影响雌蕊发育等[11], 这些研究说明了生长素对植物花的不育起重要作用。
以高通量测序技术分析基因表达谱是从转录水平研究整体基因表达差异的有效方法。其灵敏度高和运行成本低, 已逐步取代基因芯片技术成为目前从转录组水平研究基因表达的主流方法, 同时不需要基因组学背景就可以分析新物种的转录表达概况以及有效发掘和鉴定目标基因等[12, 13]。因此, 本研究利用高通量测序技术分析父本花、母本花以及子代不育花的基因表达差异, 以阐明茶树花不育的分子机制、为不育基因的发掘和利用提供理论依据。
选取云南省农业科学院茶叶研究所试验基地10年树龄的福鼎大白茶花(父本)、10年树龄的佛香2号花(母本)以及他们杂交后代5年树龄的不育花, 9月25号采摘它们的花芽、花蕾、花, 利用液氮迅速固样。
选用CTAB-LiC1方法[14, 15], 分别提取花芽、花蕾、花总RNA, 采用2%的琼脂糖凝胶电泳分析RNA降解程度以及是否有污染, 利用Nanodrop检测RNA的纯度、Qubit定量RNA浓度以及用Agilent 2100精确检测RNA的完整性, 将检测合格的总RNA样品送北京诺禾致源生物信息科技有限公司, 富集mRNA、合成双链cDNA和构建文库, 并采用Illumina HiSeq 2000平台测序。
利用RSEM软件的bowtie2将Trinity拼接得到的转录组作为参考序列(ref), 将每个样品的clean reads往ref上绘制mapping。采用TMM对read count数据进行标准化处理, 再利用DEGseq技术分别对父本花与母本花、父本花与子代不育花、母本花与子代不育花进行差异分析。按照FPKM法(Reads per kb per million reads)计算差异基因的表达量[16]。筛选阈值< 0.005以及|log2Fold_change| > 1; 对于差异基因, 如果其log2 Fold_change > 0, 则认为是上调表达, 反之, 若log2Fold_change < 0, 认为是下调表达。
根据研究目的, 不育基因重点筛选在父本花与子代不育花、母本花与子代不育花之间差异表达, 且在父本花与母本花之间没有的差异表达基因。在KOBAS2.0 (http://kobas.cbi.pku.edu.cn/home.do)网站进行DEGs的KEGG代谢途径富集分析。GO和KEGG统计检验中均采用Benjamini Hochberg方法进行多重比对检验。
从测序获得的差异表达基因中, 随机挑选5个进行实时荧光定量PCR测定, 采用CTAB-LiC1法[14, 15]提取总RNA。按照Fermentas公司的RevertAid First Strand cDNA Synthesis Kit说明书合成cDNA。依据测序所得序列库对应的代表序列, 使用Primer 5.0软件设计实时荧光定量PCR引物, 以茶树的18S (AB120309.1)基因作为内参基因(表1)。实时荧光定量PCR的反应体系及程序参见Fermentas公司的SYBR Green master mix说明书, 设实验重复3个, 采用2-Δ Δ CT法计算基因相对表达量。
| 表1 实时定量PCR选用基因及引物 Table 1 Genes and primers list for qRT-PCR |
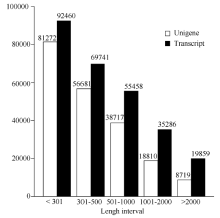
对父本花(FB_H)、母本花(MB_H)、子代不育花(ZD_H)转录组测序, 经去除接头、N和低质量reads, 在父本花中获得58 121 920条clean reads, 在母本中获得73 150 088条clean reads, 在不育子代中获得68 216 824条clean reads。获得序列的Q30值均大于91%, GC含量均大于43% (表2), 符合下一步分析要求。再利用Trinity对clean reads进行拼接共获得272 804条转录本(Transcripts)序列, 取每条基因中最长的转录本作为Unigene, 筛选出204 199条Unigene, 总长为120 173 858 bp, 平均长度为588 bp。对转录本及Unigene的长度分别统计, 其中Unigene小于301 bp的有81 272条, 分布在301~501 bp的有56 681条, 大于2000 bp的有8719条(图1)。
| 表2 数据产出质量情况一览表 Table 2 List of sequencing data quality |
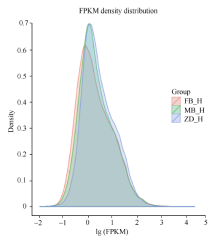
对于没有参照基因的茶树来说, 根据Trinity拼接得到的转组本作为参考序列, 将每个样本的clean reads往ref上绘制mapping。父本花获得42 291 172条mapping, 占clean reads 72.76%。母本花获得53 537 284条mapping, 占clean reads 73.19%。子代不育花获得48 115 182条mapping, 占clean reads的70.53%。再利用RSEM的bowtie2对bowtie软件进行比对, 并对比对的结果进行FPKM转换及FPKM密度分布(图2)。从图中看出父本花、母本花、子代不育花之间的基因表达存在差异。
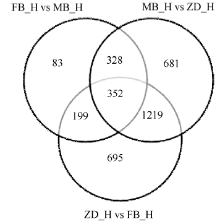
对于无生物学重复的样品, 先采用TMM对read count数据进行标准化处理, 再用DEGseq进行差异分析, 为了控制假阳性率, 需Q-value结合Fold_ change来筛选, 差异基因筛选条件为阈值 < 0.005 & |log2Fold_change| > 1。统计各组比较得到的差异基因个数并作维恩图(图3)。根据研究目的, 不育相关基因选择在父本花与子代花、母本花与子代之间共有的且在父本与母本之间没有的, 拟定为不育相关基因, 共筛选出1219个。
对获得的不育相关基因进行GO功能显著性富集分析, 在1219个差异基因中有952个被注释, 占78.1%, 并被分为生物过程(biological process, BP)、分子功能(molecular function, MF)和细胞组件(cellular component, CC) 3个功能注释, 进一步划分为24个类别。其中生物过程的类别最多, 有16个, 分子功能有7个类别, 细胞组件仅有1细胞壁类别。因为同一基因可能含有1个或多个功能注释, 从图4中可以看出参与代谢过程的最多, 为625个, 其次是催化活性, 为569个, 推测茶树不育花中的代谢是紊乱的。
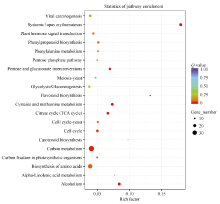
在KEGG数据库中对不育相关基因进行pathway注释和分类表明, 不育相关基因注释到116个pathway, 涉及到核酸、氨基酸、糖以及次生代谢等多个方面。对20条富集最显著的pathway绘制散点图(图5)。从图可以看出富集到碳代谢途径的基因条数最多, 其次是氨基酸的生物合成。从富集显著性看, 半胱氨酸和蛋氨酸代谢、戊糖和葡萄糖醛酸转换、酒精中毒、三羧酸循环等最为显著。
生长素作为植物中一种重要的内源激素, 在植物花的生长发育中发挥重要作用。不育基因的KEGG代谢通路分析表明, 在植物激素信号转导途径(ko04075)中有16个与生长素转导有关(表3), 其中在不育花中下降的基因包括生长素载体AUX1 LAX家族、生长素响应的GH3家族、生长素反应蛋白IAA和SAUR家族, 上调的为生长素响应因子ARF。
| 表3 生长素转导相关的差异表达基因 Table 3 Differentially expressed genes of auxin signal transduction pathway |
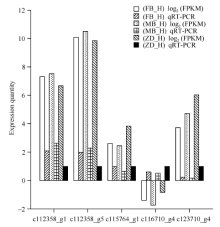
随机筛选出5个差异表达基因c112358_g1、c112358_g5、c115764_g1、c116710_g4和c123710_g4进行qRT-PCR验证, 分别提取父本花、母本花、子代不育花总RNA, 反转录后进行定量PCR验证。并根据所得数据以log2(FPKM)进行标准化处理。从图6可以看出, 5个差异表达基因在父本花、母本花以及子代不育花中的相对表达量与表达谱分析的变化趋势一致, 说明基因表达谱的分析结果可靠。
高通量测序的数字表达谱分析技术是一种从整体水平研究特定试验条件下基因表达的有效方法[17]。本试验通过高通量测序技术建立了福鼎大白茶花(父本)、佛香2号花(母本)以及他们的杂交后代不育花的表达谱, 探索正常花(父本、母本)与不育花(子代)在转录组水平上的差异。利用Solexa测序技术研究正常花与不育花之间的基因表达谱差异, 筛选茶树花不育基因以及对进一步阐明茶树花不育的分子机制具有重要意义。
为了获得茶树花的不育相关基因, 通过对父本花与子代不育花、母本花与子代不育花以及父本花与母本花基因的差异表达分析, 筛选在父本花与子代花、母本花与子代之间共有而在父本与母本之间没有的差异表达基因拟定为茶树花的不育相关基因, 共筛选出1219条。通过对拟定的不育基因进行GO功能分析发现, 参与生物过程的最多, 其次是分子功能, 细胞组件最少。大部分不育基因富集在生物过程中的代谢过程和分子功能中的催化活性, 这与An等[8]的油菜可育和不可育的转录分析结果类似。GO功能注释中找到了许多目前已证实与不育相关的生物过程, 包括植物激素信号转导、物质代谢和能量代谢等[4, 5], 表明茶树花的不育涉及到众多生物过程。
过去研究已经证实植物不育与线粒体氧化磷酸化复合体(OPC)功能紊乱有关[18]。在拟定的952个不育基因中筛选出与线粒体氧化磷酸化复合体有关的NADH脱氢酶5条、琥珀酸脱氢酶2条、细胞色素还原酶1条、细胞色素氧化酶1条、F1F0-ATP酶1条。另外, 在拟定的不育基因中还鉴定出6个编码含MADS-box转录因子的基因片段。MADS-box基因家族是目前研究最清楚的, 它对花器官发育以及在决定花器官特征方面发挥着重要的调控作用[19, 20]。上述结果表明所筛选的差异表达基因在决定茶树花不育机制方面具有重要作用。另外, 在差异表达基因中有267个是没有功能注释或没有报道过的, 它们的作用机制还不清楚, 有待开展更深入的研究。
生长素是植物体内的重要内源信号转导物, 对调控植物器官发生和形态建成起关键作用, 参与雄蕊形成, 花丝延伸, 花粉发育、花药开裂以及维管组织发育等诸多过程[21, 22]。在拟定的不育基因中有16个与生长素转导有关, 包括生长素载体AUX1/LAX家族以及生长素响应基因GH3家族、SAUR家族和ARF家族。除5个ARF家族基因在子代不育花中上调表达外, 其他的均为下调表达。AUX1/LAX家族是目前已知的最主要的生长素输入载体, 能将植物体内生长素运输到各组织, 从而调节植物体的生长发育[11]。ARF能够特异地与生长素响应元件TGTCTC结合, 激活或抑制基因的表达[23]。ARF还能与Aux/IAA抑制子结合形成二聚体, 阻遏基因的转录[24, 25]。SAUR和GH3是生长素专一诱导的基因, 受生长素调控[20]。根据本研究结果可以推测, 生长素在不育子代花中不能正常的运输, 导致生长素作为一种“ 分子胶” 影响了受体和底物结合, 使下游基因的转录受到抑制[26]。同时生长素含量低, 使Aux/IAA蛋白与ARF结合, 阻遏了基因的转录。
共筛选出不育相关基因1219个, 涉及到核酸、氨基酸合成、蛋白质、糖代谢、次生代谢、植物激素信号转导等116个pathway。本研究从全转录组层面揭示了茶树正常花和不育花基因表达的差异, 为挖掘不育基因以及深入研究不育分子机制提供了丰富的信息, 在茶树花的不育机制中生长素信号转导起重要作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|