第一作者联系方式: E-mail: fbs1006@126.com **同等贡献(Contributed equality to this work)
Pm48为本实验室鉴定的一个抗白粉病新基因。为精细定位该基因, 利用混池ddRAD测序鉴定了81个与该基因关联的序列, 开发了STS标记 Xmp931, 转化了CAPS标记 Xmp928、 Xmp930和 Xmp936; 同时, 利用粗山羊草基因组序列开发了71个基因组SSR标记, 定位了其中的 Xmp1089和 Xmp1112。在115个宁糯麦1号×Tabasco衍生的 F2:3家系中, Xmp928与目的基因共分离, Xmp1112位于近着丝粒方向处距抗病基因3.1 cM。在671个纯合感病家系中, 标记 Xmp928仍与目的基因共分离。利用3个中国春5DS缺失系, 最终将 Pm48定位在小麦5DS上0.63-0.67的臂区段中。
Pm48 is a novel powdery mildew resistance gene identified previously in our laboratory. This study aimed at developing close molecular markers for fine mapping of the gene. The ddRAD-sequencing assay revealed 81 SNPs associated with the target gene, in which one converted into the STS marker Xmp931 and three converted into the CAPS markers Xmp928, Xmp930, and Xmp936. We also developed 71 genomic SSR markers according to the genome sequence of Aegilops tauschii. And mapped two of them, Xmp1089 and Xmp1112. Using the 115 F2:3 families derived from the cross of Ningnuomai 1 × Tabasco, the target gene was found to be co-segregated with Xmp928 and distal to Xmp1112 with the genetic distance of 3.1 cM towards centromere. In the 671 homozygous susceptible families, Xmp928 also showed co-segregated with the target gene. We also physically mapped Pm48 to the bin of 5DS 0.63-0.67 by using three Chinese Spring 5DS deletion lines.
由禾布氏白粉病菌(Blumeria graminis f. sp. tritici)引起的白粉病是小麦的重要病害, 在严重流行年份可导致小麦减产34%以上[1]。抗病品种在小麦白粉病防治中发挥了重要作用, 但白粉病菌的变异会导致抗病品种丧失抗性, 因此需要不断挖掘新的抗病基因来培育小麦抗白粉病新品种。
随着分子标记技术的发展, 分子标记的类型逐渐丰富, 如初期的RFLP (restriction fragment length polymorphism)、AFLP (amplified fragment length polymorphism), 以及根据序列开发的SSR (simple sequence repeats)、STS (sequence tagged sites)、CAPS (cleaved amplified polymorphic sequence)、dCAPS (derived cleaved amplified polymorphic sequence)、SNP (single nucleotide-acid polymorphism)等。分子标记类型的丰富以及越来越成熟的分子标记技术极大地推动了小麦抗白粉病新基因的发掘, 越来越多的小麦抗白粉病基因通过分子标记技术得到鉴定, 如Pm47[2]、Pm50[3]、Pm51[4]等。迄今为止, 已经在50个位点报道了80多个抗白粉病基因[5], 分布在小麦除4D和5A以外的所有染色体上。
由于小麦还没有完整的基因组序列, 在特定染色体区域开发标记一般需要借助物理定位的EST、共线性关系、基因组序列、SNP芯片序列信息开发标记。在小麦中, 不同倍性小麦的遗传和物理图谱信息、网上公布的水稻、短柄草、大量小麦EST序列信息和小麦基因组序列信息等是用于饱和目标基因区域遗传图谱的重要标记来源。这些信息为开发新的标记奠定了良好的基础。
近年蓬勃发展的高通量测序也是基因型分析的一种新策略。为了降低复杂基因组的测序费用, 研究者已经提出了基于第二代测序技术的简化代表文库测序策略[6], 其中最简单的方法是分离纯化特定片段大小范围的限制性酶切片段。如, 利用RAD (restriction site-associated DNA, 限制性酶切位点关联DNA)测序方法已成功构建了若干高密度遗传图谱[7, 8]。而ddRAD (double-digest RAD, 双酶切RAD)测序是RAD衍生的一种测序策略[9], 与RAD的单末端测序相比, ddRAD的双末端测序能够增加标记的特异性和准确性。近年, 在花生[10]、草莓[11]、油菜[12]等物种中已经利用该测序方法构建了若干高密度遗传图谱。
目前, 已经克隆的小麦抗病基因有Lr10[13]、Vrn1[14]、Yr36[15]和Lr34/Yr18/Pm38[16]等, 而抗白粉病基因只克隆了Pm3[17]和Pm21[18]。本实验室在德国小麦品种Tabasco中鉴定到抗白粉病基因Pm46, 位于5DS染色体上[19], 后由于基因重名被重新命名为Pm48[20]。本实验室鉴定了与Pm48紧密连锁的分子标记, 但只包括1个显性STS标记和5个SSR标记[19]。显性标记在分离群体中的带型信息相对较少, 不利于该基因的有效利用; 另外, SSR标记由于是基于重复序列的标记类型, 没有足够的序列信息, 不利于抗病基因的比较基因组学分析及进一步精细定位。因此, 本实验室深入研究并开发了与Pm48紧密连锁的新类型分子标记, 为该基因的分离和有效利用奠定基础。
利用抗小麦白粉病的德国品种Tabasco与本实验室培育的糯性感病品种糯麦1号, 经杂交和自交获得4129个宁糯麦1号× Tabasco F2单株, 用于抗性遗传分析; 从436个F2:3家系[19]中随机选择115个家系组成分离群体用于新开发分子标记的多态性分析和定位。
利用“ 中国春” 及其缺失系del5DS-1、del5DS-2和del5DS-5进行目标分子标记的染色体臂定位, 其中del5DS-1保留有5DS末端63%长度, 缺失了37%的染色体长度, del5DS-5保留有染色体5DS末端67%长度, 缺失了33%的染色体长度, del5DS-2保留有5DS末端78%长度, 缺失了22%的染色体长度[21]。
参考高海东等[19]报道的方法评价白粉病抗性。将小麦种子播在72孔的穴盘, 亲本品种及家系各播种15~20粒, 每穴盘随机种植9粒感病对照苏麦3号。于幼苗一叶期人工接种, 将充分发病的足量苏麦3号叶片悬于待接叶片上方, 轻轻抖落病菌孢子, 菌种为南京地区流行的Bgt18。在人工智能气候室(14 h光照/10 h黑暗, 18~22℃, 相对湿度80%~90%)中培养接种后的麦苗。接种后7 d当感病对照表现出明显病症时调查病情, 按盛宝钦[22]的0~4级分类方法记录, 即0级为免疫, 植株无病斑, 0; 级为坏死反应, 叶片有枯死斑, 1级为高抗, 病斑直径小于l mm, 菌丝层稀薄可见绿色叶面, 偶见较大病斑, 但仍透绿, 产孢量极少, 2级为中抗, 叶片病斑直径小于l mm, 但菌丝层较厚, 不透绿, 能产生一定量孢子, 3级为中感, 叶片病斑多, 且直径大于l mm, 菌丝层厚, 产孢量大, 但病斑不连片, 4级为高感, 叶片病斑直径大于l mm, 菌丝层厚, 产孢量多, 病斑连片。
1.3.1 基于ddRAD测序获得的序列 根据前期F2:3家系的分子鉴定结果[19], 从中随机选取50个纯合抗病家系和50个纯合感病家系, 每家系选取8株, 将其DNA等量混合构建抗池(BR)和感池(BS), 由南京集思慧远生物科技有限公司进行ddRAD测序。根据抗感池序列SNP是否产生酶切位点差异, 决定转化成CAPS或dCAPS标记。如果抗、感池间的SNP存在酶切位点的差异, 则直接将该SNP标记转化成CAPS标记, 即在SNP位点两侧设计引物, 并利用相应的限制性内切酶进行酶切; 如果抗、感池间的SNP不存在酶切位点的差异, 则利用软件dCAPS Finder 2.0 (http://helix.wustl.edu/dcaps/dcaps.html)和Primer 5.0将SNP转化成dCAPS标记, 即在引物中引入错配与SNP位点形成新的酶切位点。新开发的多态标记信息见表1。
| 表1 基于ddRAD测序和粗山羊草基因组序列新开发的标记信息 Table 1 Information of primers newly developed based on ddRAD-seq and Aegilops tauschii genome sequence |
1.3.2 基于粗山羊草基因组序列 高海东等[19]鉴定出Pm48的紧密连锁标记Xmp510。本研究利用Xmp510序列及ddRAD测序获得的多态标记序列, 在线搜索比对粗山羊草标记序列(http://probes.pw.usda.gov/WheatDMarker/ phpblast/blast.php)。先对相应的粗山羊草基因组序列进行SSR筛查, 然后用MACVECTOR V8.0 (Accelrys, UK)设计引物, 并进行亲本及抗感池间多态性筛选。新开发的多态标记信息见表1。
参照Ma等[23]报道的SDS法, 从小麦嫩叶中提取总DNA, -4℃保存。在SENSOQUEST LABCYCLER PCR仪(德国)上扩增, 反应体系为10 µ L, 包括1× buffer 10 µ L (含MgCl2 15 nmol), DNA模板1 ng, 上、下游引物各2 pmol, 2 nmol的dNTPs, 1 U Taq酶。PCR程序为94℃预变性5 min, 然后按94℃变性30 s、50~60℃退火45 s、72℃延伸50 s进行36个循环扩增, 最后72℃延伸7 min。扩增产物经8%非变性聚丙烯酰胺凝胶电泳, 银染法显色。
CAPS标记选择特定的限制性内切酶(TaKaRa), 如Alu I、Acc I、Mae II、Hpy 188I和Taq I, 按生产商说明书进行酶切反应, 反应体系8 µ L, 含PCR产物约50 ng, 于37° C或65° C (依酶特性而定)过夜, 用8%非变性聚丙烯酰胺凝胶电泳分离检测酶切产物。
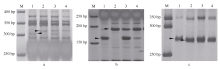
对抗池、感池进行ddRAD测序, 获得81个可能与Pm48关联的SNP序列, 将其中14个关联性强的SNP标记转化为STS或者CAPS标记。其中, Xmp931在抗、感亲本间有多态性, 且与抗、感池表现一致; Xmp928(图1-A)、Xmp930(图1-B)和Xmp936经相应的限制性内切酶酶切后, 在抗、感亲本以及池间表现一致多态性。利用这4个新开发的标记检测115个F2:3家系, 结果4个标记均被定位于Pm48的遗传图谱上, 其中Xmp928与目标基因共分离, Xmp931、Xmp936和Xmp930位于远着丝粒的一侧, 与目标基因分别相距7.8、9.7和15.7 cM (图2-A)。
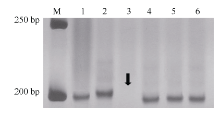
利用已定位Pm48连锁标记序列信息, 比对粗山羊草基因组序列, 开发了71个gSSR标记, 其中Xmp1089(图1-C)和Xmp1112 (图3)在抗、感基因型间存在多态性, 并且被整合到Pm48连锁图谱中, 距Pm48分别为3.1 cM和10.8 cM (图2-A)。
利用3个中国春5DS缺失系对Pm48进行染色体臂定位, 结果显示Xmp1112位于小麦5DS 0.63~0.67的染色体区段(图3), 在该染色体区段中已定位标记Xcfd81[19], 同时连锁图谱显示Pm48位于这2个标记之间(图2-A), 因此认为Pm48位于小麦5DS 0.63~0.67的染色体区段(图2-B)。
利用4129个F2单株, 通过接种Bgt18鉴定抗病性, 结果有3103个抗病单株和1026个感病单株, 符合单个显性基因的3︰1分离(χ 2=0.04; χ 20.05, 1=3.84)。这些感病单株移栽后完成整个生育期并收获种子的有671个家系, 对每个家系衍生的15~20个植株进行表型鉴定后, 推测均为纯合感病家系。利用位于Pm48两侧的分子标记对这671个纯合感病家系进行基因型检测, 其中共显性标记Xmp1112和Xcfd81分别筛选到12个和8个重组家系; 标记Xmp928和Xmp510对这19个重组体进行基因型的分析结果表明, Xmp510检测到5个重组体, Xmp928没有检测到重组体, 与目标基因共分离(表2)。
| 表2 19个纯合感病重组体基因型分析和分类 Table 2 Genotype classification of the 19 homozygous susceptible recombinants |
为进一步精细定位小麦抗白粉病基因Pm48, 本研究利用简化测序和粗山羊草基因组序列信息开发了6个新标记。与实验室之前发表的遗传图谱[19]相比, 本研究在Xgwm205与基因之间新增了2个gSSR标记(Xmp1089和Xmp1112), 将Pm48界定在Xmp510和Xmp1112之间的4.6 cM之间, 为基因的进一步分离奠定了基础。此外, 还开发了一个与基因共分离的标记Xmp928, 该标记无论在小群体中还是在扩大的纯合感病家系中均与抗病基因共分离, 将作为抗病基因Pm48的重要选择标记。Xmp928是重复序列连接(repeat junction)类型的标记, 这类标记在重复序列超过80%的小麦基因组中非常丰富[27], 将是小麦基因定位的重要标记类型, 然而该类型标记无法与基因序列关联, 很难为基因分离提供帮助。
简化测序可以降低测序成本, 根据性状混池后测序更进一步降低成本。本研究利用ddRAD测序成功开发了3个CAPS标记和1个STS标记, 转化了与基因关联性强的14个SNP标记, 其中4个(28.6%)为多态性标记, 而其余标记没有多态性。对于没有转化成功的10个SNP标记, 推测是由于ddRAD测序后获得的重复序列导致非特异性以及扩增引入的错配。本研究还利用粗山羊草基因组序列开发了71个gSSR标记, 但只有2个被定位, 多态率为2.8%, 远低于其他研究报道的gSSR的多态率[28, 29, 30]。推测可能的原因, 一是D基因组的多态性偏低[28, 29, 30], 二是Tabasco、宁糯麦1号两亲本的分子标记多态率低。对比上述两种方法, 利用混池的ddRAD测序效率较高。
本研究利用5DS缺失系成功将抗病基因Pm48定位在小麦5DS 0.63-0.67的染色体区段中, 这一区段的物理距离大约为55 Mb [31]。标记Xcfd81和Xmp1112相距8.0 cM, 假定两标记位于边界, 该区域的重组率估算为0.145 cM/Mb, 低于Erayman等[32]在该区域估算的重组率(0.341 cM/Mb), 并非重组热点区域。尽管如此, 该区段较小的物理距离仍然将有助于抗病基因的分离。本实验室将在以下两方面进一步研究, 一是解决标记多态性低的问题, 准备利用不同的感病亲本与Tabasco构建多个分离群体, 构建Pm48的饱和遗传图谱; 二是利用混池进行转录组测序, 发掘Pm48候选基因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|