第一作者联系方式: E-mail: yongjians1980@163.com
以氮高效品种(德香4103)和氮低效品种(宜香3724)为材料, 利用13C和15N双同位素示踪技术和生理生化分析方法, 采用盆栽及大田试验, 在施氮量180 kg hm-2条件下, 设置3种氮肥运筹方式, 基肥∶蘖肥∶穗肥比例分别为5∶3∶2 (N1)、3∶3∶4 (N2)、3∶1∶6 (N3), 以及不施氮(N0)处理; 研究其对不同氮效率水稻花后氮碳代谢的影响, 并探讨氮肥后移下花后光合同化物及氮素累积、转运、分配的共性响应机制及其与产量的关系。结果表明, 品种、氮肥运筹对花后氮素利用特征、光合同化物分配、生理特性及产量均存在显著影响。氮高效品种与氮肥后移量占总施氮量的40%、氮素穗肥运筹以倒四、倒二叶龄期等量追施相配套(N2处理), 能促进花后氮素累积, 提高剑叶光合速率和1,5-二磷酸核酮糖羧化酶、谷氨酰胺合成酶等碳氮代谢关键酶活性, 促进叶片、茎鞘、根系、穗各营养器官光合同化物及氮素累积与转运, 进而提高产量及氮肥利用率, 为本试验氮高效品种配套的氮肥运筹优化模式。花后不同氮肥运筹下, 氮高效品种光合同化物、氮素的累积与转运, 分别较氮低效品种高7.78~12.75 mg13C 株-1、15.14~18.78 mg15N 株-1; 且叶片转运量分别较氮低效品种高1.70~2.93 mg13C 株-1、2.21~4.55 mg15N 株-1, 茎鞘转运量分别较氮低效品种高1.70~2.93 mg13C 株-1、0.05~1.14 mg15N 株-1; 而穗部氮高效与氮低效品种13C同化物分别增加31.04~ 44.68 mg13C 株-1(占13C总量的42.04%~46.38%)、24.94~34.26 mg13C 株-1(占13C总量的36.45%~41.36%),15N则分别增加35.56~46.58 mg15N 株-1(占15N总量的61.82%~82.93%)、27.37~31.57 mg15N 株-1(占15N总量的58.04%~68.31%)。氮高效品种花后具有强光合碳同化、氮素的协同吸收转运特征, 以及碳氮代谢能力, 来满足籽粒灌浆期对光合同化物及氮素的利用, 是氮高效品种相对于氮低效品种高产、氮高效利用的重要原因。此外, 从花后不同器官碳氮比(C/N)变化值综合两品种高产及氮肥高效利用来看, N2处理下, 齐穗至成熟期叶片、穗部C/N提高幅度与该时期茎鞘、根系C/N降低幅度一致, 据此可将C/N作为水稻高产及氮肥高效利用同步提高的评价指标, 这具有重要的参考价值。
The optimal nitrogen (N) managements and the selection of genotypes with high N use efficiency (NUE) play a vital role in rice production aiminged at high yield and high NUE. Two rice cultivars, one with high-NUE (Dexiang 4103) and the other with low-NUE (Yixiang 3724) were used in pot and field experiments in 2013 and 2014. The total N fertilizer applied was 180 kg ha-1 of urea and three treatments were included: 1) 50% basal dressing, 30% topdressing at 7 d after transplanting (DAT), and 20% topdressing at 4th leaves emerged from the top (N1), 2) 30% basal dressing, 30% topdressing at 7 DAT, 40% topdressing was split into two equal applications at 4th and 2nd leaves emerged from the top, 3) 20% basal dressing, 20% topdressing at 7 DAT, 60% topdressing was split into two equal applications at 4th and 2nd leaves emerged from the top, respectively. Double isotope tracing technique of13C and15N and physiological-biochemical analysis were used to study the accumulation, translocation, distribution of N and photosynthate, and the correlation between morphology and physiological-biochemical characteristics and their relationships with grain yield. There were significant effects of cultivars and N application modes on grain yield, as well as the absorption and translocation of N and photosynthate from full-heading to maturity stage. Compared with N1and N3, N2 treatment with high-NUE was the best model in this paper referred as the variety and N application coupling model, which could improve N accumulation in rice plant after anthesis, increase photosynthetic rate, activities of ribulose 1,5-bisphosphate carboxylase, and glutamine synthetase in flag leaves, promote accumulation and translocation of photosynthate and N, and then improve the yield and NUE. Double isotope labeling results showed that the accumulation amount of photosynthetic products and N in rice plant with high-NUE was 7.78-12.75 mg13C plant-1 and 15.14-18.78 mg15N plant-1 higher, the translocation amount of photosynthate and N in leaves with high-NUE was 1.70-2.93 mg13C plant-1, 2.21-4.55 mg15N plant-1 higher, the translocation amount of photosynthate and N in leaf sheaths with high-NUE was 1.70-2.93 mg13C plant-1, 0.05-1.14 mg15N plant-1 higher than those with low-NUE, respectively. From full-heading to maturity stage,13C photosynthate in the spike with high-NUE and low-NUE respectively increased by 31.04-44.68 mg13C plant-1(accounting for 42.04%-46.38% of total amount of13C) and 24.94-34.26 mg13C plant-1 (accounting for 36.45%-41.36% of total amount of13C), while,15N accumulation in the spike with high-NUE and low-NUE respectively increased by 35.56-46.58 mg15N plant-1(accounting for 61.82%-82.93% of total amount of15N) and 27.37-31.57 mg15N plant-1 (accounting for 58.04%-68.31% of total amount of15N). Compared with low-NUE, the high NUE rice cultivar is more beneficial to the accumulation and translocation of photosynthate, with higher N absorption capacity, stronger N translocation ability, and stronger C and N metabolism capacity in leaves, satisfying the N demand of plants during their grain forming stage, which is the important reason for high-NUE rice cultivar further to increase yield and NUE. From, the information of C/N ratio in different organs after-anthesis, combined with the results of high yield and high NUE in different varieties under N2 treatment, from full-heading to maturity stage, the C/N increasing range in leaf and panicle is the same as the reducing range in leaf sheaths and roots. Therefore, C/N ratio in different organs from full-heading to maturity stage might be a candidate indicator for high yield and high NUE in rice production.
氮肥运筹技术是水稻高产高效栽培技术的重要组成部分, 也是水稻配套栽培技术形成的重要基础[1, 2]。水稻籽粒产量主要取决于碳代谢和光合作用的物质生产能力, 以及花后光合同化物的运转和分配效率[3, 4]; Kumar等[3]研究证实, 水稻籽粒产量9%~43%来自花前储藏的非结构性碳水化合物, 而花后光合产物对产量的贡献为57%~91%; Lu等[4]利用Ba13CO3产生的13CO2示踪标记研究表明, 水稻光合固定的13C-同化物地上部占45.3%~95.0%。同时, 水稻营养体内及再生器官内的氮代谢、氮素积累与再分配也是决定产量的重要因素[5, 6, 7]; Mea等[5]报道水稻相当部分氮素从营养器官转运至籽粒中, 其中约64%来自叶片, 叶鞘及茎占20%; 黄见良等[7]应用15N示踪技术研究表明, 水稻分蘖期、幼穗分化期吸收的15N, 至成熟期分别有39%和46%转运至籽粒。然而以上研究多偏重于碳、氮代谢单方面[3, 4, 5, 6, 7]。在水稻花后籽粒产量形成过程中, 碳氮代谢在稻株体内的变化直接影响碳、氮物质的形成、转化及分配, 碳氮代谢调节机制是相互偶联互相制约的, 不仅碳代谢受氮素水平的调节, 氮代谢途径相关酶与代谢产物同样受碳代谢相关产物的反馈制约[8]。此外, 水稻花后光合同化物及氮素累积、转运、分配的比例也取决于品种本身的特性[9, 10, 11, 12], 且不同品种类型[9]、不同穗重品种[10, 11]、不同氮效率品种[12, 13]碳、氮代谢差异显著, 以及不同品种对氮肥运筹的响应也不太一致[2, 13, 14], 但多数研究集中于不同水稻品种氮素利用差异及氮代谢[10, 11, 12]。对于不同氮效率水稻品种花后光合同化物精确定量转运、分配是否存在差异; 以及不同氮效率水稻花后叶片、茎鞘中氮转移的差异对光合同化物的转运及分配效率是否存在协同作用, 均鲜见报道。为此, 以国内外相关的研究[3, 4, 5, 7, 8, 9, 10, 11, 12, 13]及我们前期研究的结果[2, 6]为基础, 本研究选用不同氮利用效率的水稻品种为供试材料, 利用13C和15N同位素示踪技术和生理生化分析方法, 采用大田及盆栽试验, 探究氮肥运筹对不同氮效率水稻花后光合同化物及氮素累积、转运、分配的共性响应机制, 明确其花后碳氮代谢与各营养器官氮碳比间的关系, 揭示其光合产物运转分配的特性及其生理机制, 提出高产且氮高效水稻品种共性的氮肥运筹模式, 为水稻高产高效氮肥运筹技术的应用、超高产氮高效水稻品种的选育提供理论基础和依据。
试验于2013— 2014年在四川成都温江四川农业
大学水稻研究所网室试验场进行, 并设置大田试验进行佐证。盆栽试验用土取自大田试验同一田块, 耕层土壤质地为沙质壤土, 理化性状见表1。2011— 2012年从广泛应用且适宜在本地区种植的18个杂交籼稻品种中, 在4种施氮水平(纯氮0、90、180、270 kg hm-2)及基肥∶ 蘖肥∶ 穗肥比例为5∶ 3∶ 2条件下, 以氮效率及产量分类评价为基础, 筛选出生育期基本一致、氮效率存在显著差异的2个中籼迟熟型杂交籼稻品种(表2)为试材[2]。
| 表1 试验田耕层土壤(0~20 cm)理化性状 Table 1 Physicochemical characteristics of soil (0-20 cm) in the experiments |
| 表2 供试品种产量表现及氮利用率 Table 2 Yield performance and N use efficiency of two experimental rice cultivars |
1.1.1 盆栽试验 施氮(15N标记的尿素, 上海化工研究院, 丰度为10.02%)水平按实际生产水平180 kg hm-2 (折算1.0 g N 株-1), 设置3种氮肥运筹方式, 即基肥∶ 蘖肥∶ 穗肥比例分别为5∶ 3∶ 2, 3∶ 3∶ 4, 3∶ 1∶ 6, 另设不施氮处理, 分别记为N1、N2、N3、N0; 分蘖肥在移栽后7 d施用; 孕穗肥N1处理在倒四叶龄期一次性施入, N2和N3处理分别在倒四、倒二叶龄期分2次等量施入。用脉冲标记法[4]略加改进, 在齐穗期晴天9:00— 15:00, 13CO2标记在3个透明有机玻璃同化箱(通光率> 85%, 1.5 m× 1.5 m× 1.8 m)中进行, 通过滴管向各同化箱内顶端悬挂着4个装有NaH13CO3(美国剑桥CIL, 丰度99.0%)的容器中缓慢注入2 mol L-1硫酸, 并立即密封加样孔, 进行13CO2均匀饲喂, 室内CO2浓度400 μ l L-1, 开动小风扇混合空气, 并用CO2监测仪(GXH-3010E)连续测定, 同时同化箱上通自来水降温, 盆钵在同化箱内两因素随机区组排列。试验用盆钵高27.6 cm, 上口径33.3 cm, 下口径28.5 cm, 每盆装混匀、过筛干土15.0 kg, 两年均于5月18日移栽四叶一心的秧苗, 每盆2穴, 每穴1株, 每个处理40盆(其中施用15N标记, 每个处理15盆), 全部基施磷肥(过磷酸钙)施用量折合P2O5 90 kg hm-2, 钾肥(氯化钾)施用量折合K2O 180 kg hm-2。开花处理前筛选出每个处理具有代表性, 且已进行15N标记的9盆, 以及N0处理, 进行13CO2饲喂。齐穗期标记后、成熟期分别取4盆分析δ 13C、δ 15N值; 取18盆未标记的进行生理指标测定; 6盆计产、考种。连续试验两年。
1.1.2 大田试验 不进行同位素标记处理, 各年度间品种、氮肥运筹等均同盆栽试验。两因素随机区组设计, 3次重复, 小区面积23.6 m2, 采用控制性交替灌溉方式[8], 用水表准确记载每次灌水量, 确保各施肥处理的小区灌水量一致; 小区间筑埂(宽40 cm, 高30 cm)并用塑料薄膜包裹, 以防串水串肥, 其他田间管理按大面积生产田进行。
1.2.1 植株氮含量 于齐穗及成熟期, 选取各处理未进行碳氮标记的3盆水稻, 测定地上部叶、茎鞘和穗等器官的干重, 以浓H2SO4+定氮催化剂消煮, 用FOSS-8400凯氏定氮仪测定氮含量, 并计算氮素积累量、氮素稻谷生产效率、氮素干物质生产效率、氮肥农艺利用率、氮肥回收利用率、氮肥生理利用率[2]。
1.2.2 1, 5-二磷酸核酮糖羧化酶(RuBPCase)和蔗糖磷酸合成酶(SPS) 于齐穗期、齐穗15 d及成熟期的晴天9:00、光照强度1100~1200 mol m-2 s-1条件下, 选取各处理未进行碳氮标记的4盆主茎剑叶, 去叶脉, 剪碎混匀。按照李粹芳和李立人[15]的分光光度法测RuBPCase酶, 以每分钟固定的CO2微摩尔数(µ mol CO2 mg-1 protein min-1)表示酶活力; 参照Wang等[16]和王维等[17]的方法测SPS酶, 以每分钟生成的蔗糖微摩尔数(µ mol mg-1 protein min-1)表示酶活力。
1.2.3 硝酸还原酶(NR)和谷氨酰胺合成酶(GS)
利用1.2.2同时期所取的样品, 按李合生[18]的离体法测NR酶活性, 以每小时产生的NaNO2微克数(µ g mg-1 protein h-1)表示酶活力; 参照Lea等[19]的方法测GS酶活性, 并以每小时生成的γ -谷氨酰基异羟肟酸微摩尔数(µ mol mg-1 protein h-1)表示酶活力。
1.2.4 净光合速率 分别于齐穗期、齐穗15 d及成熟期的晴天9:30— 11:00、光照强度在1200 mol m-2 s-1以上时, 用Li-6400光合仪(美国)测定, 各处理分别选取5盆主茎剑叶, 每叶重复测定3次。
1.2.5 同位素13C和15N 分别于齐穗期13CO2饲喂后当天, 以及成熟期, 分别取各处理碳氮标记的4盆水稻, 分叶、茎鞘、根、穗四部分, 样品经杀青、烘干、恒重后研磨过超细筛, 利用Thermo Fisher Scientific公司(美国)生产的同位素比率质谱仪(DELTA V Advantage)及元素分析仪(Flash EA1112 HT), 样品在元素分析仪中高温燃烧后生成CO2, 质谱仪通过检测CO2的13C/12C, 并与国际标准物(Pee Dee Belnite)比对后计算出样品的δ 13C比率值; 高温燃烧后生成N2, 检测N2的15N/14N, 并与国际标准物(大气N2)比对后计算出样品的δ 15N比率值, 同时测定总碳、总氮含量并计算碳氮比(C/N)。
1.2.6 考种与计产 成熟期盆栽取6盆计产和考种; 大田试验则从各小区随机取10株(每株茎蘖数为各小区的平均茎蘖数), 测定穗粒数、实粒数、千粒重, 计算结实率等性状。各小区按实收株数计产。
用Microsoft Excel和SPSS17.0处理系统分析数据, 2年结果趋势一致, 且年季间产量及碳氮代谢指标间差异未达到显著水平, 因此本文主要以2014年试验结果进行分析; 以SigmaPlot10.0软件作图。
品种、氮肥运筹对产量及其构成因素的影响均达显著或极显著水平, 且两因素互作效应对产量、每穗粒数及总颖花数(有效穗和穗粒数的乘积)的影响均达显著水平。不同品种、氮肥运筹处理下(表3), 产量受氮肥运筹的影响明显高于品种的差异; 产量以氮高效品种N2处理最高, 为本试验氮高效品种配套的氮肥运筹优化模式, 而氮高效品种再随氮肥后移比例的增大(至N3处理), 虽然会造成产量的降低, 但减产程度未达显著水平; 氮低效品种下, 以N2处理产量最高, 增加氮肥的后移量, 会导致产量的显著下降; 表明适当的氮肥后移(达总施氮量的40%), 均能促进不同氮效率品种产量的增加, 再增加氮肥后移量的比例, 应配合选用氮高效品种可缓解产量的显著降低。年度间大田试验的产量结果与盆栽试验结果基本一致(表4)。
由表3和表4还可看出, 有效穗、总颖花数和结实率受氮肥运筹的影响也高于品种差异, 但穗粒数及千粒重则相反, 表明适宜品种、氮肥运筹调控措施可以对产量构成因子进行调节, 最终达到促产的目的。不同品种下, 除千粒重外, 各产量构成因子均值均表现为氮高效显著高于氮低效品种。各氮肥运筹比例处理下, 不同品种各产量构成因子均随氮肥后移量的增加, 表现先增后降的趋势; 氮肥后移量过多均会导致两品种结实率显著下降, 尤其导致氮低效品种有效穗、总颖花数、结实率和千粒重的显著降低。对产量及其构成因素相关分析表明, 产量受总颖花数影响较大, 相关系数为0.940* * ~0.976* * 。
由表5可见, 齐穗和成熟期氮累积量及氮素利用效率平均值均表现为氮高效不同程度高于氮低效品种, 且均随氮肥后移比例的提高整体呈先增后降的趋势, 以氮肥后移比例40%为宜, 在此基础上增加氮肥后移量也会导致两品种氮素累积及利用效率
| 表3 氮肥后移对不同氮效率水稻产量及构成因素的影响(盆栽试验2013-2014年) Table 3 Effects of postponing N topdressing on yield and its components in rice cultivars with different NUE in the pot experiments (2013-2014) |
| 表4 氮肥后移对不同氮效率水稻产量及构成因素的影响(大田试验2013-2014年) Table 4 Effects of postponing N topdressing on yield and its components in rice cultivars with different NUE in the field experiments (2013-2014) |
| 表5 氮肥后移对不同氮效率水稻氮素累积利用效率的影响(盆栽2014年) Table 5 Effects of postponing N topdressing on N accumulation and N use efficiency (NUE) in rice cultivars with different NUE in the pot experiment (2014) |
不同程度的降低, 尤其对于氮低效品种降幅达到显著水平。氮素干物质生产效率在施氮条件下随氮肥后移比例的增加呈增加趋势, 氮素稻谷生产效率则呈不同程度的降低趋势; 表明氮肥后移比例的增加虽有利于氮素的累积和氮素干物质的生产, 但不利于提高氮素的转运及利用, 最终导致氮素利用效率的显著下降。品种、氮肥运筹对水稻吸氮量、氮肥回收利用率、农艺效率及氮肥生理利用效率的影响均达极显著水平, 且两因素对成熟期氮素累积量及氮肥利用效率的影响存在显著或极显著的互作效应。
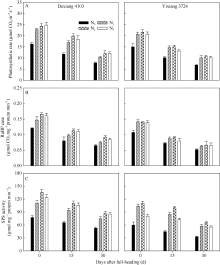
品种、氮肥运筹均显著影响剑叶净光合速率(图1-A)、RuBP羧化酶(图1-B), 以及SPS活性(图1-C); 随生育进程, 不同品种剑叶净光合速率(Pn)及碳代谢酶活性均呈降低趋势, 且氮高效品种各生理指标均不同程度地高于氮低效品种。同一品种下, 随氮肥后移比例的增加, Pn、RuBP羧化酶和SPS活性呈先增加后降低的趋势, 整体以N2处理最高; 但不同氮效率品种对氮肥后移比例响应不太一致: 氮高效品种在氮肥后移比例达40%~60%, 各生理指标均高于氮肥后移20%处理, 且氮高效品种下60%的氮肥后移比例处理在齐穗期、成熟期能维持水稻较高的Pn及碳代谢酶活性; 而氮低效品种以氮肥后移量20%~40%为宜, 氮肥后移量达到60%会导致剑叶Pn及碳代谢酶活性显著下降; 也间接表明结实期氮高效品种对氮肥后移运筹处理响应明显, 其生理代谢活性也较高。
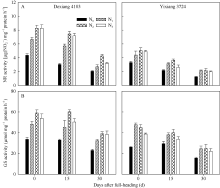
由图2可见, 品种、氮肥运筹对剑叶NR (图2-A)和GS (图2-B)活性也存在显著调控效应, 且品种、氮肥运筹对各氮代谢酶活性的影响变化趋势基本一致, 但叶片中NR活性随着生育进程呈明显降低的趋势, GS活性随生育进程则呈缓慢降低, 随后再显著降低的趋势, 尤其在齐穗后0~15 d降幅缓慢, 随氮肥后移比例的增加剑叶GS活性甚至有所提高。
由表6可见, 从齐穗至成熟期, 不同氮肥处理下, 氮高效品种有利于光合同化物累积, 较氮低效品种高7.78~12.75 mg 13C 株-1; 且利于13C同化物由叶片和茎鞘向籽粒转运, 茎鞘转运量要明显高于叶片; 其中叶片与茎鞘转运分别较氮低效品种高
1.70~2.93 mg 13C 株-1、1.70~2.93 mg 13C 株-1; 穗部氮高效与氮低效品种13C同化物分别增加31.04~ 44.68 mg 13C 株-1(占13C总量的42.04%~46.38%)、24.94~34.26 mg 13C 株-1(占13C总量的36.45%~ 41.36%)。但不同品种不同生育时期各营养器官中13C同化物量差异不太一致: 齐穗期除根系两品种差异不显著外, 氮高效品种叶片、茎鞘及穗中13C同化物量均显著高于氮低效品种, 而成熟期两品种叶片及茎鞘间差异不显著, 但氮高效品种根系及穗中13C同化物量均显著高于氮低效品种, 间接表明氮高效品种花后有利于同化物由“ 源” 至“ 库” 的转运。氮肥运筹对不同氮效率水稻花后各营养器官13C同化物累积与转运的影响均达极显著水平。同一品种下, 随氮肥后移比例的增加, 齐穗期不同营养器官13C同化物量呈先增加后降低的趋势, 均以N2处理下各营养器官同化的总量最高, 表明适度的氮肥后移利于叶片、茎鞘13C同化物量向籽粒的转运, 而氮肥后移比例过多至N3处理水平, 会导致叶片、茎鞘转运量及转运比例下降, 不利于籽粒中13C同化物量的增加。
由表7可见, 除齐穗期两品种根系15N累积量差异不显著外, 品种、氮肥运筹对花后各营养器官15N累积与分配的影响均达极显著水平, 且两因素互作效应对齐穗期穗部、成熟期各营养器官, 以及稻株15N累积总量的影响显著。花后不同氮肥处理下, 氮高效较氮低效品种高15.14~18.78 mg 15N 株-1; 且
 | 图2 氮肥后移对不同氮效率水稻剑叶NR (A)和GS (B)活性的影响(盆栽, 2014年)Fig. 2 Effects of postponing N topdressing on NR (A) and GS (B) activity of leaves in rice cultivars with different NUE in the pot experiments (2014) |
| 表6 氮肥后移对不同氮效率水稻花后各营养器官13C同化物累积与转运的影响(mg 13C 株-1) (盆栽, 2014年) Table 6 Effects of postponing N topdressing on post-anthesis accumulation and translocation of 13C in rice cultivars with different NUE (mg 13C plant-1) in the pot experiment (2014) |
| 表7 氮肥后移对不同氮效率水稻花后各营养器官15N累积与分配的影响(mg 15N 株-1) (盆栽, 2014年) Table 7 Effects of postponing N topdressing on post-anthesis accumulation and distribution of 15N in rice cultivars with different NUE (mg 15N plant-1) in the pot experiment (2014) |
叶片与茎鞘转运分别较氮低效品种高2.21~4.55 mg 15N 株-1、0.05~1.14 mg 15N 株-1; 穗部氮高效与氮低效品种15N分别增加35.56~46.58 mg 15N 株-1(占15N总量的61.82%~82.93%)、27.37~31.57 mg 15N 株-1 (占15N总量的58.04%~68.31%)。两品种各营养器官及各生育时期15N的累积总量表现, 与13C同化物累积与转运的影响基本一致, 均表现为氮高效高于氮低效品种, 但不同的是叶片15N转运量要明显高于茎鞘。同一品种下, 齐穗期随氮肥后移比例的增大, 除根系外, 两品种植株15N累积总量、叶、茎鞘及穗部均呈不同程度的降低趋势, N1和N2处理间差异不显著, 且均显著高于N3处理; 而至成熟期N2处理植株15N累积总量超过N1处理, 但尚未达显著水平; 也间接表明N2处理利于结实期对氮素的吸收。氮肥后移比例过大至N3处理水平, 虽在结实期相对于N1处理利于氮素的累积, 但从15N累积总量来看, 仍显著低于N1和N2处理。
由表8可见, 两品种仅在齐穗期叶片和茎鞘的碳氮比(C/N)差异显著, 且氮肥运筹对C/N的调控效应显著高于品种差异。同一品种施氮条件下, 齐穗期随氮肥后移比例的增加, 各营养器官C/N均呈不同程度的增加趋势。成熟期氮高效品种各营养器官C/N, 则均随氮肥后移比例的增加呈不同程度的降低趋势, 而氮低效品种茎鞘及根系随着氮肥后移比例的增加变化规律不太一致, 60%氮肥后移比例反而使C/N增加。从花后不同器官C/N的变化来看, 齐穗至成熟期施氮处理下, 两品种叶片及穗部C/N均值呈显著增加的趋势, 茎鞘和根系C/N均值呈不同程度降低的趋势; 结合最终产量来看, 两品种高产N2处理下, 齐穗至成熟期叶片、穗部C/N提高幅度, 与该时期茎鞘、根系C/N降低幅度一致, 为花后各营养器官最适的C/N变化值, 可以此作为高产的鉴定指标。
碳、氮代谢是植物体内最基本的两大代谢过程, 分别与碳水化合物和蛋白质的合成有关, 且光合碳、氮同化间存在着代谢和能量的竞争关系[20]。如何调节两者间的关系, 这对水稻碳氮代谢平衡, 提高产量及氮肥利用率有着十分重要的意义。本庄一雄等[21]研究表明, 增施氮肥可使叶绿素含量以及GS、SPS和磷酸烯醇式丙酮酸羧化酶(PEPC)活性保持较高水平, 利于增强后期净光合能力, 促进光合产物的形成、籽粒淀粉和蛋白质的积累等, 使产量和蛋白质含量协同提高。王永锐等[22]指出, 氮钾肥可促进剑叶光合速率、SPS、NR活性提高, 降低呼吸速率, 加速碳同化物从剑叶的输出, 提高碳同化物在穗部的累积。本研究表明, 不同氮效率品种对
| 表8 氮肥后移对不同氮效率水稻花后各营养器官总碳氮比的影响(盆栽2014年) Table 8 Effects of postponing N topdressing on post-anthesis total carbon nitrogen ratio of different organs in rice cultivars with different NUE in the pot experiment (2014) |
氮肥利用效率、花后穗部碳同化物累积的影响明显高于氮肥运筹的调控效应; 而氮肥运筹对齐穗和成熟期氮累积量、C/N、稻谷生产效率、氮素干物质生产效率, 以及产量的调控作用显著; 适宜的氮肥后移比例, 能协调碳氮代谢关键酶活性(图1和图2), 促进花后碳同化物和氮素的协同转运(表6和表7), 可实现水稻产量和氮肥利用率的同步提高, 且能进一步发挥氮高效水稻品种的优势(表3~表5), 进一步证实、完善和补充了前人及我们前期的研究结果[2, 21, 22]。同时, 本研究还表明, 氮肥后移量达到60% (N3处理), 相对于氮低效品种, 虽不会导致氮高效品种产量显著下降, 但也会造成花后剑叶碳氮代谢关键酶活性下降, 氮累积量显著降低, 叶片及茎鞘中碳同化物滞留量增加, 穗部碳同化物显著减少, 导致氮肥农学及生理利用率显著降低; 这可能与氮循环消耗生物体内无机氮代谢同化力, 同时利用CO2同化产物作为氨基受体形成有机的C-N化合物有关[23], 使碳氮代谢失调。林晶晶等[9]通过设置不同的氮肥量及氮肥运筹研究表明, 基蘖肥用量越大, 其损失也越大, 总体氮肥利用率也越低; 本研究进一步表明, 氮肥后移比例越大, 虽从氮累积量上看氮素损失量减少, 但氮素、光合碳的累积及协同转运量低, 也会导致总体氮肥利用效率显著降低, 进一步完善了前人[9]的研究结论。此外, 本研究还发现, 随着
15N标记氮肥比例的后移, 至齐穗期品种、氮肥处理间15N累积量差异显著, 这与叶利庭等[13]研究的不同品种下, 基肥与齐穗期前期分两次施用15N标记的氮肥, 至齐穗期不同处理间水稻对15N总量的吸收在一个水平、差异不显著, 结果不太一致[13]。本研究齐穗期稻株不同器官15N的累积量随氮肥后移量的增加而减少(表7), 尤其至N3处理显著降低; 而齐穗至成熟期, 虽然N3相对N1处理能进一步提高对15N的吸收, 表明氮肥后移能促进水稻花后对氮素的吸收, 但成熟期对15N吸收总量上N3处理仍显著低于N1处理(表7), 而N1和N3处理间氮素总累积量却差异不显著(表5)。此结果可能表明, N3处理40%基肥氮与60%的氮肥追施间存在脱氮现象, 追肥前水稻过多地吸收了土壤的氮素, 而后追施的15N氮肥, 可能导致了土壤与根系对氮素的竞争, 由于本研究只注重了对植株整体的研究, 究竟如何导致成熟期N1和N3处理间氮素总累积量差异不显著, 而对15N吸收总量存在显著差异, 有待于对土壤-植株作为一个整体进一步探究。
水稻品种自身的优势也是发挥水稻高产高效作用的另一途径, 对于不同源库类型水稻光合同化物及氮素的转运与分配报道较多。杨建昌等[24]研究表明, 库源比越大, 叶片光合产物及氮素输向穗粒中的越多; 严建民等[11]利用14C、32P示踪研究表明, 亚种间重穗型杂交稻光合产物的运转受SPS和根系活力的影响较大; 且重穗型杂交稻穗中14C-同化物的量约占整株的85%~95%, 茎为3%~10%, 叶片为2%~5%; 而对于不同氮效率水稻光合同化物及氮素转运、分配的研究, 多集中于氮素的转运及分配方面, 大多认为, 氮高效基因型能在抽穗后积累更多的氮素并且向籽粒的转运量高; 叶利庭等[13]通过15N标记精确定量不同氮效率水稻齐穗后氮素积累和转运量, 表明氮高效水稻从茎叶转移出的15N量约占籽粒所需氮量的85%以上。本研究表明, 花后不同氮肥运筹下, 氮高效品种氮素的累积与转运明显高于氮低效品种, 氮高效品种花后穗部N增加35.56~46.58 mg 15N 株-1, 由叶片及茎鞘转运量(根系不明显)占15N总量的61.82%~82.93%, 而氮低效品种穗部N增加显著降低, 为27.37~31.57 mg 15N 株-1, 其由叶片及茎鞘的转运量占15N总量的58.04%~ 68.31%, 这进一步证实了前人的结果[15, 25, 26]。但不同氮效率水稻品种花后光合同化物精确定量转运、分配是否与氮转运存在差异及协同性, 却鲜见报道。本研究表明, 花后不同氮肥运筹下, 氮高效品种光合同化物、氮素的累积与转运明显高于氮低效品种, 氮高效品种花后穗部13C同化物增加31.04~ 44.68 mg 13C 株-1, 由叶片及茎鞘的转运量(根系不明显)占13C总量的42.04%~46.38%, 氮低效品种花后穗部13C同化物则只增加24.94~34.26 mg 13C 株-1, 占13C总量的36.45%~41.36%, 由此也进一步表明氮高效品种花后具有强光合碳同化和氮素的协同吸收转运特征, 以及碳氮代谢能力, 以满足籽粒灌浆期对光合同化物及氮素的利用, 是氮高效品种相对于氮低效品种高产、氮高效利用的重要依据与原因。因此应进一步加强氮高效、高产水稻品种的筛选, 提出鉴定氮高效、高产品种的指标并集成高产氮高效水稻配套栽培技术体系。
选择能评价氮肥利用率及产量的指标对作物氮利用效率的评价和高产、氮高效品种的筛选具有重要意义[27]。胡健等[28]认为结实期水稻叶片内肽酶(EP)活性可以作为水稻灌浆特征以及产量和品质的指标。曾建敏等[12]研究表明, GS活性和可溶性蛋白含量对评价水稻氮肥利用率有重要的参考价值。我们前期研究结果[29]也表明, 功能叶GS活性可作为准确判断水稻各生育期氮素积累量的指标, 并可将抽穗期剑叶中NR、GS及谷氨酸合酶(GOGAT)活性作为综合评价水稻产量及氮效率同步提高的指标。从本研究来看, 不同品种、氮肥运筹下, 水稻花后各生育阶段剑叶光合速率, 以及RuBPCase、GS等碳氮代谢关键酶活性均能准确评价水稻氮素累积量、氮肥利用效率, 以及产量水平, 这进一步证实了前人及我们前期的研究结果[12, 27, 28, 29]; 同时, 本研究还表明, 13C标记花后形成的光合碳同化物的累积、转运与剑叶光合速率, 以及碳氮代谢关键酶活性均存在显著的一致性与协同性, 进一步阐明了碳氮代谢能简洁明确地反映水稻产量、氮效率, 以及光合同化物累积与转运的情况, 探明氮高效品种具备高碳代谢的能力, 碳代谢关键酶活性也可作为筛选和鉴别氮高效水稻基因型的生理生化指标。此外, Weigelt等[30]研究表明, 作物正常生长不需要很高的氮、碳含量, 而在C/N达到某种平衡的状况下就能完成。但关于不同氮肥运筹下, 不同氮效率水稻光合碳同化、物质积累与根系氮吸收动态的平衡关系、C/N计量比的研究却少见。本研究发现, 高产条件下, 齐穗至成熟期叶片、穗部C/N提高幅度, 与该时期茎鞘、根系C/N降低幅度一致, 因此可将水稻花后各营养器官C/N变化值, 作为水稻高产、氮高效利用同步提高的评价指标, 也可以进一步优化调控齐穗至成熟期氮高效品种水稻各营养器官的C/N, 作为实现高产与氮高效利用协调统一的另一重要途径, 这较通过测定特定生育期的某一种碳、氮代谢酶活性来判断水稻产量及氮效率更为准确。
不同氮效率品种、氮肥运筹对花后氮素利用特征、光合同化物分配、生理特性及产量均存在显著影响。本试验条件下, 氮高效品种以氮肥后移量占总施氮量的40%、氮素穗肥运筹以倒四、倒二叶龄期追施相配套, 能促进花后氮素的累积, 提高剑叶碳氮代谢关键酶活性, 促进叶片、茎鞘、根系、穗各营养器官光合同化物及氮素累积与转运, 是实现产量和氮素利用效率同步提高的主要调控途径。氮高效品种花后具有强光合碳同化、氮素吸收转运特征, 以及碳氮代谢能力, 可满足籽粒灌浆期对光合同化物及氮素的利用, 是氮高效品种相对于氮低效品种高产、氮高效利用的重要原因。齐穗至成熟期叶片、穗部C/N提高幅度, 与茎鞘、根系C/N降低幅度一致, 据此C/N可作为水稻高产及氮肥高效利用同步提高的评价指标, 可作为实现高产与氮高效利用协调统一的另一重要途径。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|