第一作者联系方式: E-mail:huwran@126.com, Tel: 0991-4529217
分子量是聚合物的重要特性之一, 木质素的分子量及其分布是研究苯丙烷类结构的反应、物理化学特性和评价其改性产物质量的内容之一。本研究以陆地棉TM-1成熟纤维为材料, 分别利用酶解-温和酸解木质素法和二氧六环法提取棉纤维中木质素, 结合凝胶渗透色谱法(gel permeation chromatography, GPC)调查和评价2种方法获得的棉纤维中木质素的相对分子量。结果表明, 经二氧六环处理提取的棉花纤维中的木质素(dioxane lignin, DL)的重均分子量为2924 g mol-1、数均分子量2403 g mol-1, 略高于由酶解-温和酸解处理提取的木质素(enzymatic hydrolysis-mild acidolysis lignin, EMAL)的重均分子量(2169 g mol-1)和数均分子量(1970 g mol-1), EMAL的多分散系数稍低, 说明木质素的均一性比DL高。表明EMAL法提取的木质素更适用于分析棉纤维中木质素的相对分子量。利用EMAL法分析棉纤维中木质素相对分子量表明, 不同棉花品种的木质素重均分子量分布范围为938~2169 g mol-1, 数均分子量分布范围为857~1970 g mol-1, 多分散性系数在1.09~1.74间, 均小于2。重均分子量与纤维马克隆值呈显著负相关, 数均分子量与纤维长度呈显著负相关, 与纤维马克隆值呈极显著负相关。
Molecular weight is one of the important characteristics of polymers, lignin molecular weight and its distribution is one of the contents for studying responses of phenylpropanoid structure, physicochemical characteristics and evaluation of the modified product quality. In this research, the relative molecular weight of lignin extracted respectively by enzyme hydrolysis mild acidolysis and dioxane from mature cotton fibers ( Gossypium hirsutum L. acc. TM-1) was studied combined with gel permeation chromatography (GPC). The dioxane lignin (DL) had an average molecular weight (Mw) of 2924 g mol-1, and a number-average molecular weight (Mn) of 2403 g mol-1, which were slightly higher than the enzymatic hydrolysis-mild acidolysis lignin (EMAL, Mw was 2169 g mol-1 and Mn was 1970 g mol-1). The polydispersity coefficient of EMAL was slightly lower than that of DL, showing the higher uniformity in EMAL than in DL. The method of EMAL was more suitable to analyze the relative molecular weight of lignin in cotton fiber. The relative molecular weights of lignin in different cotton varieties, extracted by EMAL, were analyzed, showing that the Mw distribution range of lignin was 938-2169 g mol-1, while Mn was 857-1970 g mol-1 and the polydispersity coefficient was 1.09-1.74 (less than 2). The weight average molecular weight had significantly negative correlation with the micronaire value ( P<0.05). The number average molecular weight was negatively correlated with fiber length ( P<0.05), and the micronaire value ( P<0.01), respectively.
近年来的研究表明棉花纤维发育中存在着苯丙烷代谢, 并且是仅次于纤维素代谢的第二大代谢途径, 苯丙烷代谢和棉花纤维细胞壁发育密切相关, 其代谢产物苯丙烷类化合物和棉花纤维品质密切相关[1, 2, 3, 4]。形成植物细胞壁交联结构的苯丙烷类化合物可分为通过氧化连接形成木质素的单体木质素, 以及与细胞壁上不同化合物交联的低分子羟基肉桂酸[5, 6]。在细胞壁的形成过程中, 苯丙烷类化合物在细胞壁内和细胞壁间逐渐沉积, 把细胞和细胞粘结起来, 苯丙烷类化合物填充于纤维素骨架内, 起到交联作用, 加大了植物细胞壁的韧性, 增加了细胞的机械支持力和抗压强度[7]。
分子量是聚合物的重要特征性质之一, 高分子聚合物的分子量是其强度和其他物理性能的良好标志[8]。木质素的分子量及其分布是研究苯丙烷类结构的反应、物理化学特性和评价其改性产物质量的内容之一[9, 10, 11], 更为重要的是, 木质素的许多性能, 不但与其分子量有着密切的关系, 而且还受分子量分布的影响, 木质素的分子量影响着生物量的抗降解性和苯丙烷类化合物的稳定[12]。研究木质素分子量及其分布便于理解木质素反应和物理化学性质的特性原理[10, 11, 13]。同时木质素的分子量可用来描述在分离提取生物原材料木质素的过程中木质素的降解程度[14]。
研究表明棉花纤维中存在着苯丙烷类化合物[1, 3, 15], 主要是由愈疮木基结构单体(G-木质素)和紫丁香基结构单体(S-木质素)聚合而成[16, 17], 然而对棉纤维这种高纤维素含量的特殊材料中木质素的分子量分布及其与纤维品质间的关系还未见报道。本研究以陆地棉自然成熟纤维为材料, 选出适合分析棉纤维木质素相对分子量的方法, 并利用该方法分析研究不同品种棉纤维中木质素的相对分子量, 结合品质主要恒定指标进行相关分析, 为进一步研究棉纤维中苯丙烷类化合物的性质提供理论依据。
将TM-1和新陆早39种植于新疆玛纳斯县试验站, 新陆中60和中棉35种植于新疆库车试验站, 采摘自然成熟棉铃, 使用小型轧花机脱籽后留取纤维备用。
匀质缓冲液(50 mmol L-1 Tris-HCl, 10 g L-1 Triton X-100, 1 mol L-1 NaCl, pH 8.3); 0.2 mol L-1醋酸-醋酸钠缓冲液(pH 4.8); 丙酮、纤维素酶、1, 4-二氧六环、吡啶、乙酸酐、甲醇、浓HCl、NaHCO3、Tris-HCl、NaCl和Triton X-100, 均为分析纯; 试验用水均为蒸馏水。
电热恒温水槽(上海一恒科技有限公司, DKZ系列); 旋转蒸发仪(日本东京理化, EYELA N-1100); 气相色谱仪(ThermoFinnigan Trace 2000, 美国); 磁力搅拌器(WH220 plus, 德国); 高速冷冻离心机(Hitachi, CR20B2); 冷冻干燥机(北京松源华兴, LGJ-12); 烘箱(EYELA, NDO-700)。
不同品种的棉花纤维经彻底去除非纤维杂质, 用匀质缓冲液清洗2次, 80%丙酮清洗2次, 纯丙酮清洗1次[18], 每次都用金属夹蒜器将溶液挤干, 清除棉花纤维的可溶物质, 留下结构物质, 于干净滤纸上晾干, 45℃恒温干燥箱烘干至恒重备用。
1.4.1 酶解温和酸解处理棉纤维 参照文献[19-20]方法, 略有改动。①称取6份5.0 g的TM-1棉纤维分别置6个100 mL锥形瓶中, 各加0.2 mol L-1醋酸缓冲液100 mL、纤维素酶325 mg, 玻璃棒搅拌, 将棉纤维彻底浸润混匀; ②将锥形瓶封口后放入电热恒温振荡水槽, 50℃条件下轻缓振荡60 h, 反应完成后, 利用2 mol L-1 HCl调节反应液pH至2.0; ③室温下过滤, 收集棉纤维, 用稀HCl (pH 2.0)清洗2~3次, 再用蒸馏水清洗2~3次; ④混合棉纤维, 利用冷冻干燥机冻干后置1 L烧瓶中, 加入300 mL 85∶ 15 (v/v)二氧六环/水溶液和1.25 μ L浓HCl, 充分混匀后于电热恒温水槽中86℃条件下加热回流2 h; ⑤待反应完成后, 取出烧瓶, 室温下冷却后过滤, 收集滤液; 用二氧六环/水溶液清洗残渣3次, 收集合并滤液后用NaHCO3调节pH至中性; ⑥利用旋转蒸发仪40℃下将滤液浓缩, 冷冻干燥后备用。
1.4.2 二氧六环处理棉纤维 参照蒋挺大[21]方法, 略有改动。①取30 g清洗后的TM-1棉纤维样品, 置烧瓶中, 加入500 mL的85∶ 15 (v/v)二氧六环/水溶液和8.75 mL 浓HCl, 充分混匀后于电热恒温水槽中95℃条件下加热回流16 h; ②反应完成后取出烧瓶, 冷却至室温后过滤, 收集滤液, 纤维残渣经85∶ 15二氧六环/水溶液清洗2~3次, 将所有滤液合并, 用NaHCO3调节pH值至中性; ③利用旋转蒸发仪40℃下将滤液浓缩至15~20 mL, 加入10倍体积的冷水, 利用磁力搅拌器搅拌均匀; ④ 4℃条件下, 16 400× g离心5 min, 收集沉淀; ⑤提纯木质素[22], 干燥后备用。
1.4.3 乙酰化处理 将提取的木质素置具塞小试管内, 加入1 mL吡啶溶解, 再加入1 mL乙酸酐, 封口后以磁力搅拌器搅拌72 h, 加入5 mL甲醇∶ 水(1∶ 1, v/v), 于4℃冰箱过夜处理后, 16 400× g, 4℃下离心5 min, 收集沉淀, 干燥后备用。
准确称取2 mg乙酰化后的木质素样品溶于1 mL的四氢呋喃溶液中, 待样品全部溶解后, 利用Waters1525凝胶渗透色谱仪(GPC)测定。
采用仪器的Agilent PLgel 5 μ m MIXED-C色谱柱(300.0 mm × 7.5 mm); Waters 2414检测器; 流动相为THF (四氢呋喃); 柱温35℃, 进样量60~80 μ L, 流速1 mL min-1, 聚苯乙烯标样作为标准品。采用GPC Software处理数据。
选出合适的分析棉纤维木质素分子量的方法, 分别提取新陆早39、新陆中60和中棉35自然成熟纤维的木质素, 再采用GPC分别测定其相对分子量。
将测得的棉纤维木质素相对分子量, 即重均分子量(X1)、数均分子量(X2)及多分散性系数(X3), 结合纤维品质主要恒定指标纤维长度(X4)、强度(X5)及马克隆值(X6), 经数据标准化后用Microsoft Excel 2003进行相关分析。
从图1可以看到2种处理得到的木质素色谱图检测器响应曲线类似, 二氧六环处理得到的TM-1棉纤维木质素的色谱图相应值稍高于酶解温和酸解木质素。从表1可以看到, 二氧六环处理棉花纤维提取的木质素重均分子量为2924 g mol-1, 酶解温和酸解处理提取的木质素重均分子量为2169 g mol-1, 二氧六环木质素分子量的分散性系数稍高于酶解温和酸解木质素, 说明酶解温和酸解木质素分子量分布较窄, 相对分子质量分布比较均匀, 性能相对稳定, 而二氧六环处理棉花纤维从中提取的木质素结构较为复杂一些。推测直接采用酶解温和酸解提取得到木质素更接近棉纤维中真实的木质素类型。因此, 酶解温和酸解提取得到木质素更适合于分析棉纤维苯丙烷类化合物的分子量。
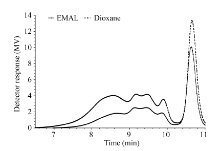 | 图1 二氧六环处理与酶解温和酸解处理得到的TM-1棉纤维木质素的色谱图Fig. 1 Chromatogram of lignin from TM-1 cotton fiber treated by dioxane and enzyme hydrolysis mild acidolysis |
| 表1 二氧六环处理与酶解温和酸解处理得到的TM-1棉纤维木质素的分子量及分布 Table 1 Molecular weight and distribution of lignin from cotton fiber treated by dioxane and enzyme hydrolysis mild acidolysis |
从图2可以看到不同品种棉纤维中木质素色谱图检测器响应曲线稍有不同。由表2可知, 4个品种棉花纤维中木质素样品重均分子量分布范围为938~2169 g mol-1, 数均分子量分布范围为857~1970 g mol-1, 多分散性系数(Mw/Mn)在1.10~1.74之间。
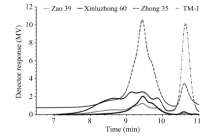 | 图2 不同品种棉纤维EMAL色谱图Fig. 2 Chromatogram of lignin from different cotton fibers treated by enzyme hydrolysis mild acidolysis |
| 表2 不同品种棉纤维EMAL木质素分子量及分布 Table 2 Molecular weight and distributing of EMAL from fibers of different cotton varieties |
表3表明, 酶解温和酸解得到的木质素的重均分子量与纤维马克隆值呈显著负相关, 数均分子量与纤维长度呈显著负相关, 与纤维马克隆值呈极显著负相关。
| 表3 不同品种棉纤维EMAL分子量与纤维品质指标间的相关性 Table 3 Correlation coefficient between molecular weight of EMAL and the fiber quality indexes from different cotton varieties |
存在于植物细胞壁中未经分离的木质素为原本木质素, 其相对分子量可以达到几十万到几百万, 不溶于任何试剂。但植物细胞壁致密的物理束缚和木质素与细胞壁多糖组分之间各种化学键的联接使木质素组分很难以化学结构完整的形式从细胞壁中分离出来[23], 所以给其分子量的研究也带来了困难。鉴于天然高分子木质素结构的复杂性和分布的不均一性, 研究者将木质素通过一定的方法解聚, 转化为低分子物质是对其最有效的应用途径。分离的木质素因为发生了缩合或降解, 相对分子量要低很多, 由于木质素的分离提取方法的不同, 其相对分子量一般是几千到数万[13]。影响木质素分子量分布的因素较多, 木质素的来源和分离方法决定其相对分子量的大小。
木质素是天然的高分子聚合物, 其分子量呈现多分散性, 即分子量有一定范围。常用统计的方法求出试样分子量的平均值和分子量分布。一般测定重均分子量(Mw)和数均分子量(Mn), 以重均分子量和数均分子量的比值D (D = Mw/Mn)即多分散系数表示多分散性。D一般用来表征分子量的分散程度, 高分子试样的分子量分布愈宽, D值愈大[24]。重均分子量和分子量分散系数都可能影响木质素的热性能, 一般重均分子量和分子量分散系数越大, 其玻璃化温度越高[25]。
近年来, 对生物原材料中木质素的分离提取方法, 在原有的基础上其过程逐渐趋于多级化, 以期在尽可能保证结构破坏程度较小的前提下分离提取出生物原材料中的木质素。原本木质素的分子量分布较宽, 然而, 木质素结构与分离提取木质素的方法有关, 致使木质素分子量的大小因分离提取方法不同而受到一定程度的影响。生物质原材料不同, 木质素的分子量不同; 同一种生物原材料因不同的分离方法所得的木质素分子量也有所差异。同时, 在分离提取的过程中, 木质素片段的降解、缩合以及变性等, 也是影响分子量大小的原因之一[21]。
磨木木质素(milled wood lignin, MWL)的化学结构变化较小, 是分析植物细胞壁中木质素特性的常用方法之一[26, 27]。二氧六环木质素(DL)也可用于结构研究[21]。Wu等[20]和Guerra等[28]研究发现EMAL分离方法在提取过程中只是断裂了木质素-碳水化合物间的化学联接键, 木质素大分子内的各连接键并没有断裂, 为木质素的高效分离提供了保证。武书斌等[29]在麦草分析上也发现该方法提取得到的木质素得率和纯度都高于磨木木质素, 不会造成木质素大分子化学结构的变化。棉花纤维纤细、柔软, 不适合球磨。棉纤维中纤维素含量高达90%。本研究结果显示棉纤维经二氧六环直接提取的木质素的重均分子量和数均分子量略高于酶解温和酸解法所得。该结果与韩敏[13]采用二氧六环处理慈竹提取的木质素分子量范围一致; 但二氧六环直接提取的木质素分子量的分散系数稍高于EMAL法得到的木质素, 说明EMAL法提取的木质素分子量分布较窄, 木质素结构均一, 更适用于分析棉纤维中的苯丙烷类化合物分子量。利用EMAL法提取不同品种棉纤维中的木质素, GPC测试结果表明不同棉花品种的木质素重均分子量分布范围为938~2169 g mol-1, 多分散性系数均小于2。再次说明EMAL法提取得到的棉纤维木质素适合于评价棉纤维中的木质素的相对分子量。相关分析结果表明, 该方法提取得到的木质素的分子量与纤维品质主要恒定指标有关, 其中重均分子量与纤维马克隆值呈显著负相关, 数均分子量与纤维长度呈显著负相关, 与纤维马克隆值呈极显著负相关。该结果验证了棉纤维中的苯丙烷类化合物与纤维品质的负相关性[1, 3]。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|


