第一作者联系方式: E-mail: xiaoyonggui@caas.cn
双链DNA (dsDNA)定量分析是植物分子生物学研究的基础, 对基因型分析尤为重要。本研究以λ噬菌体dsDNA为标准样品, 建立了荧光定量标准曲线, 探讨荧光核酸定量通量性及其与紫外法定量的差异, 并分析荧光染料在基因分型中的应用。结果表明, 荧光染料能够对dsDNA进行高效微量定量分析(<1.1 ng μL-1), 但因鉴定核酸的浓度较低, 对小麦籽粒和叶片全基因组DNA定量时稀释倍数较大, 易增大浓度误差。降低反应体系量导致标准曲线决定系数降低, 影响测量准确性。精确定量dsDNA浓度时, 总反应体系应大于200 μL; 对PCR产物进行基因分型时, 总反应体系应不低于40 μL。相同DNA模板浓度下, FLUOstar平台可以对抗秆锈病基因显性标记 csSr32#1 ( Sr32)和 IB-267 ( Sr50)的PCR产物进行基因型分型, 判断准确率为100%。对特异性强且等位基因片段差异大(≥100 bp)的共显性标记, 如抗叶锈病基因标记 We173 ( Yr26)等, 用荧光染料同样可以进行基因分型。与琼脂糖凝胶电泳相比, 荧光染料鉴定等位基因价格略高, 但方法简单、准确快速、重现性好, 可用于分子育种中世代材料快速筛选。
Quantitative analysis on double-stranded DNA (dsDNA) lays a foundation in molecular biology research in plants, particularly important for genotyping in molecular breeding. The objective of this study was to establish standard curve for fluorescence quantitative analysis by lambda DNA, to compare the difference between dsDNA value in fluorescence system and ultraviolet spectrophotometry, and to identify the allelic variations of rust resistance genes in wheat. The fluorescent dye could be efficiently performed in the quantitative analysis with micro dsDNA concentration (< 1.1 ng μL-1). However, the fluorescent dye could lead to uncertainty of original concentrations of wheat leaf and grain genome DNA, due to more fold serial dilutions for higher DNA concentration. A downward tendency was happened in fluorescent intensity when fluorescent reaction volume was tapered, which influenced the accuracy of DNA concentration. The volume of reaction system mixed nucleic acid and fluorescent dye should be more than 200 μL for accurate determination of micro dsDNA. For genotyping on PCR products, the volume of fluorescent reaction system should be more than 40 μL. FLUOstar could be used for identifying the dominant marker, for instance csSr32#1 ( Sr32) and IB-267 ( Sr50), its accuracy was 100% in correspondence with that from agarose gel electrophoresis. Co-dominant marker with the characteristic of peculiarity and major difference in amplified fragment length ( ≥100 bp), such as We173( Yr26), could also be identified by fluorescent analysis. Compared with agarose gel electrophoresis method, fluorescent method have a simple, convenient, and rapid oparetion with high repeatability, and can be used for segregating generations in marker-assisted breeding.
核酸定量相关技术在生物遗传学研究中应用比较广泛, 如微量DNA残留检测、深度测序技术、量化PCR产物和转基因产物等[1, 2]。随着分子生物学技术的快速发展, 核酸定量相关技术也得到相应发展, 常用定量方法包括放射免疫法、紫外分光光度计、荧光染料法和生物质谱法等。因放射免疫法涉及同位素, 生物质谱易受其他杂质干扰, 使用较少[3, 4]。紫外分光光度法虽然是实验室常用的DNA定量方法, 操作简单, 对设备要求低, 但灵敏度低, 只能测定总核酸浓度高于2 ng μ L-1的样品, 且测定过程中无法区分单(ssDNA)、双链DNA (dsDNA)及其他核酸类型, 容易导致吸收峰偏差, 准确度较低。随着研究需求和仪器的发展, 核酸定量的精确度也得到提高, 经济高效的荧光定量方法逐渐得到广泛应用[1, 5, 6]。
核酸荧光染料是一种能够与特异核酸分子结合发光的染料, 属于内嵌染料, 信号强度与结合的核酸分子数成正比[7]。DNA荧光染料具有通用性好、灵敏度高、所需样品量少、重复性高等优点, 广泛用于定量基因表达和基因突变等[8]。常用的DNA染料包括溴化乙锭、PicoGreen、Hoechst 33258、QuantiFluor等[3]。溴化乙锭与DNA和RNA均具有较强的结合性, 但无法区分单一类型核酸, 并具有较强毒性, 最低检测核酸量为0.1 ng μ L-1。Hoechst 33258与dsDNA的A-T碱基对具有较强的特异性, 最低检测核酸量为 10 ng mL-1 [9]。PrcoGreen和QuantiFluor均对dsDNA具有特异性[7, 10, 11], 前者最低检测250 pg mL-1, 精度高, 但试剂价格较高; 后者最低检测量为0.01 ng μ L-1, 价格相对较低。
分子标记在小麦辅助选择育种中已开始发挥作用, 国内已育成中麦998、中麦1062、济麦23等的品种。具体做法是, 在合理选配亲本的基础上, 对分离世代的单株进行农艺性状选择, 并采用与目标基因紧密连锁的标记或基因特异性标记, 结合PCR和凝胶电泳技术筛选入选单株的优异等位变异, 以提高选择的准确性。入选单株在进行基因型检测过程中, 因受DNA提取、PCR和凝胶电泳耗时、费工的技术限制, 通常辅助选择基因数目较少。就分子标记辅助选择而言, 任何提高目标基因鉴定的技术, 均利于提高分子标记检测速度, 加快育种进程。本研究拟分析FLUOstar平台下dsDNA定量在分子育种中的应用价值, 并根据荧光定量原理, 探索荧光染料在基因分型中的可行性, 为提高分子标记检测效率提供理论依据。
国际玉米小麦改良中心(CIMMYT)正开展聚合主要病害的抗病基因的分子育种项目, 拟通过多个抗病基因型亲本杂交, 将抗条锈、秆锈、叶锈、赤霉病的主效/微效基因聚合到优异高产品种中, 以提高育种材料的持久抗病性和兼抗性。本研究以该项目分子聚合材料中的2个F2群体(Sr32/Baj#1, 44个株系; Reedling#1/Sr50, 66个株系)和1个BC1F3群体(Avocet/Yr26//Avocet, 59个株系)作为基因型分析试材, 用于分子标记检测。以硬粒小麦Alar 84和普通小麦Berkut的籽粒DNA为材料, 分析籽粒DNA与叶片DNA定量差异。
2015年6月, 将上述3个群体种植于CIMMYT总部的El Batan (19.52° N, 98.85° E, 海拔2275 m), 采用单株点播, 株距10~15 cm。拔节期剪取每个单株1~2 g叶片, 置2 mL离心管中, 采用CTAB法提取全基因组DNA (http://www.diversityarrays.com/), 检测并稀释DNA浓度至20 ng μ L-1, 用于PCR。
Sr32源于拟斯卑尔脱山羊草(Aegilops speltoides), 是秆锈生理小种Ug99的有效抗病基因, 其与普通小麦杂交创制的2D-2S#1易位系, 同样具有良好的抗秆锈性, 该基因标记csSr32#1 (F: 5′ -GGT TTGGTGGCAACTCAGGT-3′ ; R: 5′ -CATAAGCCAA AGAGGCACCA-3′ )为显性标记[12]。Sr50来自普通小麦与帝国黑麦(Imperial Rye)杂交创制的1BL/1RS或1DL/1RS易位系, 定位在1RS染色体上, 目前对Ug99仍具有良好的抗性, 该基因标记IB-267 (F: 5′ -GCAAGTAAGCAGCTTGATTTAGC-3′ ; R: 5′ -AA TGGATGTCCCGGTGAGTGG-3′ )为显性标记[13]。Yr26在墨西哥是一个有效的抗条锈病基因, 位于1BL染色体长臂, 该基因标记We173 (F: 5′ -GGG ACAAGGGGAGTTGAAGC-3′ ; R: 5′ -GAGAGTTCC AAGCAGAACAC-3′ )为共显性标记[14]。
PCR体系10 µ L, 包括1× Green GoTaq Flexi buffer (Promega, 美国, #M891A)、1.5 mmol L-1 MgCl2、0.2 mmol L-1 dNTPs、每条引物0.2 µ mol L-1、0.5 U Taq DNA聚合酶、模板DNA 80 ng。反应程序为94℃预变性5 min; 94℃变性1 min, 55℃退火1 min, 72℃延伸1 min, 36个循环; 72℃延伸8 min。用2%琼脂糖凝胶电泳检测PCR产物。40 μ L荧光反应体系用于基因分型, 即PCR体系4 μ L、1× TE (pH 7.5) 16 μ L和1× QuantiFluor荧光溶液20 μ L。
采用FLUOstar Omega全自动多功能酶标仪(BMG LABTECH, 德国)进行荧光测定, 测定温度控制在18~25℃, 扫描dsDNA样品的激发波长为485 nm, 发射波长为510 nm。测定时, 增益调节的目标值(Target value)为90%, 原始增益值(Raw result)为自动获取。对每个样品扫描一次, 进行dsDNA定量和标记检测分析。使用QuantiFluor dsDNA反应系统(Promega, Madison, WI, 美国), 包括TE缓冲液(pH 7.5)、dsDNA荧光染料和λ 噬菌体DNA标准样(100 ng μ L-1)。用NanoDrop 8000分光光度计(ThermoFisher Scientific, Courtaboeuf, 法国)鉴定小麦叶片初始基因组DNA浓度, 样品使用量为2 μ L。
以荧光值为x轴, 以dsDNA浓度为y轴, 通过线性回归绘制标准曲线。将dsDNA样品的荧光值直接载入定标软件Omega MARS, 根据标准曲线对样品定量分析, 在Microsoft Excel中绘图。
分别按照1/4倍(标准样品A)和1/2倍(标准样品B)稀释λ 噬菌体dsDNA的标准样品, 并设置7个浓度梯度, 分别为0.00024、0.00098、0.00391、0.01563、0.06250、0.25000和1.00000 ng μ L-1 (图1-A)和0.01563、0.03125、0.06250、0.12500、0.25000、0.50000和1.00000 ng μ L-1 (图1-B)。在200 μ L反应体系下, 标准样品A和B的dsDNA实际浓度与荧光值之间均具有较好的相关性(R2> 0.999, 表1)。本研究后续dsDNA浓度定量计算均采用200 μ L体系标准样品A的标准曲线。
 | 图1 λ 噬菌体dsDNA样品A和B制作的标准曲线及不同反应体系间的荧光差异Fig. 1 Lambda dsDNA standard curve in sample A and sample B and the fluorescence differences among four reaction systems |
为减少样品使用量, 降低成本, 在96孔平底微量板上分别使用200 μ L (dsDNA溶液和荧光染料按1︰1等体积混合)、100 μ L、40 μ L、20 μ L和10 μ L反应体系进行定量分析。如图1和表1所示, 随着反应体系降低, 回归曲线斜率逐渐减小。虽然100 μ L和40 μ L体系的标准曲线R2也呈下降趋势, 但测定的荧光值波动较小, 较20 μ L和10 μ L体系稳定。在20 μ L和10 μ L反应体系的低dsDNA浓度(0.0002~ 0.0040 ng μ L-1)区间, 荧光值时常出现波动, 易产生较大误差。可见, 在进行dsDNA定量分析时, 200 μ L反应体系的荧光值最稳定, 建议使用该标准曲线精细定量分析。在对不同基因型间等位基因差异的定性分析时, 可以考虑选择试剂量少且稳定的反应体系, 如100 μ L或40 μ L体系。本研究后续基因型分析均采用40 μ L体系。
| 表1 不同反应体系下λ 噬菌体dsDNA标准浓度A和B的回归方程 Table 1 Regression equations of lambda dsDNA standard sample A and B under five reaction systems |
QuantiFluor染料嵌入dsDNA后可发出较强的荧光, 受ssDNA、RNA和蛋白质影响较小。由于DNA和RNA的紫外吸收峰值相同(均为260 nm), 紫外分光光度计很难区分dsDNA、ssDNA和RNA。在荧光和紫外可见光两种定量系统下, 对小麦叶片DNA (图2-A)和籽粒DNA (图2-B)的定量分析表明, 紫外可见光测定的DNA浓度略高于荧光定量的浓度值, 二者具有较好的相关性(P < 0.01), 而叶片DNA浓度相关系数高于籽粒DNA相关系数, 与预期一致。因为籽粒DNA易受胚乳和糊粉层中蛋白质和多糖污染, dsDNA、ssDNA、RNA、蛋白质等其他吸光物质均对紫外光具有吸光性, 易造成吸收光值偏大, DNA浓度测定值偏高。
 | 图2 小麦叶片DNA(A)和籽粒DNA(B)分别在荧光和紫外可见光下定量差异Fig. 2 Difference of DNA quantification in wheat leaf DNA (A) and seed DNA (B) between FLUOstar and NanoDrop |
本研究小麦叶片dsDNA浓度范围为500~1200 ng μ L-1, 籽粒dsDNA浓度范围为60~900 ng μ L-1, 20 ng μ L-1模板DNA经过PCR扩增后dsDNA浓度范围为5~23 ng μ L-1(图3)。紫外可见光系统(如NanoDrop 8000)测定范围为2~150 000 ng μ L-1, 基本涵盖叶片、籽粒和PCR产物DNA浓度范围, 但实际测定时, NanoDrop在低浓度测定值范围内波动较大, 难以获得准确的PCR产物dsDNA浓度值。QuantiFluor荧光虽然容易测定低浓度dsDNA值(如PCR产物), 但在估测叶片和籽粒dsDNA浓度时, 需要对样品原液进行大倍数稀释, 增加定量误差, 降低工作效率。
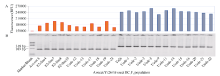
利用Sr32和Sr50基因的显性标记, 分别对两个F2群体的单株进行基因分型。在Sr32/Baj#1群体的44个单株中, 19个检测到Sr32扩增片段(图3-B), 其荧光值为192 349~259 557 RFU, 而未检测出Sr32扩增片段的25个单株的荧光值仅为61 899~117 679 RFU (图3-A), 二者差异极显著(P< 0.01)。在Reedling#1/Sr50群体的66个单株中28个携带Sr50基因, 其荧光值为187 571~249 682 RFU, 远高于未携带Sr50基因的38个单株的荧光值(62 117~120 528 RFU)。可见, 荧光染料完全可以对显性标记进行基因分型。
利用共显性标记We173, 对59个BC1F3单株进行Yr26基因分型鉴定。琼脂糖凝胶电泳发现38个单株可扩增出189 bp特异片段, 21个单株可扩增出318 bp特异片段(图4-B)。这2种基因型的荧光值分别为145 213~176 907 RFU和238 685~256 794 RFU, 差异非常明显(图4-A), 能够有效区分Yr26基因型。我们尝试用琼脂糖凝胶电泳和荧光染料两种方法, 分析定量等位片段差异小或引物特异性较差的标记(Vrn-A1和Xgwm540), 结果表明, 前者能够有效分辨出扩增产物的等位变异, 但等位变异间的荧光强度无显著差异, 无法用后者进行基因分型。
基因鉴定的成本和效率是评价分子育种技术实用性的关键。正常条件下, 每个样品使用荧光染料体系20 μ L, 分析单个微孔板(96个样品)的成本约4.1美元, 耗时8 min。采用2%琼脂糖凝胶电泳检测, 每个微孔板的琼脂糖试剂(不包括常规化学试剂)成本约3.0美元, 耗时90 min。可见荧光定量分析的最大优势在于节省时间, 非常适合高通量样本检测。虽然荧光染料较琼脂糖电泳成本略高, 但基因分型耗时短, 效率提高近10倍。但值得说明的是, 琼脂糖凝胶电泳方法在共显性标记分型中相对稳定, 且能够区分共显性标记的杂合基因型; 荧光定量分析方法对显性标记分型非常有效, 但对共显性标记分型时, 要求引物特异性高、等位变异的片段差异大, 一般应超过100 bp。
提高基因标记检测效率是加速分子育种进程的关键。荧光染料是一种操作安全、简便快捷、高效的核酸分析试剂, 但因成本略高, 目前主要用于活细胞和实时核酸定量研究[2, 3]。本研究基于FLUOstar多功能酶标仪平台建立了QuantiFluor染料的标准曲线(图1和表1), 可有效分析0.1~1.0 ng μ L-1的 dsDNA浓度。尽管荧光染料可对dsDNA准确定量, 但在常规分子实验中, 我们不推荐使用荧光染料测定从小麦叶片和籽粒直接提取的DNA浓度, 主要原因是原液DNA浓度较高, 稀释倍数较大, 容易增加实验操作误差[15], 换算出的原液DNA偏离实际浓度。在精量dsDNA实验时, 建议先使用NanoDrop测定核酸总浓度, 估算DNA稀释浓度处于荧光测定范围内后, 再用荧光染料定量, 避免因dsDNA浓度过高造成荧光强度超过仪器所承载的阈值(< 260 000 RFU) [9, 16, 17, 18]。
| 表2 琼脂糖电泳与荧光染料的经济效益差异分析 Table 2 Comparing the efficiency difference of genetic typing between agarose gel and QuantiFluor dye reagents |
减少样品和试剂使用量, 节约成本, 是高通量实验的基本要求[7]。随着荧光染料反应体系量的减少, 相同浓度dsDNA的荧光信号也逐渐下降, 标准曲线斜率呈下降趋势(图1)。其主要原因是反应体系dsDNA总量降低, 嵌入双链间的染料随之减少, 入射激发光激发的荧光燃料所产生的总荧光强度相对减弱[5, 7, 19]。因此, 控制反应体系和样品使用量是荧光定量技术的关键[6, 19, 20]。通常情况下, 在一定范围内增加dsDNA模板和荧光染料的浓度, 荧光强度也会增加[2, 18, 21], 但过多增加染料浓度, 荧光染料分子间会相互作用形成缔合分子, 产生荧光淬灭团[4, 10, 22]。从经济角度考虑, 我们推荐精量dsDNA浓度实验使用200 μ L反应体系, 染料使用适量。dsDNA定性分析时(如基因分型), 可以减少样品量, 40 μ L反应体系已可满足实验要求。值得注意的是, 每种荧光染料有其最适的pH值, 改变反应体系的pH值易造成染料与核酸双链嵌合不牢固, 加速染料淬灭, 影响荧光吸收强度[11, 22, 23]。
传统凝胶电泳的检测手段能够准确有效检测PCR产物, 但操作繁琐, 耗时费工, 效率低[3, 24]。从理论上讲, 对dsDNA特异性染料均可进行PCR产物定性分析, 通过判断荧光强度计算PCR产物的多寡, 鉴别等位基因。本研究表明, 以荧光强度可有效鉴定显性标记的PCR产物量, 进行等位基因分型。因使用40 μ L反应体系存在微量波动, 对共显性基因标记鉴定时, 需要满足4个条件, 一是不同基因型品种的DNA模板量相对均一, 以减少模板差异对荧光值的影响; 二是被检测等位基因片段的差异尽可能大, 差异至少100 bp; 三是引物特异性好, 只有单个扩增片段, 无其他杂带; 四是尽可能使用精确的移液器, 并保证荧光反应体系中PCR产物的进样量一致。
以荧光染料可精确定量微量dsDNA, 在定量小麦叶片和籽粒提取的全基因组DNA原液时, 过多倍数稀释原溶液会大大降低dsDNA浓度的精确性, 建议选择紫外可见光设备进行高浓度核酸测定。反应体系量对荧光强度有重要影响, 实验过程中应根据研究目的进行调整, 最终达到经济高效的目的。荧光染料可有效区分显性标记或特异性强的共显性标记的等位基因型。尽管荧光定量分析法的成本略高于琼脂糖凝胶电泳方法, 但其操作简单、检测效率高且稳定性好, 值得推广应用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|