第一作者联系方式: E-mail: chengwei8503@163.com, Tel: 15705983326
寄主诱导的基因沉默(host-induced gene silencing, HIGS)以病原菌生长发育、产孢繁殖、侵染或致病过程中的关键基因作为靶点, 在寄主植物中表达针对靶基因的RNAi构建体, 在病原菌侵染植物的过程中, 摄入相应的dsRNA或siRNA分子, 通过识别、结合特异核苷酸序列, 干扰病菌靶基因表达, 从而抑制病菌侵染和扩展, 使植物表现抗病。这项技术为培育基于病原菌特异序列的植物抗病性奠定了基础, 显示了巨大的应用潜力。本文综述了利用HIGS技术提高植物真菌病抗性的最新研究进展, 总结了国内外利用这项技术改良植物真菌病害抗性的主要策略、技术路线, 展望了发展应用前景。
Host-induced gene silencing (HIGS) uses the key genes that are involved in growth and development, sporulation and propagation, and pathogenesis of pathogens as targets, and expresses the RNAi constructs in host plants targeting to the target genes; during infection of plants, pathogens take up dsRNA or siRNA molecules, specifically bind to nucleotide sequences after recognition, and interfere the expression of the target genes, thereby inhibiting infection and spreading of invaded pathogens and thus conferring resistance phenotypes in plants. This technology serves as the solid foundation of plant resistance based on pathogen-specific sequences and has great potential for application in crop improvement against fungal diseases. In this review, recent advances in methodologies, technological routes and application of the HIGS strategy in plants against invading fungal pathogens are summarized; prospects for the future in HIGS-based plant resistance to fungal pathogens were also discussed.
真菌病害是最重要的植物病害类型, 约占植物病害的70%~80%。农作物感病后引起产量下降和品质变劣, 有些病原真菌(如镰刀菌、黄曲霉菌)在侵染植物过程中, 还产生多种对人畜有害的真菌毒素, 影响食品安全。作物病害综合治理有多种技术, 其中培育抗病品种被认为是最经济有效且环境友好的防控措施。然而, 由于已发现的植物抗病种质资源有限, 加之病原菌变异导致部分抗病品种丧失抗性, 导致目前生产上种植推广的一些品种的抗性水平不高, 或抗性表现变异较大, 在病害流行年份往往主要依赖于化学防治。这不仅增加了农业生产成本, 还造成植物产品和环境的污染, 同时容易诱发病原菌的耐药性。长期以来, 抗病资源匮乏一直是作物抗病育种的主要瓶颈之一, 许多重要的植物真菌病害甚至没有发现抗源品种。利用传统育种方式从抗源材料转育抗病品种, 育种程序较为漫长; 因为缺少有效的分子标记, 多数基因也难以利用分子标记辅助选择(marker-assisted selection, MAS)技术加速选育过程。
现代农业生物技术的发展, 为植物抗病新资源的开发及应用开辟了新途径。来自不同植物、动物、微生物的抗病资源, 已广泛用于改良植物的抗病性, 特别是近年来发展起来的寄主诱导的基因沉默(host-induced gene silencing, HIGS)技术展示了良好的发展应用前景。本文概述了该技术在植物真菌病害防治中最新研究进展。
RNA干扰(RNA interference, RNAi)是动物、植物以及微生物中普遍存在的一种遗传现象, 具有保守的作用机制和生物学功能[1, 2]。RNAi技术率先在植物病毒、线虫等病虫害控制中取得良好进展[3, 4, 5], 随后拓展至植物真菌病害防控领域。Nowara等[6]发现植物表达靶向大麦白粉病菌葡聚糖转移酶(GTF1/GTF2)效应子(Avra10)的RNA干扰分子, 引起侵染大麦的白粉病菌吸器减少、菌丝生长受到抑制, 从而提高了大麦的白粉病抗性, 据此首次提出了寄主诱导的基因沉默(host-induced gene silencing, HIGS)的概念。Tinoco等[7]在烟草中表达靶向GUS基因RNA干扰分子, 接种携带GUS基因的串珠镰刀菌, 发现侵染烟草的镰刀菌中的GUS基因表达量显著降低, 表明寄主表达的RNA干扰分子, 可以进入寄生在植物组织中的真菌细胞, 干扰真菌基因的表达。
HIGS技术是病毒诱导的基因沉默(virus-induced gene silencing, VIGS)技术的发展[3]。HIGS通常以病原菌生长发育、致病过程中的关键基因为靶点, 在寄主植物中表达与靶基因序列互补的RNA干扰分子, 经植物细胞Dicer核酸酶加工形成19~25 nt的小RNA分子(small interfering RNA, siRNA), 病原菌在侵染植物过程中摄入这些siRNA, 从而干扰真菌靶基因的翻译和转录, 影响真菌生长发育, 延缓病菌扩展, 降低病害损失, 使植物呈现抗病表型。HIGS中植物细胞表达形成的siRNA亦可作为引物, 在RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRP)作用下, 以靶基因的mRNA为模板, 合成新的双链RNA (double-strand RNA, dsRNA), 经Dicer酶加工, 再形成新的siRNA, 供真菌细胞摄取。如此反复循环, 使寄主细胞中的小RNA分子得以不断扩增, 从而增强RNAi效应[8, 9, 10, 11], 赋予植物持久抗病性。
HIGS作为一种新型植物真菌病害防控技术, 已被用于不同植物与病原真菌的互作及重要作物抗真菌病害的研究中, 取得了一些重要研究进展(表1), 展示出良好的发展应用前景。
| 表1 HIGS技术在植物抗真菌病害领域的研究进展 Table 1 Recent advances in host plant-induced gene silencin(HIGS) for plant improvement against fungal diseases |
在专性寄生真菌中, Nowara等[6]首次将HIGS技术应用于大麦抗白粉病研究。随后, Pliego等[12]在大麦中利用HIGS单细胞分析(single-cell assay)技术, 筛选出8个干扰大麦白粉病菌(B. graminis f. sp. hordei)侵染的效应子。Zhang等[13]利用大麦条纹花叶病毒(Barley stripe mosaic virus, BSMV)介导的VIGS瞬间表达体系, 干扰小麦条锈病菌(Puccinia striiformisf. sp. tritici)钙依赖磷酸酶(Calcineurin)亚基PsCNA1和PsCNB1基因的表达, 可减少病菌产孢量, 延缓菌丝扩展; Panwar等[14, 15]针对小麦叶锈病菌(P. triticina)促分裂素原活化蛋白激酶(PtMAPK1)、亲环蛋白(PtCYC1)、钙依赖磷酸酶B基因(PtCNB), 分别利用农杆菌介导法和BSMV-VIGS两种瞬时表达体系, 在小麦叶片中瞬时表达它们的RNAi构建体, 可显著抑制病原菌生长。
在非专性寄生真菌中, Koch等[16]针对禾谷镰刀菌(Fusarium graminearum)麦角固醇合成相关的甾醇-14α -去甲基化酶基因(CYP51), 在拟南芥和大麦中表达了一个CYP51-A、CYP51-B和CYP51-C基因串联片段的RNAi构建体, 禾谷镰刀菌接种鉴定结果表明转基因植物的抗性显著提高; Ghag等[17]以尖孢镰刀菌(Fusarium oxysporumf. sp.cubense)的Velvet基因和转录因子Ftf1基因为靶点, 在香蕉中分别表达它们的RNAi构建体, 转基因植株抗香蕉萎蔫病能力显著优于未转化的对照。我们以小麦赤霉病菌(F. graminearum)几丁质合酶(chitin synthase, Chs)基因3b为靶点, 将这个基因3个片段的RNAi构建体, 共转化小麦品种扬麦15, 在苗期和花期接种赤霉病菌的鉴定结果表明, 转基因株系既抗苗腐和穗腐, 也抗赤霉菌毒素[18]。最近, Chen等[19]在小麦中分别表达靶向黄色镰刀菌(F. culmorum)葡聚糖合酶基因、MAP激酶、几丁质合酶5基因的RNAi构建体, 也提高了转基因小麦的赤霉病抗性。Wang等[20]以灰霉病菌(Botrytis cinerea)和黄萎病菌(Verticillium dahliae)的Dicer同源蛋白(Dicer-like protein, DCL)基因为靶点, 在拟南芥中共表达BcDCL1/2和VdDCL1/2的RNAi构建体, 获得的转基因植株兼抗这两种病原真菌。
在卵菌中, 不同基因的HIGS表型出现变异。Zhang等[21]在拟南芥中分别表达绿色荧光蛋白基因GFP和寄生疫霉(Phytophthora parasitica)基因PnPMA1的RNAi构建体, 在植物体内可检测到GFP和PnPMA1约21 nt的小RNA分子, 接种携带GFP编码基因的寄生疫霉后, 未能降低GFP和内源PnPMA1的表达量, 也未发生明显的表型变化。作者分析认为, 这可能是寄生疫霉在侵染植物过程中, 缺乏有效摄入dsRNA/siRNA的作用机制。但是, Govindarajulu等[22]的研究表明, 以莴苣盘梗霉(Bremia lactucae)的未知功能基因HAM34和纤维素合成酶基因CES1为靶点, 经农杆菌介导法将HAM34-RNAi和CES1-RNAi构建体导入到莴苣中, 获得的转基因植株的抗霜霉病水平显著提高。这些结果似乎说明, 不同类型的卵菌与不同的寄主植物互作时, 可能具有不同的小RNA分子交换或扩增机制。实际上, 目前关于病原菌如何从植物细胞中摄取dsRNA或siRNA分子, 这方面的机制尚不清楚, 还有待进一步明确。
并非所有的候选靶点基因的下调表达, 都会引起植物相应抗病表型的改变。因此, 选择高效的病原菌靶点基因是HIGS技术在植物真菌病害防治中成功应用的关键。例如, Yin等[23]选择12个在小麦条锈病菌(Puccinia striiformis f. sp. tritici)或秆锈病菌(P. graminisf. sp.tritici)吸器中高效表达的基因, 包括几丁质酶(Chitinase)、甘油醛-3-磷酸脱氢酶(GAPDH)、肌动蛋白(Actin)、β -微管蛋白(β -tubulin)、己糖转运蛋白(HXT1p hexose transporter)、延伸因子(PSTEF1)、5-烯醇式丙酮酰莽草酸-3-磷酸合成酶(EPSPS)以及一些其他未知功能基因, 经BSMV-VIGS在小麦或大麦中瞬时表达, 接种鉴定抗病性, 结果表明, 尽管其中一些基因的表达水平受到了抑制, 但病菌生长发育、孢子形成并未受到影响。因此, 这些候选基因不适合作为HIGS的靶点[23]。Govindarajulu等[22]选择莴苣盘梗霉Bremia lactucae的7个基因为靶点, 包括未知功能基因HAM34、纤维素合成酶CES1、延伸因子ELF1、肌动蛋白Actin、微管蛋白β -tubulin、致死和乙烯可诱导蛋白1 (Nep1)类蛋白NLP2和NLP3, 利用农杆菌介导法分别将这些基因的RNAi构建体转化莴苣, 其中仅表达HAM34-RNAi和CES1-RNAi构建体的转基因植株, 其霜霉病抗性显著提高。这些研究表明, 病原菌不同靶点基因(或片段)的RNA干扰效率, 可能与靶点基因自身的功能及其调控方式、代谢路径及其网络、时空表达模式、同相关路径基因的互作特点等因素有关。
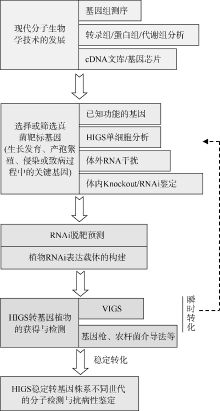
随着大量病原菌和寄主植物基因组测序完成及功能解析, 相关遗传信息也越来越丰富, 如何从这些海量信息中找到理想的靶点基因, 还需要开展大量研究。专性寄生真菌由于体外培养比较困难, 可采用HIGS单细胞分析或VIGS介导的瞬间表达体系, 筛选有效的靶基因。非专化真菌既可以采用上述方法, 也可以采用病原菌体外或体内RNAi鉴定, 结合基因敲除缺失突变体方法, 筛选可用于HIGS的靶基因(图1)。
为了避免潜在的RNAi脱靶造成的负面效应, 还需要对靶标基因进行RNAi脱靶预测, 如利用Blastn或SI-FI生物软件(http://labtools.ipk-gatersleben.de/), 选择特异性高、干扰效率显著的序列, 用于RNAi构建体的构建。
根据研究目的或转化方法, 可以构建用于基因枪或农杆菌介导法转化的RNAi构建体(用于稳定及瞬间表达), 或BSMV-VIGS表达体系(瞬间表达)。根据选择的靶基因, RNAi构建体的构建大致可采用以下几种方式: 针对单个靶基因(或基因区段), 构建单个RNAi构建体转化植物; 针对单个靶基因序列的不同区段, 构建几个不同的RNAi构建体共转化植物或者构建一个携带某个靶基因不同区段序列RNAi构建体, 以获得加强的干扰效果。可针对同一家族的多个基因同源性很高的保守区域, 来设计RNAi构建体转化植物, 产生对多个基因同时沉默的小RNA分子; 针对不同类型的靶基因, 构建几个不同的RNAi构建体, 共转化植物或者构建一个携带几个不同类型靶基因序列的RNAi构建体, 达到对多个不同类型靶基因同时沉默的效果。
通过遗传转化获得HIGS稳定转基因植物后, 一般需要通过PCR以及Southern杂交等技术手段对转基因植株进行鉴定, 以检测其遗传稳定性。还可以利用Northern杂交或小RNA转录组测序分析技术, 检测、鉴定HIGS转基因植物体内能否形成19~25 nt的特异siRNA分子。接种病原菌后, 靶基因的表达水平是否降低, 以及能否产生相应的抗病表现型, 是对特定病原菌靶基因进行HIGS介导的真菌病害防治效果的最终评价。
长期以来, 学术界一直在寻找高效、特异的植物病原菌控制靶点, HIGS技术的发展为开发和利用源于病原菌的抗病资源提供了一个有效途径, 特别是对于抗病资源匮乏的作物抗病改良具有重要意义。一般认为, HIGS靶基因主要包括控制病原菌生长发育、产孢繁殖、侵染或致病的关键或必需功能基因。此外, 在真菌中, 越来越多的非编码RNA (non-coding RNA, ncRNA)的发现, 可被视为一种新的遗传资源。这类RNA不行使编码蛋白质的功能, 却是维持真菌基本生存和调节基因表达必不可少的分子。以病原菌特异ncRNA为靶点, 如利用target mimics技术[24, 25, 26], 干扰其正常的功能, 导致其功能紊乱, 这将进一步拓宽源于病原菌的抗病资源开发渠道, 为抗病育种提供更多选择, 培育广谱、持久的植物抗病品种。
近年研究表明, 灰霉病菌(B. cinerea)和黄萎病菌(V. dahliae)在侵染植物过程中, 向寄主细胞中分泌一些效应子, 除了传统认为的效应蛋白外, 还发现一类小RNA分子, 这类小RNA分子由Dicer同源蛋白DCL1和DCL2加工而成, 它们在植物抗病免疫防卫反应中具有重要作用[20, 27]。利用HIGS技术, 在植物体内表达DCL1/2-RNAi构建体, 可以显著提高寄主的抗病能力。此外, 在植物体表施用人工合成的DCL1/2-dsRNA或siRNA分子, 同样也起到很好的病害防治效果[20, 27]。Koch等[28]的研究也表明, 在大麦叶片表面喷施CYP3-dsRNA (CYP51-A、CYP51-B和CYP51-C基因片段串联dsRNA)分子, 接种后禾谷镰刀菌生长受到严重抑制。据Zhang等[29]新近报道, 植物自身也可以分泌一些microRNA分子, 这些microRNA分子被病原菌摄取, 可以靶向干扰病原菌致病过程中一些关键基因的表达, 从而抵御病原菌侵染和扩展。这些研究结果揭示了小RNA分子能够在某些病原真菌与寄主植物之间双向迁移, 为基于RNA干扰分子新型杀菌剂的研发及应用提供了依据。
随着现代生物技术的发展, 以及植物与病原菌互作分子机制的深入研究, HIGS技术在发掘与利用新型抗病资源方面显示出了巨大的应用潜力。由于具有基于核苷酸序列的靶向特异性, 这项技术也为培育稳定、环境安全的转基因作物提供了一种新思路, 在作物抗病遗传改良中具有重要意义。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|