全蚀病和根腐病是小麦(
Take-all disease is primarily caused by a soil-borne fungus
近年来, 农田保护性耕作技术的推广为土壤病原菌的繁殖创造了良好的环境条件, 使田间病原菌积累, 造成土传病害加剧[1]。小麦作为世界上总产量第二的粮食作物, 也受到一系列土传病的危害, 对小麦的产量和品质造成直接威胁。全蚀病是由腐生真菌禾顶囊壳小麦变种( Gaeumannomyces graminis var. tritici, Ggt)引起的世界范围的小麦毁灭性根部病害[2]。病原菌侵染小麦根部细胞, 引起次生细胞壁木质化, 破坏维管组织, 严重阻碍水分和养分运输, 造成小麦萎蔫、早熟, 形成枯白穗, 导致产量严重损失, 一些地块减产高达40%~60%[3,4,5]。我国小麦全蚀病发生于河北、河南、内蒙古、山东、陕西、甘肃等多个地区[6]。根腐病又称根腐叶斑病或黑胚病[7], 主要由平脐蠕孢菌 Bipolaris sorokiniana(有性态为禾旋孢腔菌 Cochliobolus sativus)引起[8]。根腐病原菌侵染小麦根系、茎秆基部, 加速叶片衰老, 引起植株倒伏, 严重时造成枯白穗, 轻者减产5%~10%, 重则减产20%~50%以上[9]。我国小麦根腐病主要发生于东北、西北、华北、内蒙古、广东等地。目前, 防治上述土传病害的方法主要是化学防治。选育和推广抗病小麦品种是防治上述病害最安全、经济和有效的方法, 然而由于缺乏理想的抗小麦全蚀病和根腐病的种质资源, 常规育种方法在培育小麦抗病品种方面进展缓慢。挖掘和利用抗病有效基因、开展基因工程改良抗病性研究, 则为抗全蚀病、根腐病小麦育种提供了一条新途径。
富含多糖的细胞壁是植物抵御病原微生物入侵的第一道屏障。病原真菌侵入植物细胞时分泌多聚半乳糖醛酸酶(EC3.2.1.15), 该酶能水解细胞壁的重要成分果胶等[10,11]。多聚半乳糖醛酸酶抑制蛋白(polygalacturonase-inhibiting protein, PGIP)是一种富含亮氨酸重复序列(LRR)的植物天然糖蛋白, 属于LRR蛋白超家族, 存在于植物细胞壁。当植物受到病原菌侵染时, PGIP能专一性抑制真菌的内切多聚半乳糖醛酸酶(endopo1ygalacturonase, PG)活性, 并传递防御信号, 引起植物细胞的一系列防御反 应[12]。Albersheim 和 Anderson首先在红芸豆、番茄和美国梧桐的细胞壁中发现PGIP能抑制某些病原菌PG的活性[13]。Sathiyaraj等[14]从人参中分离得到1个编码PGIP的基因 PgPGIP1。当人参受到立枯丝核菌、尖孢镰刀菌、灰霉病菌等多种病原菌侵染时, PgPGIP1基因的表达量上调, 而且不同组织部位的表达量不同, 其中以根部最高, 减少真菌分泌的PG, 体外抑菌试验表明PgPGIP1蛋白能抑制一些病原真菌的PG活性。但 PgPGIP1在植物体内特别是在小麦中抗病功能的研究尚未见报道。
本研究拟通过人工合成 PgPGIP1基因, 构建该基因的单子叶植物高效表达载体pA25-PgPGIP1, 通过基因枪介导法转化推广小麦品种扬麦18, 对转基因小麦T0至T4代材料进行分子检测和抗病性鉴定, 分析 PgPGIP1基因在小麦中的表达水平以及对全蚀病及根腐病的抗性, 以期获得抗全蚀病及根腐病的小麦新种质。
小麦受体为推广品种扬麦18, 由江苏里下河农业科学研究所程顺和院士提供, 取其幼胚用作转基因受体材料。小麦全蚀病菌 Ggt XNQS-2由西北农林科技大学植物保护学院王阳副教授提供。小麦根腐菌ACC30209由中国农业科学院作物科学研究所李洪杰研究员提供。
通过人工合成得到 PgPGIP1基因的全长编码序列(ORF)[14], 共1101 bp, 以其为模板, 利用引物(PgPGIP1-Sma F: 5′-AGCCCGGGATGAATGCCTTC TTCTTCAT-3′, 下画线指示 Sma I酶切位点; PgPGIP1-SacR: 5′-CTGAGCTCTCAACAAGGTCTA AGCGGCT-3′, 下画线指示 Sac I酶切位点)进行PCR扩增, 在 PgPGIP1基因的5′和3′端分别添加 Sma I和 Sac I酶切位点, 然后用 Sma I和 Sac I消化含上述酶切位点的该基因以及单子叶表达载体pAHC25, 回收目的片段, 利用T4连接酶将 PgPGIP1基因ORF连接到pAHC25载体上, 构建 PgPGIP1基因的植物表达载体pA25-PgPGIP1 (图1), 转化到大肠杆菌TOP10感受态细胞中, 进行菌落PCR筛选、测序分析, 以确定构建的基因表达载体pA25-PgPGIP1的正确性。该载体中 PgPGIP1基因受启动子 Ubiquitin控制, 另外 Bar基因由另一个 Ubiquitin启动子控制, 可为后续选择利用Bialaphos筛选转化再生植株提供抗性筛选标记。
采用徐惠君等[15]报道的基因枪介导法, 将pA25-PgPGIP1载体DNA与适量金粉混合, 转化小麦扬麦18幼胚愈伤组织, 经过分化, Bialaphos筛选, 再生, 移栽, 获得转基因小麦T0代植株。从成活的转 PgPGIP1基因PCR呈阳性的T0代小麦植株上收获种子, 单株播种, 获得T1代植株; 依此类推, 获得T2~T4代植株。
1.4.1 PCR检测 采用改良的CTAB法[16]从转基因小麦幼苗叶片中提取基因组DNA作为PCR检测的模板。根据转基因载体pA25-PgPGIP1的序列设计转基因检测的特异引物(Ubi-1956F: 5′-TCGAT GCTCACCCTGTTGTTTG-3′, 位于 Ubiquitin启动子序列; PgPGIP1-TR: 5′-TCCAATCCGCCATAGTGC T-3′, 位于 PgPGIP1基因读码框)。预期扩增片段约为414 bp。PCR扩增体系20 μL, 含2 μL 10×buffer (TaKaRa)、1.5 μL dNTP (2.5 mmol L-1)、上下游引物各0.5 μL (10 μmol L-1)、0.2 μL r Taq聚合酶 (5 U μL-1, TaKaRa)、50 ng基因组DNA。扩增条件为94℃预变性5 min; 94℃ 45 s, 57.5℃ 40 s, 72℃ 40 s, 共18个循环; 94℃ 45 s, 56℃ 40 s, 72℃ 40 s, 共20个循环; 72℃ 10 min。用扬麦18和水作为阴性对照, pA25-PgPGIP1质粒为阳性对照, 扩增产物经1.2%琼脂糖凝胶电泳, EB染色, 紫外拍照。
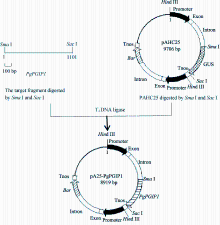 | 图1 pA25-PgPGIP1表达载体构建流程Fig. 1 Construction of pA25-PgPGIP1 expression vector |
1.4.2 RT-PCR和Q-RT-PCR分析 用RNAiso Plus (TaKaRa)试剂盒提取小麦植株根部总RNA, 按RNA PCR Kit (AMV) Ver.3.0 (TaKaRa)说明书合成第一链cDNA作为模板, 首先用 Actin基因特异引物(Act-A: 5′-CACTGGAATGGTCAAGGCTG-3′, Act-B: 5′-CTCCATGTCATCCCAGTTG-3′)使各样本cDNA均一化, 然后用 PgPGIP1基因特异引物(PgPGIp1- Q-331U: 5′-AGCACTATGGCGGATTGGA-3′, PGPGIP1- Q-637L: 5′-TCCCACTCAGTAAAGCCCG-3′)进行半定量RT-PCR表达分析。扩增条件为94℃预变性5 min; 94℃ 40 s, 61℃ 40 s, 72℃ 40 s, 共38个循环; 72℃ 10 min。
用ABIPRISMR 7300实时荧光定量PCR仪(ABI, 美国)进行Q-RT-PCR分析。反应体系25 μL, 按照SYBR Premix Ex Taq(TaKaRa)反应系统, 以 Actin作为内参, 用PgPGIp1-Q-331U/PGPGIP1-Q-637L引物进行 PgPGIP1的特异扩增。反应条件为94℃预变性5 min; 94℃变性15 s, 61℃退火31 s, 41个循环。用2-ΔΔCT方法[17]计算转基因小麦相对于受体扬麦18的 PgPGIP1基因的相对表达量。
上述实验均进行3次独立重复。
1.5.1 全蚀病抗性 将全蚀病菌接种于PDA固体培养基上, 以25℃培养箱培养15 d, 采用菌饼 法[18]对转基因小麦及未转基因的小麦扬麦18(对照)接种全蚀病菌, 每个株系接种30株。采用沙土(沙与土体积比为2∶1)培养接种后的小麦幼苗, 喷水保湿, 21 d后, 测量单株的黑(病)根长与总根长, 调查黑根面积占总根面积的百分比(即严重度); 根据病根的严重度, 参照Bithell等[19]的分级方法分成5级, (IT 0表示无感病症状, IT 1表示0<严重度≤10%; IT 2表示10%<严重度≤30%; IT 3表示30%<严重度≤60%; IT 4表示 严重度>60%)。全蚀病病情指数TAI (take-all index) = (10×N1+30×N2+60×N3+100×N4)/ (N1+N2+N3+N4), N为各病级的病株数[19]。
1.5.2 根腐病抗性 参照Dong等[20]的麦粒接种法, 在小麦分蘖盛期, 将长满平脐蠕孢菌菌丝的麦粒嵌入麦苗叶鞘内, 每个叶鞘嵌入一个有菌麦粒, 每个株系接种30株, 接种完后, 至少保湿3 d。在小麦成熟期对单株进行病情调查, 采用Dong等[20]的0~4级分级方法, 其中IT0表示无病; IT1表示叶鞘变褐, 但不侵入茎秆; IT2表示叶鞘变褐, 病斑侵入茎秆, 环茎不超过茎周的1/2; IT3表示侵入茎秆的病斑环茎1/2~3/4; IT4表示侵入茎秆的病斑环茎3/4以上或茎秆软腐。
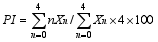
式中, PI为病情指数, n为病级, Xn表示病级为 n级的病秆数。
由图1和测序分析结果可知, 构建的 PgPGIP1基因表达载体pA25-PgPGIP1的序列与插入方向是正确的, 受玉米泛素基因( ubiquitin, Ubi)启动子的控制, 能在单子叶植物中高效表达, 可用于创制转基因小麦新材料。用基因枪介导法将pA25-PgPGIP1导入扬麦18幼胚愈伤组织, 经筛选、分化得到转 基因再生植株49株。利用pA25-PgPGIP1特异引 物进行PCR检测, 获得转基因小麦T0代阳性植株 11株。
提取转基因小麦叶片的基因组DNA作为目标基因检测的模板, 利用 PgPGIP1基因转化载体序列设计的特异性引物(Ubi-1956F和PgPGIP1-TR)进行PCR检测。结果表明, 其中4个转 PgPGIP1基因株系(G1~G4)的T1~T4代植株均可以检测到转入的外源基因 PgPGIP1 (图2), 说明该外源基因可在这4个转基因小麦株系中稳定遗传。
半定量RT-PCR分析结果表明, 经 Ggt或 B. sorokiniana侵染后, 转 PgPGIP1基因的T4代抗病株系, 即G1、G2、G3和G4中 PgPGIP1基因的转录水平高于未转基因小麦扬麦18。进一步用Q-RT-PCR定量分析各转基因株系 PgPGIP1的相对表达量。结果表明, Ggt或 B. sorokiniana侵染的转基因植株中 PgPGIP1的相对表达量均显著高于未转基因小麦扬麦18的, 但不同株系中表达量存在差异(图3)。
全蚀病鉴定结果显示, 与未转基因小麦扬麦18相比, 转基因小麦株系G1、G2、G3和G4的严重度与病情指数均显著降低(表1)。其中, 转基因株系G1~G4的严重度为9.12%~27.95%, 全蚀病病情指数TAI为16.52~36.67; 而未转基因小麦扬麦18的严重度为59.63%, TAI为72.73。转基因株系的病根面积下降53.13%~84.71%。因此, PgPGIP1基因的表达显著提高了转 PgPGIP1基因小麦对全蚀病的抗性。
 | 图2 转 PgPGIP1基因扬麦18的T1~T4代PCR检测A: T1代; B: T2代; C: T3代; D: T4代。M: 100 bp DNA ladder; P: 转基因载体质粒pA25-PgPGIP1; WT: 未转基因扬麦18; CK: H2O; G1~G4: 转基因株系。Fig. 2 PCR analysis of PgPGIP1 transgenic wheat Yangmai 18 from T1 to T4 generationsA: T1 plants; B: T2 plants; C: T3 plants; D: T4 plants. M: 100 bp DNA ladder; P: PgPGIP1transformation vector pA25-PgPGIP1; WT: wild-type Yangmai 18; CK: H2O; G1-G4: transgenic lines. |
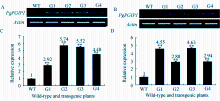 | 图3 转基因小麦中 PgPGIP1基因RT-PCR(A、C)与Q-RT-PCR(B、D)分析A, C: 全蚀病菌侵染; B, D: 根腐菌侵染。WT: 未转基因的扬麦18; G1~G4: 转基因株系。**表示转基因株系表达量与未转化小麦扬麦18有极显著差异( P< 0.01)。Fig. 3 RT-PCR (A, C) and Q-RT-PCR (B, D) assays on PgPGIP1transcript in transgenic wheat plantsA and C: inoculated by Gaeumannomyces graminis var. tritici; B and D : inoculated by Bipolaris sorokiniana. WT: untransformed Yangmai 18; G1-G4: transgenic lines.** Significantly different between the transgenic line and untransformed Yangmai 18 at P< 0.01. |
| 表1 转 PgPGIP1基因小麦及其对照(WT)的全蚀病与根腐病鉴定结果Table 1 Resistance to take-all and common root rot diseases in PgPGIP1transgenic line and the untransformed Yangmai 18 (WT) |
根腐病鉴定结果显示, 与未转基因扬麦18相比, 转基因小麦株系G1、G2、G3和G4的病级与病情指数均显著低于扬麦18 (表1)。其中转基因株系G1与G3病级为1.00~1.29, 与扬麦18相比达到极显著差异。转基因株系的病情指数为20.00~30.51, 对照扬麦18病情指数为42.71, 存在显著差异。可见 PgPGIP1基因的表达显著增强了转 PgPGIP1基因小麦对根腐病的抗性。
PGIP主要通过抑制病原菌PG的活性提高植物抗病性。已报道的PGIP基因多数是从双子叶植物中分离的, 而从单子叶禾本科植物中分离的PGIP基因报道很少。已有研究表明, 外源 PGIP基因转入小麦提高了转基因小麦对根腐病的抗性。Janni等[12]将菜豆 PvPGIP2基因转化到小麦植株中, 可增强转基因小麦对平脐蠕孢菌PG的识别能力和对平脐蠕孢菌的抗性。党良等[21]将大豆 GmPGIP3基因转入小麦中, 转基因小麦对根腐病的抗性有明显的提高。Sathiyaraj等[14]分离出人参 PGIP基因 PgPGIP1, 并证明PgPGIP1蛋白能够抑制立枯丝核菌( Rhizoctonia solani)、腐霉菌( Phythium ultimum)、胶孢炭疽菌( Colletotrichum gloeosporioides)和尖孢镰刀菌( Fusarium oxysporum)等真菌的PG活性, 具有广谱抑菌活性。
本研究表明, PgPGIP1基因表达的转基因小麦植株对全蚀病、根腐病的抗性有所提高, 证明 PgPGIP1基因在利用基因工程进行抗全蚀病、根腐病小麦育种上具有一定潜力。Q-RT-PCR与抗病性鉴定结果显示, 各转基因株系应答 Ggt与 B. sorokiniana侵染的 PgPGIP1基因表达量存在差异, 对全蚀病与根腐病的抗性提高程度有所不同, 有的株系如G2对全蚀病的抗性高于G1, 但是对根腐病的抗性却低于G1, 造成此结果的原因可能是由于接种病原菌的方式、鉴定时期与抗性机制不同。全蚀病抗性鉴定采用菌块接种法, 在苗期进行抗病性鉴定; PgPGIP1基因表达提高转基因小麦苗期对全蚀病的抗性; 而根腐病抗性鉴定采用麦粒接种法, 在分蘖盛期进行接种, 于成熟期进行抗病性鉴定; PgPGIP1基因表达提高转基因小麦成熟期对根腐病的抗性。
通过基因枪介导法, 将外源基因 PgPGIP1成功转化到小麦品种扬麦18中, 该外源目的基因可以在转基因小麦中稳定遗传并超量表达, 从而提高转基因小麦对全蚀病与根腐病的抗性; 从转 PgPGIP1基因小麦后代中选育出兼抗全蚀病与根腐病的小麦新种质4份。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|

