利用分子标记辅助选择和田间鉴定选择相结合的方法, 将三黄占2号的抗稻瘟病主基因
The novel blast resistance genes,
稻瘟病是由稻瘟病菌( Pyricularia griseaSacc.有性世代为 Magnaporthe grisea)引起的在水稻上最具毁灭性的病害。在流行年份, 发病地区一般减产10%~20%, 重的达40%~50%, 局部田块甚至颗粒无收[1]。白叶枯病是由水稻黄单胞菌水稻致病变种( Xanthomonas oryzaepv . oryzae, Xoo)引起的, 一般情况下可造成水稻减产20%~30%, 重病田损失80%, 甚至绝收[2,3,4]。实践证明, 培育和推广抗病品种是控制水稻病害发生的最经济有效方法。因此, 利用优良的抗性资源, 通过多基因聚合, 培育具有多种抗性或综合抗性品种对水稻的高产、稳产以及优质生产等具有重要的意义。
截至2012年6月, 至少有63个抗稻瘟病主基因和共77个主效QTL被报道, 这些基因分布于除第3染色体外的其他染色体上, 其中22个基因已被成功克隆[5]。由广东省农业科学院培育的三黄占2号对稻瘟病的抗性由 Pi-GD-1(t)、 Pi-GD-2(t)和 Pi-GD-3(t)等主基因和主效QTL [ GLP8-6(t)]控制, 对稻瘟病具有持久抗性[6]。三黄占2号不仅对中国稻瘟病菌株有广谱抗性, 而且对菲律宾稻瘟病菌株亦有高的抗性频率(98%)[7]。目前已有35个白叶枯病抗性基因被报道[5,8,9], 其中 Xa4和 Xa21被育种工作者们广泛应用。 Xa23是一个全生育期表现完全显性的广谱、高抗基因, 其抗性转移效应强[10]。 Xa23基因对中国、菲律宾和日本的白叶枯病菌表现广谱高抗[11]。
明恢86、蜀恢527和浙恢7954是我国大面积推广的杂交稻恢复系, 与II-32A配制出的II优明86、II优527和II优7954[12]等强优势组合, 在生产上大面积应用。明恢86和蜀恢527及配制的杂交稻组合对稻瘟病具有较好抗性, 但浙恢7954及其配制的组合稻瘟病抗性相对较差; 3个恢复系及杂交稻组合对水稻白叶枯病不具抗性。本研究利用带有抗稻瘟病基因 Pi-GD-1(t)、 Pi-GD-2(t)、 Pi-GD-3(t)和 GLP8-6(t)的三黄占2号和带有抗白叶枯病基因 Xa23的IRBB23为供体亲本, 通过复交进行2种抗病基因的聚合, 利用分子标记辅助选择将抗性基因导入到明恢86、蜀恢527和浙恢7954中, 选育抗稻瘟病兼抗白叶枯病的双基因或多基因聚合且农艺性状优良的新型恢复系, 评价多基因聚合恢复系对稻瘟病和白叶枯病的抗性改良效果, 以期为杂交稻抗病育种提供依据。
选用我国目前推广面积大的优良杂交稻恢复系明恢86、蜀恢527、浙恢7954为受体亲本, 来源于广东省农业科学院带有抗稻瘟病主基因 Pi-GD-1(t)、 Pi-GD-2(t)、 Pi-GD-3(t)和主效QTL GLP8-6(t) (分别简称为G1、G2、G3和G8)的三黄占2号和带有抗白叶枯病基因 Xa23的IR24近等基因系IRBB23为供体亲本。三系不育系II-32A用于抗性改良恢复系测交种的杂种优势鉴定和抗性评价。CO39和IR24分别用于稻瘟病和白叶枯病人工接种的对照品种。
水稻稻瘟病接种和抗性评价的菌株共计20个, 包括15个B型小种的菌株(GD08-T13、GD00-193、GD05-26a、GD07-116、GD11-1287、GD11-1093、GD11-3006、GD93-286、GD93-203、GD12-3055、GD98-288a、GD95-59a、GD97-322、GD10-424和GD10-555)和5个C型小种菌株(GD11-239、GD10- 3121、GD11-122、GD10-318a和GD11-1011), 均为广东省致病力较强的菌株。
用于水稻白叶枯病接种和抗性评价的小种或菌系共计17个, 其中10个小种来源于菲律宾国际水稻研究所, 包括P1 (PXO61)、P2 (PXO86)、P3 (PXO340)、P4 (PXO71)、P5 (PXO112)、P6 (PXO99)、P7 (PXO145)、P8 (PXO280)、P9 (PXO339)和P10 (PXO341); 另有7个菌系来自中国, 包括C1 (JS97-2)、C2 (KS6-6)、C3 (JS185-2)、C4 (Z173)、C5 (GD1358)、C6 (CS198)、C7 (JS49-6)。其中P6 (PXO99)是致病力最强的小种, C5 (GD1358)为中国的优势致病菌系。
将三黄占2号和IRBB23分别与明恢86、蜀恢527和浙恢7954杂交, 对相同恢复系不同供体亲本的F1进行复交, 聚合抗稻瘟病基因和 Xa23 (图1)。将复交F1定点播种于50孔的塑料秧盘中, 每孔播1粒种子, 于四叶期分单株对应取叶片提DNA, 采用与G1的两侧标记RM6208和R8M10, 与G2、G8和 Xa23紧密连锁的分子标记RM3855、G8-6ID-1和RM206进行PCR扩增检测抗性基因; 与抗性基因G3连锁的RM179在3个轮回亲本和抗源供体间均无多态, 因而无法采用标记进行检测(表1)。分蘖期和孕穗期接种白叶枯病优势菌系C5 (GD1358)验证白叶枯病抗性。选择抗白叶枯病单株(基于标记和接种鉴定结果)和抗稻瘟病单株(仅基于标记检测结果)自交留种, 获得F2群体。采用同样的方法在秧苗期对F2群体3个抗瘟基因和 Xa23基因进行分子标记检测, 选择抗性基因纯合且农艺性状与受体亲本相仿的个体继续自交, 得到F3代株系。下一代按株系播种, 经秧苗期对抗性基因分子检测, 选抗性基因型纯合且综合性状与轮回亲本相仿的个体收获F4自交种子, 之后采用分子标记跟踪检测结合系谱选育, 直至农艺性状完全稳定。从3个恢复系背景的抗性基因导入后代, 分别选择带有单个或多个抗瘟基因与抗白叶枯病基因组合、综合性状与轮回亲本相似的稳定株系用于抗性鉴定和与不育系测交。经广东省农业科学院植物保护研究所苗期稻瘟病接种鉴定和中国农业科学院作物科学研究所白叶枯病接种鉴定, 根据恢复系抗性和测交种的优势表现, 最终确定2个带有纯合双抗基因且对稻瘟病和白叶枯病抗性强、农艺性状与轮回亲本相似的株系, 分别命名为明恢86-G1-G2- Xa23和蜀恢527-G2- Xa23。
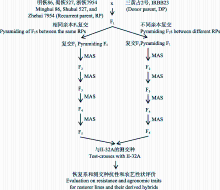 | 图1 中籼恢复系抗稻瘟病和抗白叶枯病分子改良图示Fig. 1 Scheme of molecular improvement of blast and bacterial leaf blight resistance for restorer lines |
| 表1 与稻瘟病基因和抗白叶枯病基因紧密连锁的分子标记信息Table 1 Information of molecular markers associated with resistance genes for rice blast and brown planthopper |
对单个恢复系进行抗性改良的同时, 对不同恢复系背景的F1通过复交聚合不同抗性基因, 如浙恢7954/三黄占2号F1分别与蜀恢527/ IRBB23和明恢86/IRBB23的F1复交, 采用上述同样方法, 在复交后代于秧苗期对3个抗瘟基因和 Xa23基因进行分子标记检测, 由于RM179在3个轮回亲本和抗源供体间均无多态, 因此在检测时只能选择带有G1、G2和G8的抗稻瘟病基因单株移栽和收获自交种子, 并增加入选单株数量以增加对无多态抗性基因G3的入选机会, 之后每代采用分子标记检测抗性基因, 进行系谱选育, 直至选育出抗性基因纯合且农艺性状优良的株系。经稻瘟病和白叶枯病接种鉴定, 最终得到3个带有纯合双抗基因的株系, 分别命名为明浙-G2-G8- Xa23-1 、明浙-G2-G8- Xa23-2和明浙-G1-G2-G8- Xa23。
将3个原始恢复系和上述5个聚合抗稻瘟和抗白叶枯病基因的改良系, 委托广州省农业科学院植物保护研究所进行苗期稻瘟病接种鉴定, 采用搪瓷盘育苗, 播前种子消毒催芽, 将被鉴定的水稻材料及对照品种CO39的种子分区均匀播于盘中, 3次重复。待水稻生长至三叶一心时, 将其移至接菌室, 喷雾接种。稻瘟病菌分生孢子悬浮液浓度约为2×105个孢子 mL-1, 用弥雾喷雾器将分生孢子悬浮液喷洒于稻苗上, 喷雾量为每100株苗30 mL接种液。24℃保湿培养48 h, 再移至室外遮阴保湿7~10 d, 当感病对照CO39病情稳定时, 采用目测法调查病斑大小[13]。根据病斑占叶面积百分率将抗感反应型划分为9级, 0~3级为抗(R), 4~9级为感(S)。
将3个原始恢复系和上述5个聚合抗稻瘟和抗白叶枯病基因的改良系及其与II-32A的测交种, 2011年夏种于中国农业科学院作物科学研究所水 槽, 每材料种9行, 每行种8株, 行株距20 cm × 17 cm, 2次重复。于分蘖期和孕穗期采用剪叶法[17], 分别接种菲律宾10个白叶枯病小种和我国7个白叶枯病菌系, 每菌系接种4株, 每株剪3~4张最上部的完全展开叶, 每行接2个菌系, 分蘖期接种2周后调查, 孕穗期接种3周后调查, 测量接种叶的病斑长度, 以4株所有接种叶的平均病斑长度作为指标衡量白叶枯病的抗性水平。
为探讨恢复系的白叶枯病抗性改良效果, 2011年冬在海南三亚中国农业科学院试验农场, 将3个原始恢复系和上述5个抗稻瘟病兼抗白叶枯病改良恢复系及其与II-32A的测交种, 分别种在两块水田, 一块接种白叶枯病菌, 另一块作为不接种的对照。每个材料种2行, 每行10株, 行株距25 cm×17 cm, 2次重复。按上述同样的方法于孕穗期接种我国白叶枯病C5型菌系GD1358, 记载抽穗期(d), 成熟后每材料取中间的6株考察株高(cm), 每株取2个主穗考察穗部相关性状如每穗总粒数、每穗实粒数、结实率(%)和千粒重(g), 并混收测定单株产量(g 株-1)。由于2012年春海南接种时间偏迟, 白叶枯病发病不理想。故2013年春季在海南对改良恢复系及其与II-32A的测交种重新接种白叶枯病菌, 并考察接种组的相关农艺性状。对所得数据采用SAS 8.0软件进行方差分析, 达显著水平者再进行LSD比较。
经稻瘟病接种鉴定, 3个恢复系亲本对源于广东省的20个稻瘟病菌表现出不同的抗性水平(表2), 明恢86除了对S10和S17菌株表现感病外, 对其他菌株均表现抗病, 抗病频率达90%; 蜀恢527对S2、S6和S12菌种感病, 对其他17个菌株表现抗病, 抗病频率为85%; 浙恢7954只对S1、S11、S14、S15、S16、S19和S20等7个菌株具有抗性, 抗病频率仅为35%。感病对照CO39只对S14、S15具有抗性, 抗病频率为10%。抗源供体三黄占2号对20个菌株中的S2和S10感病, 对其他18个菌株表现抗病, 抗病频率为90%。表明3个恢复系亲本的稻瘟病抗性存在明显差异, 明恢86最好, 浙恢7954最差。
5个多基因聚合恢复系对20个稻瘟病菌种的抗性频率变化范围为90%~95% (表2), 其中明恢86- G1-G2- Xa23只对S10、S17菌株感病, 与轮回亲本明恢86相似, 抗病频率为90%; 蜀恢527-G2- Xa23对20个菌株中19个表现抗病, 与轮回亲本蜀恢527相比改善了对S2和S12的抗性, 抗病频率达到95%; 明浙-G2-G8- Xa23-1只对S2、S10菌株感病, 抗病频率为90%; 明浙-G2-G8- Xa23-2只对S2菌株感病, 抗病频率为95%; 明浙-G1-G2-G8- Xa23只对S10菌株感病, 抗性频率达到95%。5个多基因聚合恢复系对20个稻瘟病菌种的抗性均显著强于亲本浙恢7954、蜀恢527, 优于或与明恢86相仿。结果表明, 浙恢7954的稻瘟病抗性改良效果明显, 多数后代株系的抗瘟性均明显高于对照。虽然蜀恢527对大多数的菌株表现抗性, 但是通过引入三黄占2号的抗稻瘟病基因, 改良系对稻瘟病的抗性有不同程度的改善。说明利用三黄占2号抗稻瘟病基因改良恢复系的抗瘟性是可行的。
| 表2 稻瘟病抗性改良恢复系对稻瘟病菌的抗性评价Table 2 Evaluation of resistance of newly bred restorer lines to Pyricularia grisea Sacc . |
采用7个中国和10个菲律宾的白叶枯病菌于分蘖期和孕穗期接种鉴定, 带有 Xa23抗白叶枯病基因的供体IRBB23苗期和孕穗期对所有菌系的病斑长度均小于1 cm, 表现出高水平抗性, 感病对照IR24对17个菌系的病斑长度平均为12.8 cm, 变幅为8.8~18.2 cm, 表现高度感病(表3)。明恢86和蜀恢527苗期和孕穗期除对我国的C1、C3和C4等少数弱致病力菌系表现抗病外, 对多数菌系尤其是C5和P6等强致病力菌系表现高度感病。浙恢7954的白叶枯病抗性稍好于明恢86和蜀恢527, 对P1、P5、P7、P10、C2~C4、和C7表现出一定的抗性, 但对其余9个菌系表现不同程度的感病。5个多基因聚合恢复系明恢86-G1-G2- Xa23、蜀恢527-G2- Xa23、明浙-G2-G8- Xa23-1 、明浙-G2-G8- Xa23-2和明浙-G1-G2-G8- Xa23分蘖期和孕穗期对多数菌系的病斑长度均在1 cm以内, 表现出较强的抗病性, 表明利用 Xa23基因改良恢复系的白叶枯病抗性效果明显。
| 表3 白叶枯病抗性改良恢复系对我国和菲律宾白叶枯病菌的抗性评价Table 3 Evaluation of resistance of newly bred restorer lines carrying Xa23 gene to seven Chinese strains and ten Philippines races of Xanthomonas oryzaepv. oryzae at early tillering and booting stages |
采用我国致病力强的菌系C5 (GD1358)于孕穗期接种多基因聚合恢复系及其与三系不育系II-32A的杂交种, 5个多基因聚合恢复系及其与II-32A测交种的白叶枯病抗性均显著好于3个受体恢复系对照及其与II-32A杂交种(表4)。表明 Xa23基因不仅在不同恢复系品种背景下抗性表现彻底, 而且在与三系不育系测交种的背景下同样表现出较高水平的抗性。
| 表4 抗性改良恢复系与不育系测交种孕穗期对白叶枯病菌C5菌系的抗性Table 4 Resistance of test-crosses between newly bred restorer lines with Xa23 gene and sterile line to the Chinese virulent strain C5 of Xanthomonas oryzaepv . oryzaeat the booting stage |
在未接种条件下, 5个改良恢复系与原恢复系相比, 单株产量均没有显著差异; 在各产量相关性状中, 多数改良恢复系的穗长缩短, 每穗粒数减少, 千粒重下降, 株高降低, 但结实率有提高的趋势(表5)。改良恢复系与II-32A的测交种, 除II-32A/明浙-G1-G2-G8-Xa23的单株产量达显著差异外, 其余改良恢复系与II-32A的测交种的单株产量与原恢复系与II-32A的测交种的单株产量相仿。测交种的各产量相关性状表现与改良恢复系相似, 表现多数测交种的穗长缩短, 每穗粒数和千粒重下降, 结实度有增有降。在接种白叶枯病菌的条件下, 除改良恢复系明浙-G2-G8-Xa23-1株系的单株产量显著高于双亲明恢86和浙恢7954外, 其余抗性改良系的单株产量与原恢复系均没有显著差异, 各产量相关性状的差异也不明显(表5)。大多数改良恢复系与II-32A测交种的单株产量均显著高于原恢复系与II-32A测交种, 改良恢复系与II-32A测交种的单株产量增加的主要原因在于改良恢复系测交种的结实率和千粒重的增加, 但多数测交种的穗长缩短, 抽穗期提前, 在穗粒数和株高上变化不明显。表明由于改良恢复系的白叶枯病抗性的增强, 改良恢复系与II-32A测交种的千粒重和结实率有提高的趋势, 导致测交种单株产量显著增加。
|
| 表5 改良恢复系及其测交种在接种和未接种条件下产量及农艺性状的表现Table 5 Agronomic performance of newly bred restorer lines with Xa23 gene and their testcrosses under both severe disease (artificial inoculation) and disease free field conditions during 2011 winter season in Hainan |
|
| 续表5 改良恢复系及其测交种在接种和未接种条件下产量及农艺性状的表现Table 5 (Continuous) Agronomic performance of newly bred restorer lines with Xa23 gene and their testcrosses under both severe disease (artificial inoculation) and disease free field conditions during 2011 winter season in Hainan |
抗性基因的精细定位和分子标记辅助选择技术的日益成熟, 为通过标记辅助选择培育多个抗性的基因聚合体成为可能, 已成为水稻分子育种的重要内容。Narayanan等[14]将 Piz-5和 Xa21聚合到IR50中, 同时提高了对白叶枯病和稻瘟病抗病能力。倪大虎等[15,16,17]利用分子标记辅助选择将广谱高抗稻瘟病的 Pi9基因和全生育期高抗白叶枯病的 Xa21或 Xa23基因聚合到优良株系中, 获得了含2个或3个抗性基因的一批优良新株系, 聚合系同时抗白叶枯病和稻瘟病。陈建民等[18]利用常规回交育种结合分子标记辅助选择技术, 将来自C750的抗白叶枯病基因 Xa23 和抗稻瘟病基因 Pi9聚合到感病杂交稻恢复系闽恢3139中, 获得了4个农艺性状与受体亲本恢复系闽恢3139基本相似的 Pi9/ Xa23双基因改良系。梁海福等[19]利用常规回交育种结合分子标记辅助选择技术, 将高抗水稻白叶枯病 Xa4 和 Xa23基因、广谱高抗稻瘟病 Pi9基因聚合到同一株系中, 获得了三基因聚合的纯合株系。王军等[20]以含有抗稻瘟病基因 Pi-ta和 Pi-b的武运粳8号与含有条纹叶枯病抗病基因 Stv-bi的镇稻42杂交配组, 利用分子标记辅助选择技术结合田间多代选育和抗性鉴定, 将3个抗病基因同时转育到高产品种中, 选育出高产、优质、多抗水稻新品系74121。本研究通过2种不同的复交形式将三黄占2号的抗稻瘟病基因 Pi-GD-1(t)、 Pi-GD-2(t)和 GLP8-6(t)和IRBB23的抗白叶枯病基因 Xa23导入到3个中籼骨干恢复系明恢86、蜀恢527和浙恢7954, 并通过不同F1复交聚合, 采用分子标记辅助选择技术结合分离世代严格的表型鉴定筛选, 获得了5个稻瘟病抗性水平与供体三黄占2号相当、白叶枯病抗性水平与供体IRBB23相当的多基因聚合恢复系蜀恢527-G2- Xa23、明恢86-G1-G2- Xa23、明浙-G2-G8- Xa23-1 、明浙-G2-G8- Xa23-2和明浙-G1-G2-G8- Xa23, 其与II-32A配制的杂种白叶枯病抗性水平显著好于原来推广组合, 再次证实了利用分子标记辅助聚合不同抗性基因改良恢复系抗病性的有效性。
从苗期稻瘟病接种结果发现, 5个多基因聚合恢复系对20个稻瘟病菌种的抗性频率变化范围为90%~95%, 均显著强于亲本浙恢7954、蜀恢527, 优于或与明恢86、抗源供体三黄占2号相仿。表明通过导入三黄占2号的抗稻瘟病基因, 可以有效提高受体亲本的抗稻瘟病能力, 并与抗病性较强的亲本蜀恢527、明恢86中的抗性基因产生互作效应, 进一步增强抗病性或获得更持久的抗性。从白叶枯病接种结果来看, 5个多基因聚合恢复系在分蘖期和孕穗期对多数菌系的病斑长度均在1 cm以内, 表现出很强的抗病性, 与供体IRBB23的抗性相当, 表明利用 Xa23基因改良恢复系的白叶枯病抗性效果明显。抗性鉴定结果同时也表明, 采用与 Pi-GD-1(t)的两侧标记RM6208和R8M10、与 Pi-GD-2(t)、 GLP8-6(t)和 Xa23紧密连锁的分子标记RM3855、G8-6ID-1和RM206进行PCR扩增检测抗性基因, 结合白叶枯病分蘖期和孕穗期人工接种鉴定, 可以有效地在复交分离后代中跟踪抗性基因的流向, 从而确保抗性基因在筛选过程中不被丢失。但由于与 Pi-GD-3(t)连锁标记RM179无法在恢复系与抗源供体间检测出多态性, 因而无法确定三黄占2号中的 Pi-GD-3(t)基因是否导入到改良系中。因此, 需要针对 Pi-GD-3(t)进一步开发具有多态性标记。
两个聚合系明浙-G2-G8- Xa23-1和明浙-G2-G8- Xa23-2对白叶枯病的抗性相仿, 但对20个稻瘟病小种的抗谱不同, 前者为90%, 后者为95%。比较发现, 明浙-G2-G8- Xa23-2对强致病小种S10表现抗病, 而双亲明恢86和浙恢7954及抗源三黄占对S10小种均感病, 浙-G2-G8- Xa23-2表现抗病的原因可能是2个恢复系亲本之间或恢复系与抗源之间存在抗性互作位点, 不同亲本抗病位点结合产生的抗性互作效应导致对S10小种表现抗性, 而明浙-G2-G8- Xa23-1则缺少了这种互作效应, 仍表现感病。浙-G2- G8- Xa23-2对S10小种的抗病互作效应还有待深入研究。
在抗性改良过程中, 回交选育可以有效地改善受体品种的个别性状, 但改良品种的综合性状与原品种性状相似, 很难在原有的基础上取得突破。抗性基因聚合育种有两种基本的途径, 一是相同背景的不同抗性基因的聚合, 二是不同背景的不同抗性基因的聚合。前者改良的效果与回交改良相似, 除抗性得到提高外, 其他性状难以被突破。如本研究中获得的同一恢复系背景的2个不同抗病抗性基因聚合系, 明恢86-G1-G2- Xa23和蜀恢527-G2- Xa23, 虽然稻瘟病和白叶枯病抗性强于受体明恢86和蜀恢527, 但改良恢复系本身及其与II-32A的杂种产量与原来的恢复系及杂种对照相比没有显著的改善。而利用不同恢复系背景进行不同抗性基因的聚合, 在利用标记辅助跟踪目标抗性基因的同时, 通过目测在分离世代选择不同恢复系亲本间产生的重组体, 可望实现抗性和产量的同步改良。如在浙恢7954/三黄占2号F1与明恢86/IRBB23 F1的复交后代选育的双抗聚合系明浙-G1-G2-G8- Xa23, 其与II-32A的测交种在不接种和接种条件下, 杂种产量分别比对照组合II优明86和II优7954增产15.1%及14.4%和16.3%, 是一个产量和抗性同步改良的苗头恢复系。进一步将明浙-G1-G2-G8- Xa23与不同不育系进行更广泛的测交, 有望筛选到双抗强优新组合。
进行不同恢复系背景的抗性基因聚合改良, 将涉及多个不同亲本, 故标记辅助选择比双亲本的单交组合要复杂得多。因此, 尽可能多地开发与目标基因紧密连锁的分子标记显得尤为重要, 而且鉴定复交分离群体所用的标记最好是保证供体与其他所有亲本都有多态, 否则会影响标记辅助选择的效率。另外, 要获得不同基因的优良个体, 尤其是要获得聚合不同目标基因且综合农艺性状优良的个体, 就必须扩大分离, 才能确保选育的效果。
必须指出的是, 由于受稻瘟病接种条件的限制, 本研究没有进行改良恢复系与II-32A测交种的稻瘟病抗性评价, 因而对利用三黄占改良杂交稻的稻瘟病抗性还缺少实验数据, 有待今后进一步完善。
选育出5个稻瘟病抗性水平优于或与供体三黄占2号相当、白叶枯病抗性水平与供体IRBB23相当的多基因聚合恢复系蜀恢527-G2- Xa23、明恢86-G1-G2- Xa23、明浙-G2-G8- Xa23-1 、明浙-G2-G8- Xa23-2和明浙-G1-G2-G8- Xa23, 其与II-32A配制的杂种白叶枯病抗性水平显著好于原恢复系配制的推广组合。在不接种的正常条件下, 改良恢复系及其与不育系测交种的单株产量与原恢复系及相应的杂交种相当, 但在接种发病的条件下, 多数改良恢复系与不育系测交种的结实率、千粒重和单株产量显著高于原恢复系与相应不育系的杂交种。表明抗稻瘟病基因 Pi-GD-1(t)、 Pi-GD-2(t)和 GLP8-6(t)和抗白叶枯病基因 Xa23在杂交稻的抗性改良上具有很好的应用价值。
致谢: 感谢广东省农业科学院刘斌研究员提供三黄占2号稻瘟病抗源, 朱小源研究员提供稻瘟病接种抗性评价。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|

