为进一步揭示硝酸还原酶(nitrate reductase, NR)活性的调控机制及其与植株体内硝酸盐含量的关系。本试验在正常供氮(15 mmol L-1 NO3-)和缺氮(7.5 mmol L-1 NO3-)条件下, 以氮高效(H1: 742和H2: Xiangyou 15)和氮低效(L1: 814和L2: H8)油菜基因型为研究材料, 通过NR活性的专性抑制剂处理, 研究NR活性和硝酸盐含量的基因型和氮水平差异。结果表明, NR专性抑制剂处理可以显著降低叶片NR活性, 正常供氮和缺氮条件下分别降低53.0%和57.6%, 但对叶片硝酸盐的含量没有显著影响。正常供氮条件下的NR活性和硝酸盐含量比缺氮条件下分别高46.9%和16.4%。氮高效油菜基因型的硝酸盐含量显著低于氮低效基因型。H2的NR活性(NRAact)显著高于氮低效基因型的本质原因是其主效基因(
This study aims at inspecting the regulation mechanisms of NR activity and its relation to nitrate content in oilseed rape. A sand culture experiment with N treatment at normal (15 mmol L-1 NO3-) and deficiency (7.5 mmol L-1 NO3-) levels and NR activity obligate inhibitor treatment using oilseed rape genotypes with high nitrogen use efficiency (NUE) (H1: 742 and H2: Xiangyou 15) and low NUE (L1: 814 and L2: H8) was conducted to study differences of NR activity and nitrate contents between genotypes and N application levels. The results indicated that, compared with control treatment, inhibitor treatment under N normal and deficiency levels decreased NR activity by 54.1% and 55.9% respectively, but could not influence the nitrate content of leaves. NR activity and nitrate content of N normal level treatment were 46.9% and 16.4% higher than those of N deficiency level. Nitrate content of high NUE genotypes was significantly lower than that of low NUE genotypes. NR activity (NRAact) of H2 was significantly higher than that of low NUE genotype, resulting from that H2 possesses higher relative expression level of major NR gene (
增加氮肥施用量使作物体内硝酸盐含量猛增已成为制约我国叶菜类作物进一步提升品质的主要限制因子之一[1,2]。硝态氮(NO3--N)是植物的主要氮源, 在植物体内可大量累积[3]。硝酸还原酶(nitrate reductase, NR)是硝酸盐在植株体内代谢的限速酶, 极大地调控着植物组织中硝酸盐的含量[4]。因此, 从植物本身出发研究NR活性与植株中硝酸盐含量的关系, 挖掘作物高效利用氮素的潜力是近几年来植物营养研究的热点之一[5,6]。NR是一个硝酸盐的光诱导酶[7], 通常情况下细胞质用于NO3--N还原的同化力在叶片中是比较充足的[8,9]。而NR活性的调节主要通过NR的磷酸化作用[10]。NRAact和NRAmax分别代表有活性的硝酸还原酶的量和硝酸还原酶的总量; 前者指在实验过程中加入大量EDTA来螯合由于研磨释放出来的Mg2+, 从而防止NR提取过程中的磷酸化反应, 而后者指在实验中加入足够的Mg2+使NR蛋白在提取过程中完全磷酸化, 此时所测的NR反映了组织中存在的所有NR蛋白的量[11]。水稻中 OsNial和 OsNia2的基因表达结果表明, OsNial的缺氮反应比 OsNia2快[12], 且NR主效基因为 nia2, 其表达量的多少很大程度上控制着NR还原酶有效活性的高低[9]。此外, NR活性还受外来化合物的抑制, Na2WO4就是一种特异性NR抑制剂。陈龙正等[13]和司江英等[14]研究表明, Na2WO4处理能使小白菜的NR活性和净光合速率显著降低, 是NR活性的特异性抑制剂, 且不影响细胞内NR蛋白含量。由此可见, 国内外对NR活性与硝酸盐含量的关系已有不少研究, 但NR活性基因型和氮水平差异机理研究报道的相对较少[11,15,16]。为进一步深入研究NR活性的调控机理及其与植株体内硝酸盐含量的关系, 本试验通过NR活性的专性抑制剂处理, 研究NR活性和硝酸盐含量的基因型和氮水平差异, 为进一步发掘植物有效利用NO3--N的潜力提供科学依据。
试验材料为作者所在课题组2005—2009年间筛选出来的氮高效油菜基因型(H1: 742; H2: Xiangyou 15)和氮低效油菜基因型(L1: 814; L2: H8)。采用沙培试验, 选用30 cm×30 cm棕色圆塑料钵, 生长基质为珍珠岩沙粒(用水和稀盐酸清洗干净), 用Hoagland完全营养液培养, 每5 d更换一次营养液。2011年9月25日大田育苗, 同年11月2日移栽, 3次重复(每重复2株), 每钵一株, 全生育期统一管理, 以保证植株生长一致。盛花期(2012年3月28日)采样测定。试验设: 正常供氮(15 mmol L-1 NO3-)和缺氮(7.5 mmol L-1 NO3-)处理, 缺氮处理除KNO3 2.5 mmol L-1, Ca(NO3)2·4H2O 2.5 mmol L-1施用量减半外, 其他营养元素用量同正常供氮处理, 减量的K和Ca以K2O和CaCl2的形式补充。
基因型(氮高效和氮低效)、氮水平(正常供氮和缺氮)、抑制剂(对照, 不添加抑制剂, Na2WO4) 3个因素, 共8个处理, 随机区组排列。将0.15 mmol L-1 Na2WO4溶液于上午10时(2012年3月27日, 盛花期)均匀喷洒到选定叶片上(从下往上数第4片叶), 于次日(2012年3月28日)上午10时采样。对照处理则均匀喷洒等量的蒸馏水。
1.2.1 NR活性测定 参照Botrel的离体法[17]。采集从底部往上数的第4片叶, 迅速置液氮, 速冻10 min后放入-20℃冰箱待测。将叶片剪碎取1 g左右, 加5 mL提取缓冲液和少量石英沙于研钵中, 冰浴研磨至匀浆, 将其转移至l0 mL离心管, 以 10 700× g离心20 min, 上清液即为酶粗提液。其中提取缓冲液为5 mmol L-1 EDTA和5 mmol L-1半胱氨酸溶于0.025 mol L-1 pH 8.7的磷酸缓冲液。电子供体为NADH, 其浓度为2 mg mL-1。另取一离心管加入1 mL KNO3、0.6 mL NADH、0.4 mL酶粗提液, 混匀后25℃反应30 min, 立即加入0.5 mL磺胺中和过量的NADH, 终止反应。其后加入0.5 mL α-萘胺, 以17 800× g离心15 min, 分光光度计测定其在 540 nm处的吸光度值。以0.1 mo1 L-1磷酸缓冲液(pH 7.4)代替NADH为对照。同时取0、0.25、0.5、1.0、2.5、5.0和10.0 mg kg-1 NaNO2作标准曲线。根据标准曲线计算出反应液中所产生的NO2--N总量。
1.2.2 NRAact和NRAmax测定 参照Kaiser等[18]和范晓荣[11]的方法。采集从底部往上数的第4片叶, 迅速置液氮, 速冻10 min后放入-20℃冰箱待测。将叶片剪碎取1 g左右, 用液氮研磨后加提取缓冲液。NRAmax提取缓冲液为50 mmol L-1 Hepes-KOH (pH 7.6)磷酸缓冲液溶解于EDTA和半胱氨酸, 使溶液中的EDTA和半胱氨酸的浓度分别为5 mmol L-1和5 mmol L-1; NRAact提取缓冲液为50 mmol L-1 Hepes (肝素钠)-KOH (pH 7.6)磷酸缓冲液溶解于MgCl2和半胱氨酸, 使溶液中的MgCl2和半胱氨酸的浓度分别为10 mmol L-1和5 mmol L-1。电子供体(NADH)浓度为2 mg mL-1。其他反应条件与前面的NR活性的测定一样。
1.2.3 叶片硝酸盐含量的测定 叶片硝酸盐含量的测定[19]采用研磨浸提法制成叶片硝态氮待测液, 用连续流动分析仪测定硝态氮。
1.2.4 叶片NR主效基因表达量的测定(RT-PCR)
叶片NR主效基因表达量的测定(RT-PCR)[9]RNA提取, 取50~100 mg叶片, 于液氮中研磨至粉末状, 置1.5 mL离心管中, 加入1 mL TRIzol充分匀浆, 室温静置5 min。加入0.2 mL氯仿, 剧烈振荡15 s, 静置3 min。4℃ 10 700× g离心10 min, 取上清液。加入0.5 mL异丙醇, 混匀, 冰上静置20~30 min。4℃10 700× g离心10 min, 弃上清液。加入75%乙醇1 mL, 洗涤沉淀。4℃, 7500× g离心5 min, 弃上清液。室温放置晾干或超净台中吹干5 min左右, 加入适量的RNase-free H2O溶解, 电泳检测RNA。按照BBI第一链cDNA合成试剂盒(AMV First Strand cDNA Synthesis Kit)进行反转录。将cDNA样品稀释8倍作为模板上机检测。定量PCR试剂为ABI SybrGreen PCR Master Mix (2X), 使用ABI Stepone plus型荧光定量PCR仪。以Primer 5.0软件设计, 5'-TTCACGACTCAGAAGCCTTACAC-3' (正向引物)和5'-CAGCACCAGAACTTGCCATACT-3' (反向引物)为NR主效基因( nia2)的引物; 5'-GCTA TGCTACATTGCTCTTGACTAC-3' (正向引物)和5'-CTTGTCCATCAGGCATCTCGT-3' (反向引物)为参照基因的引物。
用Microsoft Excel 2003软件绘图, 用SPSS V.13.0软件分析数据, 采用新复极差法进行处理间和油菜基因型间的方差分析。
表1表明, 正常供氮和缺氮条件下抑制剂处理(NRH)的硝酸还原酶(NR)活性显著低于对照处理。正常供氮条件下, NRH处理时氮高效和氮低效油菜基因型NR活性分别比对照处理下降47.4%和58.6%; 缺氮条件下分别下降59.1%和56.1%。H2号氮高效油菜基因型NR活性不管在正常供氮和缺氮条件下都显著高于氮低效油菜基因型, 而H1的NR活性与氮低效基因型间无显著差异。正常供氮条件下的NR活性比缺氮条件高46.9%。
表2表明, 正常供氮和缺氮条件下抑制剂处理(NRH)硝酸盐含量与对照处理没有显著差异。正常供氮条件下, 抑制剂处理时氮高效和氮低效油菜基因型硝酸盐含量分别比对照处理升高4.8%和下降18.6%; 缺氮条件下分别升高7.8%和下降5.7%。正常供氮条件下的硝酸盐含量比缺氮条件高16.4%。
氮高效油菜基因型硝酸盐含量不管在正常供氮和缺氮条件下都显著低于氮低效油菜基因型。正常供氮和缺氮条件下氮高效油菜基因型硝酸盐含量比氮低效油菜基因型分别低48.6%和45.5%。
| 表1 抑制剂处理条件下NR活性的基因型差异和氮水平响应Table 1 NR activity of oilseed rape differing in NUE at N normal and deficiency levels with different inhibitor treatments |
| 表2 抑制剂处理条件下NO3-含量的基因型差异和氮水平响应Table 2 NO3- content of oilseed rape differing in NUE at N normal and deficiency levels with different inhibitor treatments |
图1表明, 正常供氮和缺氮条件下, H2氮高效油菜基因型硝酸还原酶(NR)主效基因( nia2)的相对表达量都高于氮低效基因型, 且正常供氮水平高于缺氮水平(图1-A)。正常供氮和缺氮条件下, NR活性(NRAact)对NR主效基因( nia2)相对表达量的响应度在氮高效和氮低效油菜基因型间都没有显著差异, 且正常供氮水平高于缺氮水平(图1-B)。H2氮高效油菜基因型的NR总量(NRAmax)在正常供氮和缺氮条件下都显著高于氮低效基因型。正常供氮水平的NR总量高于缺氮水平(图1-C)。然而, 两氮水平条件下H2油菜基因型的NRAact/NRAmax比值都低于氮低效油菜基因型。正常供氮水平NRAact/NRAmax比值高于缺氮水平(图1-D)。
在正常供氮和缺氮水平下, H2氮高效油菜基因型NR主效基因( nia2)的相对表达量比氮低效油菜基因型(L1, L2)分别高出39.9%和18.7% (图1-A), NR总量(NRAmax)显著高于氮低效油菜基因型, 分别高出53.7%%和65.0% (图1-C), 而NRAact/NRAmax的比值比氮低效油菜基因型分别低42.0%%和73.4% (图1-D)。
陈龙正等[13]和司江英等[14]的研究表明, Na2WO4处理条件下小白菜NR活性和净光合速率明显降低, Na2WO4是NR的专性抑制剂, 而且不影响NR的总量。因此可以通过NR活性的专性调控, 来进一步研究NR对细胞硝酸盐含量的调控机制。本研究结果表明, 抑制剂处理NR活性都显著低于对照处理, 正常供氮和缺氮条件下分别降低54.1%和55.9%; 而抑制剂和对照处理间硝酸盐的含量没有显著的差异, 硝酸盐含量并没有因为NR活性的显著下降而显著升高, 这是因为一般情况下叶片NR的同化还原能力都远远高于硝酸盐所需的还原能力[8,9], 因此叶片NR活性显著下降的情况下仍有足够的NR参与硝酸盐的代谢反应, 而对硝酸盐的含量没有显著的影响。此外, 与Fan[12]的研究结果一样, 氮高效油菜基因型H2的NR活性高于氮低效基因型, 但这并不是其有更低的硝酸盐含量的原因。从本文的研究结果来看, NR活性的显著变化并不能显著影响硝酸盐的含量。因此硝酸盐含量的基因型差异原因还有待进一步深入研究。
活性NR量(NRAact)和NR总量(NRAmax)有着明显的基因型和氮水平差异[12,20]。本研究结果表明, 正常供氮水平的NRAact和NRAmax都高于缺氮水平的, 与Fan等[12]在水稻中的研究结果一致。但是本研究结果进一步表明, 正常供氮水平的NRAmax高于缺氮水平的主要原因是正常供氮水平NR主效基因( nia2)的相对表达量高于缺氮水平的, 即使在NRAact/NRAmax比值相当的情况下, 由于正常供氮水平下有更高的NRAmax,导致正常供氮水平的NRAact仍然高于缺氮水平的。
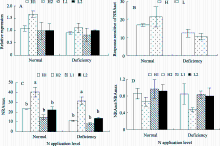 | 图1 NR活性的响应机制A: NR主效基因( nia2)的相对表达量; B: NR活性(μg NO2-g-1FW h-1)对NR主效基因相对表达量的响应度, 计算公式=NR活性(对照处理)/NR主效基因相对表达量, 响应度分别为氮高效和氮低效油菜基因型的平均值; C: 不同氮效率油菜基因型在不同供氮水平条件下NR总量(NRAmax)的差异, 同一氮水平条件下不同字母表示差异显著( P≤0.05); D: 不同氮效率油菜基因型在不同供氮水平条件下活性NR(NRact)占NR总量(MRAmax)的比值, 即NRAact/NRAmax。Fig. 1 Response mechanism of NR activityA: quantification of the expression pattern for nia2 gene (NR major gene) relative to actin was assessed by quantitative RT-PCR. Vertical bars indicate SE ( n=3), the same below; B: response sensitivity of NR activity (NRAact) (μg NO2- g-1FW h-1) to relative expression level of nia2 gene, calculation formula=NR activity/relative expression quantity of nia2 gene, NR activity in control treatment was used in formula, response sensitivity is the average of high and low N use efficiency genotypes respectively; C: differences of NRAmax in control treatment between genotypes at normal and deficiency N application levels, different letters within each genotypes are significantly different at P≤0.05; D: proportions of NRAact/NRAmax in control treatment between genotypes at normal and deficiency N application levels. |
对水稻中NR基因的表达有一定的研究, 但只是比较了水稻中不同NR基因( OsNial和 OsNia2)对不同供氮水平的响应[12,20]。本试验对不同油菜基因型间NR基因相对表达量的差异进行了初步研究, 结果表明, H2氮高效油菜基因型的NRAact高于氮低效基因型的原因是H2基因型有更高的NRAmax, 而不是因为NRAact/NRAmax的比例更高和有更高的NRAact响应度。H2基因型有更高的NRAmax的本质原因是NR主效基因( nia2)的相对表达量高于氮低效基因型。由此可以看出, H2油菜基因型NR活性高于氮低效基因型的本质原因 是其NR主效基因( nia2)的表达量高于氮低效基 因型。
NR专性抑制剂处理可以显著降低叶片NR活性, 但对叶片硝酸盐的含量没有显著影响, 表明一定程度的NR活性变化对植株体内硝酸盐的含量并没有显著的影响。正常供氮条件下的NR活性和硝酸盐含量比缺氮条件下分别高46.9%和16.4%, 氮高效油菜基因型的硝酸盐含量显著低于氮低效基因型, 充分表明NR活性和硝酸盐含量存在明显的基因型和氮水平差异。H2的NR活性(NRAact)显著高于氮低效基因型的本质原因是H2的NR主效基因( nia2)的相对表达量高于氮低效基因型。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|


 mol (g FW)–1 h–1 for at least 5 h. For the control transgenic plant (C1), which had the regulatory serine of NR intact, nitrite excretion was low and halted completely after 1–3 h. Without nitrate in the buffer in which the tissue was immersed, nitrite excretion was also low for S521, although 20–40
mol (g FW)–1 h–1 for at least 5 h. For the control transgenic plant (C1), which had the regulatory serine of NR intact, nitrite excretion was low and halted completely after 1–3 h. Without nitrate in the buffer in which the tissue was immersed, nitrite excretion was also low for S521, although 20–40