以钾高效和钾敏感型大豆品系为试验材料, 设置低钾胁迫试验, 在8个时间段取样提取RNA, 利用Real- time PCR检测
大豆是我国主要的油料作物, 其产量和品质受钾素的影响较大[1]。钾离子参与植物的许多重要生理生化过程, 如维持细胞电荷平衡, 调节各种酶的活性和细胞膨压, 参与蛋白质合成, 影响植物气孔运动、光合作用、促进细胞伸长等[2]。钾离子供应不足时植株表现根系萎缩, 茎部脆弱, 叶片生活力差, 老叶边缘焦灼, 种子果实小而皱缩, 植株矮小, 生长缓慢, 易感染病虫害及冻害等[3,4]。尽管钾素是地壳中含量最多的可供植物吸收利用的矿质元素, 但植物只能以离子形式吸收钾素, 能被植物吸收利用的钾素比例极小。农作物尤其大豆对钾素需要量较大, 作物根际可利用的钾离子浓度却常低于植株需要浓度, 造成植株遭遇低钾环境, 如果钾肥供应不足即严重影响植株正常生长发育, 制约大豆籽粒产量和品质性状。因此, 筛选钾高效大豆新品种或利用基因工程方法改良大豆品种, 提高大豆自身的钾吸收利用能力, 对于提高大豆产量、改进品质以及减少施肥量和保护环境等具有重要作用[5,6]。
相关研究表明, 植物吸收和转运K+主要依靠两种不同机制即钾离子通道和钾离子转运体[7,8,9,10], 针对外界环境钾离子浓度的差异, 植物将选择利用这两种钾吸收 及转运系统。Véry等[11]根据α亚基构型差别将钾离子通道分为shaker、TPK和Kir-like家族。Gierth等[9]、Fu等[12]和Garciadblas等[13]根据结构和功能将钾离子转运体分为K+吸收渗透性酶( KUP/HAK/KT)、K+转运体( Trk/HKT)、K+外流逆向转运( KEA)和阳离子质子交换( CHX)4个家族, 主要调控钾离子吸收、再分配和体内平衡。钾离子转运体对植物钾营养吸收起着重要作用, Xu等[14]验证了由LKS1编码的蛋白激酶CIPK23在低钾条件下使AKT1磷酸化从而调控拟南芥对K+的吸收, 其中 KUP/HAK/KT转运体家族的作用尤为重要[15]。拟南芥 KUP/HAK/KT家族有13个成员[8], 可分为4个群体, 大部分有转运体功能的基因属于群体I和II, 而有关其他群体的研究较少。 AtKUP/HAK/KT12是群体 III中的一员, 在亚细胞水平上定位于叶绿体[16], 只在根毛和叶片中表达[17], 通过调节光合作用和根体积而控制钾离子的吸收[18]。大豆中关于钾转运体的研究报道极少, 目前尚无在分子水平上开展大豆 KUP/HAK/KT家族基因功能研究的报道。本课题组通过高通量测序发现大豆中一个与 AtKUP/HAK/KT12 (At1g60160)同源的基因, 在低钾处理条件下其表达量呈现钾高效大豆品系显著高于钾敏感品系[19], 表明大豆中 KUP/HAK/KT基因可能参与调节低钾胁迫反应。在此基础上, 本研究拟从2个对钾敏感性不同的大豆品系中克隆 GmKT12, 利用生物信息学对其编码蛋白进行相关分析, 利用RT-PCR方法检测其在不 同大豆品系中的表达特性并构建植物表达载体, 为进一步验证其功能和作用机理及培育耐低钾大豆品种奠定 基础。
大豆钾高效品系油06-71和钾敏感型品系衡春04-11由本实验室前期筛选而来[19]。实验用大肠杆菌DH5α、根癌农杆菌GV3101、表达载体pCX-SN等, 均为本实验室保存。反转录酶MLV 购自Promage公司, 限制性内切酶、高保真聚合酶购自MBI公司, Taq酶购自Fermentas公司, T4DNA连接酶购自TaKaRa公司, RNA提取试剂购自Invitrogen公司, DNA凝胶回收和质粒抽提试剂盒购自AXYGEN公司, SYBR Green试剂盒购自天根生物公司。其他试剂均为国产或进口分析纯试剂。寡核苷酸引物由上海英骏生物技术有限公司合成, DNA测序由武汉三博远志公司完成。
选取籽粒饱满无病虫的种子用纸卷法室内发芽, 待2片真叶完全展开时, 去除幼苗子叶并转移到水培盆中进行钾处理培养。参照Wang等[19]水培试验方法, 用改良1/2 Hougland营养液配方, 设置正常(K+浓度为3 mmol L-1)和低钾(K+浓度为0.5 mmol L-1) 2个处理, 3次重复。分别在8个时期(开始处理后的0.5 h、2 h、6 h、12 h、3 d、6 d、9 d和12 d)取样3株, 并将植株分解为地上部和地下部, 分别装入保鲜袋, 以液氮速冻后保存于-80℃冰箱备用。
样品用液氮研磨后, 采用TRIzol一步法提取RNA, 溶解于DECP水中的RNA通过琼脂糖凝胶电泳方法检测后保存于-80℃冰箱中。
以OligdT15作为引物, 按照反转录试剂盒说明书合成cDNA第一链。产物cDNA作为普通PCR及荧光定量PCR的模板, 置-20℃冰箱保存备用。
利用大豆基因组数据库(http://www.soybase.org/)中的 GmKT12基因(Glyma08g39840) CDS序列, 应用软件Primer Premier 5.0设计引物, 对 GmKT12基因设计PCR引物, 命名为正向P-1、反向P-2。大豆 Actin (Glyma04g39380.1)作为内参基因, 按照荧光定量PCR引物设计原则设计引物。将目的基因引物命名为正向RT-1、反向RT-2; 管家基因引物命名为正向Actin-1、反向Actin-2。引物序列为正向P-1: 5-GATGAGGTTCCTATGTGGTCA-3; 反向P-2: 5-TCCCAACTTGGATGATATTGG-3。正向RT-1: 5-CTGTTGATACTACGGCTGAG-3; 反向RT-2: 5-TAG ATGGCAATGCTGATG-3。正向Actin-1: 5-TTTGCTG GTGATGATGCTC-3; 反向Actin-2: 5-ACCTCTTTTTG ACTGGGCT-3。
应用SYBR Green法进行Real-time PCR反应, 每个反应设3次重复。PCR扩增程序为95℃ 15 min; 95℃ 10 s, 60℃ 15 s, 72℃ 20 s, 40个循环。利用2-ΔΔ Ct法分析获得的数据, 反映基因的表达水平。以公式2-ΔΔCt计算目的基因在供试品系中表达水平的差异倍数。2-ΔΔCt表示实验组目的基因的表达相对于对照组的变化倍数, 使用这一方法可以直接得到目的基因相对于管家基因的定量。ΔΔ Ct=实验组( Ct,油06-71- Ct,大豆actin)-对照组( Ct衡春04-11- Ct大豆actin), 式中 Ct值是指每个反应管内的荧光信号达到设定阈 值时所经历的循环数。利用SAS软件对数据进行方差 分析。
使用2个参试品系的cDNA进行PCR扩增, 反应体系(20 µL)含无RNA酶水12.2 µL, 10×buffer (无Mg2+) 2 µL, 25 mmol L-1Mg2+1.2 µL, 2.5 mmol L-1 dNTPs 0.4 µL, 10 µmol L-1正向P-1 1 µL, 10 µmol L-1反向P-2 1 µL, cDNA 2 µL, 5 U µL-1 Taq DNA聚合酶0.2 µL。PCR扩增条件为94℃预变性4 min; 94℃ 30 s, 60℃ 1 min, 72℃ 2.5 min, 共30个循环; 72℃ 10 min, 15℃保温。用1.0%琼脂糖凝胶电泳检测PCR产物, 用DNA胶回收试剂盒回收目的片段备用。
将获得的目的片段胶回收产物, 与pMD18-T载体连接, 反应体系含pMD18-T载体1 µL、胶回收产物 4 µL和SolutionI 5 µL, 16℃金属浴中连接过夜。将连接产物转入大肠杆菌感受态细胞DH5α并将菌液涂布于含有100 µg mL-1氨苄的LB固体培养基上倒置培养12~16 h, 挑取长势均一的菌斑画线并进行PCR检测, 反应体系(20 µL)含无RNA酶水14.2 µL, 10×buffer (无Mg2+) 2 µL, 25 mmol L-1Mg2+ 1.2 µL, 2.5 mmol L-1dNTPs 0.4 µL, 10 µmol.L-1正向P-1 1.0 µL; 10 µmol L-1反向P-2 1.0 µL; 5 U µL-1 Taq DNA聚合酶0.2 µL; 同时用枪头蘸取菌落于体系中吹打。PCR扩增条件为94℃预变性 4 min; 94℃ 30 s, 60℃ 1 min, 72℃ 2.5 min, 共30个循环; 72℃ 10 min, 15℃保温。于37℃扩繁阳性菌落后交武汉三博远志公司测序。利用DNAstar及DNAMAN等软件分析测序结果。
应用ProParam、TMHMM、DNAMAN、DNAstar、PredictProtein、InterPro、WoLFPSORT、MEGA5.0、TargetP、SWISS MODEL等软件测序分析结果正确的 GmKT12基因序列及编码的蛋白质。
提取8个时间段样品的RNA并以琼脂糖凝胶电泳检测, 结果质量较好。以提取的RNA为模板反转录获得cDNA。利用特异引物从2个参试品系中均扩增出 GmKT12目的片段, 如图1显示钾高效及钾敏感品系扩增获得为2406 bp的目的片段。
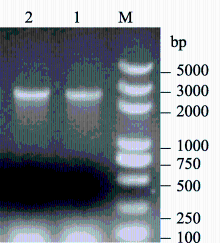 | 图1 GmKT12基因PCR扩增条带1: 从钾高效品系扩增目标片段; 2: 从钾敏感品系扩增目标片段; M: 5000 bp分子量标记。Fig. 1 Cloning of GmKT12 segment1: target fragment amplified from low K tolerant line ; 2: target fragment amplified from low K intolerant line; M: molecular marker 5000 bp. |
应用DNAMAN软件对2个参试品系扩增的 GmKT12基因测序拼接结果作比对, 发现该基因序列在2个品系中有5个单核苷酸发生变异, 即第28、第420、第637、第668和第1607位核苷酸位点存在差异, 序列一致性为99.9%。其中钾高效品系中该基因序列与预测序列有3个碱基差异; 钾敏感品系中该基因序列与预测序列有2个碱基差异。在氨基酸水平上比对结果显示(图2), 5个发生变化的核苷酸位点产生了4个氨基酸差异, 仅420位核苷酸差异未引起氨基酸变化, 序列一致性为99.83%。钾高效品系有3处变化, 即第10位E (谷氨酸)变成Q (谷氨酰胺), 第213位Q (谷氨酰胺)变成R(精氨酸), 第536位E (谷氨酸)变成G (甘氨酸); 钾敏感品系仅在第223位E (谷氨酸)变成D (天冬氨酸)。第213、第223、第536位发生变化的氨基酸均位于该基因的保守结构域内, 而第213和第223位属钾离子转运区。
利用2-ΔΔ Ct法分析目的基因表达差异表明, GmKT12基因表达在油06-71和衡春04-11地下部8个取样时期其差异均达极显著水平, 地上部处理除3 d和9 d外, 其他处理时期该基因表达差异亦达到极显著水平(表1)。值得注意的是, 钾处理前期2个品系表达差异极为突出, 如低钾处理0.5 h后, GmKT12基因在油06-71地上部表达水平是衡春04-11地上部的14.9倍, 同样, 地下部的差异也较高, 达13.4倍; 处理2 h后, 油06-71地上部 GmKT12基因的表达水平是衡春04-11地上部的23.4倍, 地下部的差异为19.0倍。然而, 处理6 h后, 钾高效品系油06-71的 GmKT12表达量迅速下降, 降至钾敏感品系的0.2~0.6倍, 随后则变化不大, 但2个品系间 GmKT12表达量仍差异极显著。试验表明经过短时期低钾处理后, GmKT12基因在钾高效品系油06-71中表达量瞬时增加的幅度极大, 反映大豆植株受到钾离子胁迫时该基因会立即响应以维持植株的正常生长发育。
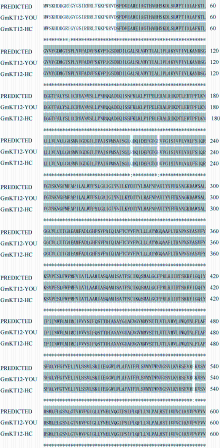 | 图2 GmKT12基因在2个品系及预测氨基酸序列的比对结果PREDICTED: GmKT12预测氨基酸序列; GmKT12-YOU: 钾高效品系扩增 GmKT12的测序结果; GmKT12-HC: 钾敏感品系扩增 GmKT12的测序结果; 灰色阴影表示保守结构域; “:”表示氨基酸差异; “*”表示该处氨基酸完全相同。Fig. 2 Amino acid sequence comparison between predicted and tested GmKT12PREDICTED: predicted amino acid sequences of GmKT12; GmKT12-YOU: sequencing of GmKT12 in the low K tolerant soybean line; GmKT12-HC: sequencing of GmKT12 in the low K intolerant soybean line; conserved domains are shaded by gray blocks; the different amino acid sequences are indicated by “:”; “*” indicates that amino acid sequences are identical. |
2.4.1 蛋白质理化性质的分析 应用ProParam (http://www.expasy.org/tools/protparam.html)软件分析数据库预测 GmKT12序列及两品系扩增 GmKT12序列的编码蛋白理化性质(表2), 结果显示 GmKT12含有801个氨基酸的开放读码框(ORF), 相对分子质量差异较小, 预测序列及钾敏感品系的蛋白质理论等电点、强碱性氨基酸(Arg+Lys)、强酸性氨基酸(Asp+Glu)一致, 而钾高效品系与其均存在一定差异; 3种序列蛋白质不稳定系数均小于40, 表明此蛋白性质稳定, 总平均疏水指数(GRAVY)显示该蛋白亲水性差, 为疏水性蛋白。
2.4.2 蛋白质跨膜区域分析 应用蛋白质跨膜区域预测工具TMHMM (http://www.cbs.dtu.dk/services/TMHMM- 2.0)分析目标蛋白的跨膜结构, 结果显示2个品系的蛋白跨膜结构基本相同(图3)。预测的跨膜螺旋区域有12个, GmKT12的52~528位氨基酸为钾离子转运区, 跨膜螺旋氨基酸期望值远大于18, 说明此蛋白有可能是跨膜蛋白或有一个明显的信号肽; 但始于N-端的60个氨基酸的跨膜螺旋期望值小于10, 说明信号肽不在N-端即为内部信号序列; 钾高效品系的蛋白N-端在细胞质膜一侧的概率是0.92911, 钾敏感品系为0.89961, 拓扑学表明蛋白始于膜内, 跨膜螺旋终止于膜内的第528个氨基酸; 应用PrediceProtein (http://www.predictprotein.org/)预测的跨膜螺旋区域有11个, 预测蛋白同样始于并止于膜内, 拓扑学预测可信度高达9分。同时疏水性氨基酸占总氨基酸个数的43%, 根据跨膜结构及疏水性分析说明该蛋白为跨膜蛋白。
| 表1 GmKT12基因在2个品系不同时期的表达差异Table 1 Expression level of GmKT12 at different periods in two lines |
| 表2 3种序列理化性质Table 2 Physical and chemical properties of three sequences |
 | 图3 用TMHMM分析蛋白跨膜区域Fig. 3 Protein transmembrane region analyzed by TMHMM |
2.4.3 蛋白质二级和三级结构预测和分析 应用软件InterPro (http://www.ebi.ac.uk/interpro/)将目标蛋白在PFAM及TIGRFAMs数据库中比对, 预测其功能为钾离子转运体, 与钾离子的吸收相关。应用软件PredictProtein预测两品系及预测序列编码蛋白的二级结构, 如表3所示, 2个品系及预测 GmKT12基因的编码蛋白质结构均产生了部分差异, 即钾高效比钾敏感品系和预测序列含有稍多的α螺旋, 2个品系的β折叠比预测序列稍少, 钾敏感品系含呈环状氨基酸残基最多, 其次是钾高效品系。3种预测蛋白暴露比例为39%左右, 为易溶蛋白(氨基酸残基暴露在蛋白质表面的超过16%)。蛋白质溶解性是判断蛋白潜在应用价值的重要指标, 预测蛋白有4个低复杂性区域, 佐证了该蛋白为可溶性表达相关蛋白。该蛋白能在体系内迅速扩散, 有利于蛋白质其他功能性质的提高。在关于基序识别和分类中预测此蛋白有3个N-糖基化位点、2个环磷酸腺苷决定的蛋白激酶磷酸化位点、6个蛋白激酶C磷酸化位点、9个酪蛋白激酶II磷酸化位点、7个N-端豆蔻酰基化位点。分析认为该蛋白具有多个磷酸化位点, 对于钾离子的吸收和转运起着重要作用。应用SWISS MODEL (http://swissmodel.expasy.org/)在线软件预测了 GmKT12基因预测序列及2个品系编码蛋白的三级结构, 发现2个品系及预测序列间存在部分细小差别(图4), 表明差异碱基引起的蛋白结构变化可能是造成该基因表达量不同的原因。
2.4.4 蛋白质系统进化分析 应用NCBI对9条来自不同物种的与 GmKT12相似性高的氨基酸序列多重序列比较表明, GmKT12编码蛋白有1个功能为钾离子转运体特有的KUP保守结构域, 6个非特异保守结构域(功能包括钾离子吸收、转运及新陈代谢), 1个多域结构(能跨越多 个结构域的模型)。 GmKT12氨基酸序列与蚕豆钾离子 转运体相似性高达85%, 与拟南芥、葡萄、杨树、蓖麻、芦苇的相似性在74%~78%之间。利用 GmKT12的氨基 酸序列在Phytozome数据库中检索得到64个钾离子转运体家族同源基因, 其中有56个同源基因其相似性在30%以上。
利用MEGA5.0软件对目的基因及56个同源基因和9个其他物种氨基酸序列构建系统发育树(图5), 表明66条序列可分为2大类群, Group I包括24个同源基因及9个不同物种的氨基酸序列, 又分为2组, 其中GmKT12氨基酸属于Group IA, 包括12个同源基因及来自不同物种的9个序列, GmKT12基因及一同源基因和蚕豆聚为一组, 杨树、蓖麻和葡萄与大豆、蚕豆的亲缘关系较近, 而与芦苇的亲缘关系最远; 同源基因与 GmKT12的亲缘关系较物种间的亲缘关系稍远; Group IB中包括12个同源基因。Group II包含33个家族成员, 也可分为2组。
| 表3 3种蛋白的二级结构预测Table 3 Predicted secondary structure of three proteins (%) |
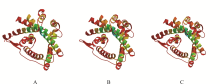 | 图4 三级结构预测图A: 预测序列编码蛋白三级结构; B: 钾敏感品系中克隆的序列编码蛋白三级结构; C: 钾高效品系中克隆的序列编码蛋白三级结构。Fig. 4 Predicted 3D structure of protein encoded by GmKT12A: protein tertiary structure of predicted sequence; B: protein tertiary structure of low K intolerant line; C: protein tertiary structure of low K tolerant line. |
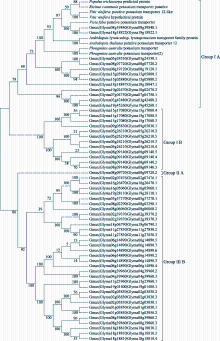 | 图5 Gm KT12系统发育树Fig. 5 Phylogenetic tree of GmKT12 gene |
2.4.5 蛋白质的亚细胞定位 应用PredictProtein、TargetP亚细胞定位及WoLFPSORT等软件预测蛋白质亚细胞定位, PredictProtein软件预测结果定位在细胞核上; WoLFPSORT软件[20]通过比对数据库中蛋白的相似结构, 分析目标蛋白定位于质膜、内质网、细胞骨架或细胞核上; 而TargetP预测该基因在叶绿体表达可能性为0.106, 在线粒体表达可能性为0.157, 在分泌系统表达可能性为0.051, 在其他部位表达的可能性为0.872。3次预测结果基本相符, 表明 GmKT12基因可能在多个部位表达。
植物界有大量的编码 KUP/HAK/KT转运体家族基因, 在植物生长过程中尤其是低钾胁迫适应性反应中起着十分重要的作用[21], 包括获取养分, 调控植物生长等。 KUP/HAK/KT转运体家族中的大部分成员属于Cluster I和Cluster II, 迄今为止仅在拟南芥和水稻中均发现6个Cluster III成员, 而Cluster IV只包含4个水稻基因[22]。 AtKUP/HAK/KT12被归类为Cluster III, 是一组低亲和性的钾离子转运体, 可能与信号转导、植物激素等有重要关系, 有关钾离子转运和维持体内平衡机制尚不清楚。本研究以NCBI比对结果显示 GmKT12基因与 AtKUP/HAK/ KT12基因在DNA水平的相似性高达82%, 同时利用Phytozome数据库分析 GmKT12基因在大豆中钾离子转运体家族成员共有64个, 对相似性在30%以上的同源基因进行系统发育树分析发现57个基因可分为2组, Group I中包含24个基因, GmKT12基因与其他物种的同源序列同属于Group IA。
GmKT12基因编码蛋白是具有稳定蛋白结构的疏水膜蛋白, 其跨膜螺旋区域有11~12个, 疏水性氨基酸348个, 总平均疏水指数(GRAVY)为0.403, 氨基酸序列的疏水性是决定蛋白质结构类型和稳定性的一个最重要的因素。应用软件预测此蛋白有一个信号肽, 虽不在N-末端, 但具信号序列的作用, 称为内含信号序列又称内含信号肽, 可引导新生肽链到达内质网膜, 作为蛋白质共翻译转移的信号被信号识别颗粒(SRP)识别, 也是起始转移信号。 GmKT12基因编码的共翻译转运蛋白质中只有1个内含信号序列即为单次跨膜蛋白。 GmKT12编码的膜蛋白具有多个蛋白磷酸化位点, 蛋白质的磷酸化修饰是生物体内重要的共价修饰方式之一, 是真核细胞中一种最普遍的调控手段。蛋白质磷酸化和去磷酸化是一个可逆过程, 是目前所知最主要的信号转导方式, 是生物体内信号传导过程中的重要环节[23], 调节钾离子和氯离子进出细 胞[24]。 GmKT12编码蛋白的亚细胞定位在细胞核、质膜、内质网或细胞骨架上。Gupta等[16]研究 AtKUP/HAK/KT12基因编码蛋白的亚细胞定位在叶绿体膜上, 可能与光合作用关系较大, 认为OsHAK23与 AtKUP/HAK/KT12基因相似性很高, 但亚细胞定位在质膜上, 表明相似性高的同源基因所起作用不同, 以致亚细胞定位不同, 这种同源基因在不同物种表达部位不同的原因, 可能是不同物种钾转运体基因在进化过程中存在一定的保守性。
本研究通过比对钾高效和钾敏感品系 GmKT12基因序列, 发现有5个核苷酸发生变化, 导致4个氨基酸产生变异, 其中3个氨基酸处于该基因保守结构域内, 2个氨基酸位于钾离子转运区, 进一步分析表明其蛋白质二级和三级结构也随之产生了一些变化, 说明由差异碱基引起蛋白结构的变化, 是导致 GmKT12基因表达量出现显著差异的原因, 也可能是造成不同品系间对钾素吸收利用及转运能力产生差异的原因之一。
Sung等[17]利用RT-PCR数据分析 AtKT/KUP12基因在根和嫩叶中表达差异显著, 认为 AtKT/KUP12基因仅在根毛和叶中表达, 对钾离子的吸收有重要作用。本研究RT-PCR验证结果表明, GmKT12在大豆地上部(茎和叶)和地下部(根)均有表达, 与前人研究结果基本一致, 说明该基因作为钾离子转运体的表达可能对钾离子吸收有较大贡献, 也可能参与光合作用或通过蛋白磷酸化而进行钾离子运输。
本研究在低钾处理大豆植株0.5 h、2.0 h后, GmKT12基因的表达水平表现钾高效品系高于钾敏感品系12.4~22.4倍, 差异极为显著, 随着处理时间的延长, 钾高效品系的 GmKT12基因表达量又迅速下降, 然后保持平稳, 但与钾敏感品系的表达量仍有显著差异。分析认为 GmKT12基因可能在大豆遭受钾离子胁迫后的短时间内促使大豆植株整体对低钾胁迫迅速做出适应性响应, 并在低钾条件下维持一定的表达水平以应对低钾胁迫。可能的响应机制是其编码蛋白在大豆处于低钾状态时于地下部和地上部立即表达, 在根部吸收钾离子的同时可能发挥信号转导作用, 在地上部通过蛋白磷酸化作用将钾离子快速转运至其他部位。当 GmKT12基因编码蛋白无法进一步吸收根际钾离子继而转运至其他部位时, 其表达量开始迅速下降, 但保持一定的水平以应对周围钾离子的变化。
GmKT12基因编码的钾离子转运体是可溶性的疏水蛋白, 具有多个蛋白磷酸化位点, 对植物获取钾离子可能起到关键作用, 有助于钾离子进出细胞。目前在大豆中有关 GmKT12基因的研究极少, 本研究对该基因进行了初步的探究, 但尚需进一步明确其功能及分子机制, 为培育耐低钾大豆品种提供基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|

