植被覆盖率是反映植株生长势的重要生理性状, 在旱作地区尤为重要。图像处理技术能够快速有效地对苗期和孕穗期植被覆盖率进行量化分析。以28份山东小麦主栽品种和品系为材料, 在240株 m-2和360株 m-2密度下, 连续2年测定了孕穗前不同发育阶段的植被覆盖率, 并利用921个DArT标记和83个SSR标记分析了与植被覆盖率相关的遗传区段。结果表明, 不同密度下, 冬小麦植被覆盖率在越冬期、返青期和孕穗期存在显著差异, 而拔节期基本一致。拔节期植被覆盖率与春季最高分蘖数、抽穗后群体叶面积指数、单位面积穗数和籽粒产量均呈显著正相关,
Vegetative vigour is an important physiological trait and selection for greater seedling vigour is a goal of breeding programs, especially in rain-fed regions. This study aimed to identify the genetic variation of early vigour, determine the agronomic traits most closely associated with seedling growth, and detect the major gene-containing region of early vigour in winter wheat. Twenty-eight cultivars and advanced lines at two planting densities (240 plants m-2 and 360 plants m-2) were grown in Jinan during 2009-2010 and 2010-2011 cropping seasons, with randomized complete block design of three replications. Whole-genome association mapping was employed to identify the chromosome region controlling early vigour using 921 Diversity Array Technology (DArT) and 83 SSR markers. Early vigour was evaluated with vegetative ground cover rate via implementation of photographic image analysis, whereby computer analysis was used to determine percentage ground cover. Significant differences of ground cover rate between two planting densities were detected in pre-winter period, greening-up and booting stages, but not in early stem elongation stage. Ground cover rate in stem elongation stage was significantly and positively associated with maximum tiller number (
植株生长势是小麦苗期地上部分生长发育的综合表现, 与品种适应性和产量潜力密切相关。在干旱环境下, 提高植株生长势能够显著增加生物学产量和籽粒产量[1,2], 因而地中海地区和澳大利亚西部等干旱地区一直将提高小麦植株生长势作为重要耐旱指标[3,4], 并选育出一批苗期繁茂且耐旱高产的品种[2]。即便在灌溉地区, 植株生长势也是育种家选择的重要性状, 因此加强该性状的遗传研究, 探索简单易行的测定方法, 发掘相关基因位点对高产广适品种选育具有重要意义。
小麦胚大小、比叶面积(叶片面积与其重量比值)和苗期生物量是决定植株生长势的关键性状[5,6]。Rebetzke等[3,7]认为, 植株生长势相关性状存在较大遗传变异, 主要受基因型影响, 广义遗传力为59%~ 88%。控制水稻苗期生长势的遗传位点主要分布在第1、第3、第6和第7染色体上[8,9,10]。大麦较小麦具有较好的幼苗生长势, 控制大麦苗期生长势相关性状的基因位点主要分布在2H、4H和5H染色体上[11,12,13]。Genc等[14]在盐分胁迫下发现, 4A、5A、5B、5D和6A染色体上携带控制苗期生物量相关性状的重要基因位点。Spielmeyer等[15]在6A染色体上定位了一个控制胚芽鞘长短和幼苗叶片宽度的主效QTL, 分别解释8%和14%的表型变异, 与标记 NW3106 紧密连锁。此外, 矮秆基因 Rht8 对幼苗生长势也有重要影响[16]。尽管在春小麦上已发掘了一些与生长势相关的QTL, 但在冬小麦遗传背景下的相关研究较少。
传统的小麦植株生长势测定主要依靠目测, 不仅需要丰富的育种经验, 而且难以量化不同基因型间的差异[17]。根据植物冠层光谱反射原理研制的野外光谱辐射计(FieldSpec UV/VNIR), 可有效估测幼苗生长特性, 但由于价格昂贵、便携性能差等原因, 在实际育种中应用很少[18,19]。数码相机具有灵敏的色彩传感器, 能够用于测定植株生长特性[20], 具有价格低廉、方便快捷、测定准确等优势, 目前已用于植物的产量估测、叶片衰老鉴定、植物病斑、氮肥营养诊断和植被覆盖[21]等性状测定。在测定小麦植被覆盖率时, 所获取的植株数码图像是地表综合特征的二维表现形式, 可包括生长势相关的胚芽鞘长短、生长速度、比叶面积、分蘖数和干物质积累量等性状[19]。Preussa等[21]认为植被覆盖率可作为鉴定植株生长势的指标, 用于反映苗期和孕穗期的生长特性。
山东省位于黄淮冬麦区北片, 小麦面积和总产皆居全国第2位, 年播种面积约400万公顷, 总产约220亿千克。本研究在墒情适宜、适时播种条件下, 设置两个密度种植, 研究山东当前主要栽培品种及苗头品系的苗期和孕穗期植株生长势, 并利用921个DArT标记和83个SSR标记对植被覆盖率进行关联分析, 旨在估测品种间生长势遗传差异, 发掘控制孕穗以前植株生长势的遗传片段, 为培育高产广适型新品种提供理论依据。
2009—2010和2010—2011连续两年度在山东省农业科学院作物所(山东济南, 36.66°N, 117.07°E)试验农场种植山东省主栽品种和苗头品系28份, 这些材料基本反映了目前山东省小麦品种的现状。试验田土质为黏壤土, 耕层含有机质18.4 g kg-1、全氮1.2 g kg-1、碱解氮135.0 mg kg-1、速效磷(P2O5) 25.6 mg kg-1、速效钾(K2O) 209.0 mg kg-1、pH 8.1。播种前施复合肥750 kg hm-2 (约含氮120 kg hm-2, 磷120 kg hm-2, 钾60 kg hm-2), 拔节期追施尿素225 kg hm-2。
采取随机区组设计, 2个种植密度分别为240株 m-2和360株 m-2, 利用小区播种机(Wtersteiger Plotseed TC, 奥地利), 分别于2009年10月13日和2010年10月16日播种。 3次重复, 小区行距20 cm, 行长4 m, 面积为5.6 m2。于幼苗三叶期间苗, 以保证群体基本苗与计划密度一致, 全生育期浇灌越冬水、拔节水和灌浆水, 并进行田间除草。
在小麦的越冬前期(12月5日)、返青期(3月5日)、拔节期(4月6日)和孕穗期(4月20日), 植株叶片无露水条件下, 利用数码相机(G11, Canon Inc., 日本), 在晴日无风天气的10:00至15:00取像, 相机调至自动拍摄模式, 关闭闪光灯, 镜头距地面高度1.2 m, 垂直于小区的中央, 取像区域排除小区两端20 cm区, 仅拍摄非边行的4行, 数字照片像素为1280 × 960。每次集中在60 min内获取全部实验照片, 避免流动云层阴影对取像的影响, 每取20张照片后, 在天空太阳对角方向获取照片1张, 作为图像空白对照, 用于矫正光线对植株图像影响的偏差。
利用Adobe PhotoShop CS3软件处理图像, 分析植株绿色部分占整个图像的比例。操作步骤如下: (1)调整图像的色相、饱和度和亮度值分别为0、+60和-20; (2)在“色彩范围”选项中使用“加号滴管”工具对图像内所有绿色像素点进行选择; (3)将所选择的绿色像素填充为“白色”, “反向”选项选取剩余的图像部分, 填充为“黑色”(图1); (4)在“分析-选择数据点-custom”选项中选定并分析图像中的“平均灰度值(mean grey value)”; (5)计算植被覆盖面积(vegetative ground cover, VGC), VGC (%)=(平均灰度值/255)×100[19]。
小区间苗后, 在非边行区选取2个长势均匀的1 m样段, 分别在起身期和灌浆中后期测定最大分蘖和穗数。在抽穗期和灌浆期, 于晴日11:00至13:00时, 利用植物冠层分析仪(AccuPAR LP80, Decagon Devices Inc., 美国)测定小区群体叶面积指数。将收获的籽粒自然晾晒至含水量13%以下, 测定千粒重, 称取小区产量, 并折算为公顷产量。
从每份材料选取10个大小和色泽均匀一致的籽粒在培养皿中育苗2周, 混合剪取叶片, 利用CTAB法提取全基因组DNA, 用分光光度计(UAS-99, ACTGene Inc., 美国)检测DNA的浓度和质量, 并将DNA终浓度稀释到50~100 ng µL-1。由澳大利亚Triticarte股份有限公司(http://www.triticarte.com.au/)完成DArT标记分析工作, 在小麦全基因组3000个标记中筛选出921个标记产生限制性多态片段信号, 并按照每条染色体分布3个以上SSR标记的原则, 筛选出83个标记用于测定供试材料的等位变异。
根据DArT和SSR标记在供试材料中的遗传变异分布, 使用STRUCTURE软件分析群体结构, K值取1~20的范围, 每个K值重复估算5次, 采用MCMC (Monte Carlo Markov Chain)模型, burn-in和run length均设置100 000, 估算出Q值为4。以SPAGeDi软件估算供试材料亲缘矩阵(kinship matrix), 并利用Tassel 3.0软件(http://www.maizegenetics.net/)的MLM模型(Mixed Linear Model)进行关联分析, 选择 P<0.05为等位变异与植被覆盖率关联阈值。利用已公布的高密度图谱(http://wheat.pw.usda.gov/ggpages/SSRclub/
GeneticPhysical/; Marone等[31])对所有关联的标记进行染色体定位, 以10 cM内富集3个以上关联标记为标准, 判断为性状关联的遗传区段。
利用SAS (Statistical Analysis System) 9.0软件分析不同发育阶段植被覆盖度的基本统计量, 并进行方差分析和多重比较。用Microsoft Excel 2010软件计算植被覆盖率与最大分蘖数、粒重、叶面积指数、每平方米穗数和籽粒产量的相关系数。
越冬前、返青、拔节和孕穗期4个发育时期的植被覆盖率在基因型、种植密度、环境(年份)和基因型与环境互作等方面差异均达0.01显著水平(表1)。除越冬期外, 返青至孕穗期的植被覆盖率在同年份不同重复间的差异均不显著。越冬、返青和孕穗期的植被覆盖率显著受种植密度影响, 差异达0.01的显著水平。说明苗期和孕穗期植被覆盖率受基因型、环境和基因型与环境互作3个因素的共同作用, 种植密度对植被覆盖率有显著影响, 但拔节期影响较小。
不同基因型间的植被覆盖率在每个发育阶段存在显著差异(表2)。越冬前, 泰山23、潍麦8号、鲁麦23、济宁16、山农15和济宁13等品种植被覆盖率均较大, 为47.5%~54.4%; 泰农2413、烟农24、济麦5037和济麦6324覆盖率较小, 为33.0%~37.9%, 在2个种植密度间品种植被覆盖率变化趋势一致。越冬前植被覆盖率较高或较低的品种, 极大多数在返青期仍保持着较高或较低的覆盖率, 而且两个种植密度间趋势一致。返青后, 伴随着温度快速回升, 小麦苗期生长加剧, 拔节期植被覆盖率迅速达到70%以上, 植被覆盖率较高品种为鲁麦23、临麦4号、济宁13、淄麦12和济南17等, 越冬前和返青期覆盖率较小的品种在拔节期仍较低, 如泰农2413、济麦6324、济麦5037和烟农24等。品种在孕穗期的植被覆盖率与拔节前有明显差异, 其值较高的品种有淄麦12、泰农2413、汶农6号、良星66等, 较低的品种为临麦4号、济麦5504、济南17、临麦2号、泰山23, 在不同种植密度间差异基本一致。综合而言, 品种间植被覆盖率的差异主要受基因型影响, 拔节以前品种间幼苗生长势变化趋势基本一致, 受种植密度影响较小, 越冬前植被覆盖率大的品种到拔节期仍具有较高的覆盖率。但是, 孕穗期品种间植被覆盖率变化趋势与拔节前存在差异, 可能与品种的叶片大小、叶型、株型等综合农艺性状有关。
| 表1 不同发育阶段植被覆盖率的方差分析 Table 1 Mean squares of variance of vegetative ground cover rate at different developmental stages |
| 表2 28个供试品种在不同发育阶段植被覆盖率的比较分析 Table 2 Comparison of vegetative ground cover rate of 28 varieties at different developmental stages |
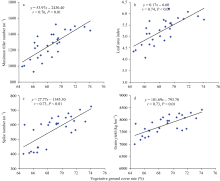
越冬前植被覆盖率与千粒重呈显著正相关( r = 0.50, P< 0.05), 拔节期植被覆盖率与群体最高分蘖数( r = 0.76, P< 0.01)、抽穗后叶面积指数( r = 0.74, P< 0.01)、穗数 m-2 ( r = 0.73, P< 0.01)和籽粒产量( r = 0.73, P< 0.01)均呈极显著正相关(图3), 而返青期和孕穗期的植被覆盖率仅与抽穗后叶面积指数呈显著正相关( r = 0.51~0.73, P< 0.05), 但相关系数低于拔节期的植被覆盖率。说明春季小麦返青后植被覆盖率与群体单位面积光截获能力(叶面积指数)密切相关, 其中拔节期植被覆盖率可作为判断品种叶面积指数、单位面积穗数和产量的指标。
在小麦全基因组上共检测到与植被覆盖率显著( P<0.05)相关的标记46个, 其中8个标记 Xcfa2147 (1A)、 wPt-9154 (3A)、 Xwmc47 (4B)、 Xbarc1 (5A)、 wPt-6674 (6B)和 Xbarc54 (6D)等与多个发育阶段的植被覆盖率相关联。所关联标记与已报道的遗传图谱和基因位点对比表明, 这些标记集中于12个遗传区段, 每个遗传区段包含3~8个标记, 其中10个遗传区段中与已经报道的苗期特征性状、农艺性状、产量性状及抗病位点一致(表3)。位于1AL上 wPt0128 - wPt5316 区段和6AL上 Xgwm169 - wPt-8124 区段携带有与返青期和孕穗期的植被覆盖率关联位点; 2BS上 Xbarc2 - Xbarc7 区段和4BL上 wPt-5265 - Xwmc47 区段存在有控制春季幼苗返青后植被覆盖率的位点; 7BL 上 wPt-2305-wPt6372 区段携带的遗传区段主要控制返青期和孕穗期的植被覆盖率; 7DS上 Xcfd4 - wPt-3462 区段主要与起身前的苗期植被覆盖率相关联。此外, 在2AS、3AL、5AS、6AS、6BL和6DS染色体区段上, 均有孕穗前植被覆盖率显著的位点。所鉴定的植被覆盖率关联区段中, 大部分区段控制孕穗前植株生长发育。可见, 控制植被覆盖率的位点相对单一, 受发育阶段影响较小。
植被覆盖率是植株生长势的综合量化指标[19,21]。通过数码垂直成像和简单图像处理技术能够快速量化植株生长势, 明确品种间遗传差异, 减少田间主观判断造成的偏差。本研究证实, 田间数码取像与Photoshop软件批量处理相结合, 能够快速准确获取小麦孕穗前植株生长势相关数据, 受测定环境影响小, 操作简单, 技术易掌握, 成本低, 耗时少, 每小时可测定300~450个小区, 是鉴定植株生长势的理想方法。此外, 植被覆盖率可以作为判定苗期群体光截获参数, 用于分析品种苗期光能利用效率[19], 拔节期的植被覆盖率可作为判断和预测群体叶面积指数、每平方米穗数和产量的有效指标。
| 表3 苗期和孕穗期不同发育阶段的植被覆盖率的遗传区段分析 Table 3 Analysis of gene-containing region for vegetative ground cover rate in different seedling developmental stages |
籽粒胚乳占粒重的80%, 是贮藏养分的组织, 也是幼苗生长和发育等所需物质及能量的重要来源。籽粒大小主要对幼苗胚芽鞘长度、第2、第3叶片长度和宽度有重要影响, 进而影响幼苗生长势。胚的大小对幼苗生长势有一定影响[2], 通常情况下, 大籽粒品种的胚比重较高, 胚重与粒重相关系数达0.71 ( P<0.01)[32]。Richards和Lukacs[17]发现, 同一品种不同粒重相差10 mg时, 幼苗分蘖数、叶片面积和干物质重分别相差12%、15%和21%。种植密度对幼苗生长势也有显著影响[2]。本研究表明, 越冬前240苗m-2密度下, 潍麦8号和泰山23的覆盖率最大, 分别为52.8%和54.4%; 360苗 m-2密度下, 潍麦8号和泰山23的覆盖率也最大, 分别为63.6%和62.8%。需要说明的是, 潍麦8号属大穗大粒类品种, 千粒重为52.0 g; 而泰山23的千粒重为44.3 g, 属于苗期生长发育快且分蘖多成穗率高的品种, 目测两个品种的胚大小基本相同。由此可见, 影响越冬前植被覆盖率的因素有2个, 一是品种籽粒大, 粒重高, 胚乳养分充足, 幼苗叶片宽大, 进而使植被覆盖率增大; 二是与品种自身特性有关, 如温度较敏感品种在适宜的环境下幼苗生长发育速度较快, 分蘖多, 促使越冬前生长势较旺[21]。
小麦孕穗前植株长势和长相是育种家关注的重要性状之一。本研究表明植被覆盖率显著受基因型、环境和基因型与环境互作影响, 而且年份间差异较大, 可能与不同年份间土壤肥力、墒情及前茬作物有关[7], 也可能与年度积温差异和发育阶段测定时期不严格有关[3,21], 但相同发育阶段植被覆盖率大的品种在同年份间和同种植密度内基本一致。如在返青至拔节期, 植被覆盖率最高的5个品种(系)分别是泰山23、泰山24、鲁麦23、临麦4号和济宁13, 这些品种可用于提高植株生长势的改良。本研究还发现, 受基因型决定的品种生长习性对植被覆盖率有显著影响, 如叶片大小、形态、株型等, 但通过测定植被覆盖率能够反映出品种间生长势和株型的差异。
本研究的材料数目相对较少, 可能导致关联分析误差偏大, 但丰富的标记信息能为发掘植被覆盖率位点提供参考, 并且关联结果以一个遗传区段包括3个以上关联标记为筛选标准, 这样有利于提高性状遗传区段判断的准确性。全基因组水平上共发现12个遗传区段与植被覆盖率存在显著关联, 其中10个区段中与已经报道的苗期性状、产量性状及抗病位点一致(表2)。位于6AS染色体上的一个控制苗期和孕穗期生长势重要遗传区段, 与Spielmeyer等[15]发现的苗期性状位点一致。本研究还发现6B染色体长臂上存在一个控制孕穗前植株生长势相关的重要位点, wPt-3376 附近的8个标记与其关联, Genc等[14]也同样发现 wPt-3376 与苗期生长势性状紧密连锁。5BL上 Xbarc59 附近区段不仅与孕穗前植株生长势关联(表2), 而且参与调控苗期根系性状[25]。此外, 位于1AL、2AS、2BS、3AL、4BS、5AS、6AL、6DS和7BL染色体上携带与孕穗前植株生长势相关联的遗传区段仍待进一步验证。
小麦生长势虽受基因型、环境和基因型与环境互作的共同影响, 但基因型仍是最关键的因素[7], 而且基因间的加性效应占主要作用[3]。已证实单个基因的遗传导入能够在提高苗期生长势上发挥一定的作用[33], 但在杂交群体中存在苗期特性超亲分离现象, 说明生长势相关性状是由多微效基因控制的[21]。因此, 针对生长势相关性状的遗传改良, 应加强对苗期长势和长相优良亲本材料的利用, 聚合微效多基因, 提高苗期生长势, 增强苗期抗逆能力, 进而提高籽粒产量。
小麦苗期植被覆盖率可作为鉴定植株生长势的重要指标用于品种产量改良和遗传研究。拔节期的植被覆盖率能够有效反映叶面积指数和单位面积穗数, 并与籽粒产量显著相关。发现12个与植被覆盖率相关联的遗传区段, 其中有3个区段与已报道的苗期性状位点一致, 另外9个控制植被覆盖率的遗传区段有待验证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|