* 通讯作者(Corresponding author): 孙其信, E-mail:qxsun@cau.edu.cn** 同等贡献(Contributed equally to this work)
WRKY transcription factors are specific in plants and related in response to stress as well as plant development. In this study, we cloned the full-length cDNA of a new WRKY transcription factor gene,
WRKY 基因是植物中特有的一个转录因子家族, 得名于其保守结构域中包含有一个WRKYGQK的序列[1]。早在1994年, Ishiguro等克隆出第一个WRKY蛋白SPF1, 此后在许多生物相继有研究报道。最近研究结果显示, 拟南芥、水稻和玉米分别存在72、107和139个 WRKY 基因[2,3], 说明 WRKY 基因是由多个成员组成的大家族。在小麦中, 迄今仅克隆了58个 WRKY 基因[4,5]。因此, 分离和克隆小麦新的 WRKY 基因, 并鉴定其功能, 将为探讨 WRKY 基因与小麦生长发育的关系奠定重要基础。
研究发现, 植物 WRKY 转录因子基因广泛参与植物对生物及非生物胁迫的响应。在逆境胁迫下, 植物能够感知并传递胁迫信号, 激活下游转录因子, 启动抗逆相关基因的表达, 从而促使植物体内发生一系列的生理生化反应, 抵御不良环境的危害并提高植物的耐逆性。 HvWRKY38 在大麦中参与调控对干旱胁迫的响应[6], AtWRKY8 在拟南芥中则参与盐胁迫调控[7]。另外, 一些 WRKY 基因在植物生长发育过程中起重要作用。 GaWRKY1 在棉花中参与次生代谢物的合成, AtWRKY6 调控叶片衰老及成熟[8,9,10]。由此可见, WRKY 转录因子对于植物胁迫响应及调控生长发育具有重要的作用。
最近, Niu等[4]克隆了43个小麦 WRKY 基因, 并对其中2个基因( TaWRKY2 和 TaWRKY19 )的功能进行了鉴定, 发现 TaWRKY2 和 TaWRKY19 可能参与植物非生物逆境胁迫过程。在本研究中, 我们克隆了一个小麦 WRKY 基因 TaWRKY44 , 在表达模式分析的基础上, 对其功能进行了鉴定, 为深入探讨 TaWRKY44 基因与植物生长发育的关系奠定了基础。
2011年9月在中国农业大学上庄试验站田间种植小麦品种农大3338, 取分蘖盛期的叶片、分蘖节、根系、开花期叶片、衰老期叶片及授粉后12 d的种子提取RNA, 其中全长cDNA克隆材料为分蘖节。在光照培养箱中, 将小麦种子置培养皿滤纸上萌发, 培养条件为26℃(16 h)/20℃(8 h)(昼/夜), 相对湿度75%。至三叶期, 对幼苗进行干旱(20% PEG, 2 h和4 h)、低温(3℃, 30 min和60 min)、高温(40℃, 20 min和40 min)及高盐(10% NaCl, 20 min和40 min)胁迫处理, 并以正常生长幼苗为对照。取各处理叶片提取RNA进行表达分析。
亚细胞定位材料为新鲜洋葱表皮。
采用CTAB法提取农大3338总DNA。用TRIzol (TIANGEN)提取小麦不同组织和不同处理时间点叶片的总RNA。按照TransScript First-Strand cDNA Synthesis SuperMix Kit (TransGen Biotech)操作说明合成cDNA, -20℃保存备用。
按照吴华玲等[5]报道的方法, 以拟南芥和水稻中已报道的 WRKY 基因为搜索序列, 在GenBank数据库中(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源比对搜索, 找出小麦中相关的EST序列后进行电子拼接, 获得包含完整开放阅读框(ORF)的cDNA序列后进行氨基酸序列比对分析, 筛选出未报道的新基因, 然后设计基因特异引物P1-L和P1-R (表1), 再分别以农大3338 DNA和分蘖节cDNA为模板进行PCR扩增, 反应总体积为20 μL, 包括反转录产物2 μL、10 mmol L-1 dNTPs 0.4 μL、20 ng μL-1基因特异引物2 μL、 Taq DNA聚合酶1 U。PCR扩增程序为94℃ 5 min; 94℃ 1 min, 63℃ 1 min, 72℃ 1.5 min, 35个循环; 最后72℃ 5 min。PCR产物采用1%琼脂糖凝胶电泳后, 将目标片段进行回收、克隆和测序。根据RT-PCR产物的测序结果, 设计5′和3′RACE引物(表1), 用5′-Full RACE Kit with TAP试剂盒和3′-Full RACE Core Set with PrimeScript RTase (TaKaRa)进行全长cDNA的克隆。同源进化分析采用ClustalX软件。
取农大3338分蘖盛期的叶片、根、分蘖节、授粉后12 d的种子、苗期、开花期和衰老期的叶片, 提取RNA并反转录。同时取苗期农大3338幼苗进行胁迫处理, 提取RNA并反转录。以 β-actin 为内标基因进行半定量RT-PCR分析, 引物序列见表1。反应总体积为20 μL, 包括反转录产物2 μL、10×buffer 2 μL、10 mmol L-1 dNTPs 0.4 μL、20 ng μL-1基因特异引物(P1-L和P1-R) 2 μL、 Taq DNA聚合酶1 U。PCR扩增程序为94℃, 5 min; 94℃ 1 min, 60℃ 1 min, 72℃ 1.5 min, 25个循环; 最后72℃延伸5 min。设3个生物学重复。
为设计引物构建融合表达载体, 在 WRKY 基因特异引物上游和下游分别引入 Eco R I与 Hin d III的酶切位点(P2-L和P2-R, 表1), 从农大3338分蘖盛期叶片cDNA中扩增出带有以上酶切位点的ORF片段, 将片段从琼脂糖胶回收后连接到T-easy (TaKaRa)载体上, 然后以 Eco R I和 Hin d III对连接载体进行双酶切, 凝胶电泳后回收片段与同样双酶切后线性化的pEGAD载体(由中国农业大学生物学院巩志忠教授提供)连接, 获得绿色荧光蛋白与目的基因的融合蛋白表达载体。
取一块长、宽大约4 cm的洋葱幼嫩表皮, 在固体MS培养基上22℃培养3~4 h。采用PDS-1000/He基因枪(Bio-Rad)轰击洋葱表皮细胞, 可裂膜压力为1100 psi, 轰击距离约为5 cm。轰击的洋葱表皮细胞于22℃培养箱中培养14~16 h, 于激光共聚焦显微镜下(Leica, TCS SP2)观察GFP的表达定位。
在 WRKY 基因特异引物的两端引入酶切位点( Xba I和 Kpn I)(P3-L和P3-R, 表1), 用于构建超表达载体。将扩增得到的片段从凝胶电泳回收后, 与T-easy载体连接, 然后用 Xba I和 Kpn I双酶切, 凝胶电泳后回收片段与同样双酶切后线性化的PCAMBIA Super1300载体(载体由中国农业大学生物学院巩志忠教授提供)相连接, 获得超表达载体。将超表达载体进行农杆菌转化(农杆菌菌株为GV3101, 由中国农业大学生物学院巩志忠教授提供), 得到的阳性菌液采用蘸花法侵染拟南芥野生型植株(种子由中国农业大学生物学院巩志忠教授提供), 收获成熟T0代种子。T0代种子经消毒后, 点播在MS选择培养板上(30 mg L-1潮霉素)。4℃下春化3 d后, 移入光照培养箱中(22℃恒温, 24 h光照, 光强30~40 µmol m-2s-1)。10 d后挑选真叶健康并呈深绿色, 根伸长至培养基中的转化体。将转化体幼苗移入土中(营养土体积∶蛭石体积=1∶1), 至收获T1代种子。经卡方检测, 筛选出符合3∶1分离比例的T1代种子; 种植该T1代种子, 获得T2代纯系种子。
| 表1 本研究所用引物 Table 1 Primers used in this study |
为检测转基因株系中 WRKY 基因插入片段的拷贝数, 剪取3个转基因株系叶片, 提取DNA后进行Southern blot分析, 野生型叶片作为对照。使用 Eco R I和 Kpn I双酶切基因组DNA,在含有TAE缓冲液的0.8% ( W / V )琼脂糖胶中电泳, 将DNA片段转移到尼龙膜上, 用α-32P-dCTP标记的 WRKY 基因PCR扩增片段为探针进行杂交,最后经过放射显影。同时, 提取3个转基因株系和野生型叶片RNA后进行反转录, 用RT-PCR方法检测 WRKY 基因在转基因株系中是否正常表达, 检测引物同 WRKY 基因表达引物。
将转小麦 WRKY 基因的拟南芥T2代幼苗移栽到土中, 生长16 d后取完全展开的第3叶片, 剪成约1 cm2的小段, 煮沸10 min, 倒弃上清液; 转至95%乙醇中, 煮沸约1 h至组织完全脱色; 迅速将已褪色的材料置预先加热至96℃的85%乳酸中, 约8 min后可观察到透明组织; 将已透明的材料转移至室温乳酸中, 取表皮细胞制片, 于倒置显微镜(Olympus, IX71)下拍照。
对拟南芥超表达株系与野生型进行抗逆性分析, 选取在温室中MS培养基上竖直萌发5 d后的幼苗(16 h昼/8 h夜, 22℃, 相对湿度40%), 待根长约2 cm时在无菌条件下移至分别加有甘露醇(400 mmol L-1)、NaCl (100 mmol L-1)和ABA (30 µmol L-1)的MS培养基平板上, 观察转基因植株和野生型在逆境胁迫下的表型差异。
采用电子克隆方法获得含有完整ORF的小麦 WRKY 新基因, 其特异引物扩增产物长度约为900 bp。扩增产物经克隆测序后发现ORF长度为897 bp, 编码298个氨基酸, 将该基因命名为 TaWRKY44 。利用RACE方法克隆了3′和5′非翻译区(UTR)的序列, 长度分别为312 bp和178 bp。将RT-PCR与RACE序列进行拼接获得一条长度为1397 bp的全长cDNA。
氨基酸序列分析表明, TaWRKY44 基因编码的蛋白具有典型的WRKY结构域及C2H2锌指结构(图1-A)。TaWRKY44与水稻OsWRKY13和OsWRKY14及拟南芥AtWRKY65和AtWRKY69归为一个小的类群(图1-B)。基因组序列分析结果显示, TaWRKY44 编码区内仅含有一个内含子, 长度为184 bp。在拟南芥中, WRKY 家族基因的内含子位置高度保守, 可以分为两种类型, 一种是位于编码R的位点, 在密码子AGG中的2个GG之间剪接, 称为R型内含子; 另一种内含子在编码V (缬氨酸)的位点前剪接, V位于锌指结构C2H2的第2个C (半胱氨酸)之后的第6个位点, 称为V型内含子[2]。分析发现, TaWRKY44 的内含子位于氨基酸R的位点, 所以属于R型内含子(图2)。
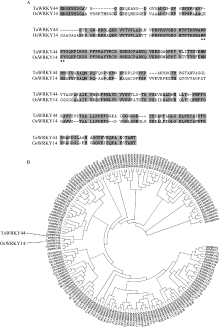 | 图1 TaWRKY44系统进化树A图中, 星号(*)表示WRKY保守氨基酸残基。Fig. 1 Phytogenic tree of TaWRKY44Asterisks in panel A show the conserved amino acid residues. |
该基因在小麦分蘖盛期的叶片中表达较高, 在根和分蘖节中相对偏低, 在授粉后12 d的种子中没有表达(图3-A)。以不同发育时期的叶片为材料研究发现, TaWRKY44 基因在苗期和开花期叶片中表达水平明显低于衰老期叶片(图3-B)。另外, TaWRKY44 在低温胁迫30 min时表达显著上调, 而到60 min时则下调表达(图3-C); 干旱胁迫处理4 h时 TaWRKY44 表达明显上调(图3-D)。但是该基因在高温(40℃)和高盐(10% NaCl)条件下表达模式与对照相比并未发生明显变化。
 | 图 3 TaWRKY44 的组织表达特异性(A)叶片表达模式(B)及低温(C)和干旱胁迫(D)表达响应1: 授粉后12 d的种子; 2: 分蘖盛期的分蘖节; 3: 分蘖盛期的分蘖叶; 4: 分蘖盛期的分蘖根。5: 幼叶; 6: 开花期叶片; 7: 衰老叶片。8: 室温 (30 min); 9: 3 ℃ (30 min); 10: 室温 (60 min); 11: 3 ℃ (60 min)。12: H2O (2 h); 13: 20% PEG (2 h); 14: H2O (4 h); 15: 20%PEG (4 h)。Fig . 3 Tissue-specific expression of TaWRKY44 (A) expression patterns of leaves (B) and low temperature (C) and drought stress (D) expression in response1: seeds of 12 days after pollination; 2: inter-node at tillering stage; 3: leaves at tillering stage; 4: root at tillering stage. 5: young leaves; 6: leaves at flowing stage; 7: aged leaves. 8: room temperature for 30 min; 9: 3 °C for 30 min; 10: room temperature for 60 min; 11: 3 °C for 60 min. 12: H2O for 2 h; 13: 20% PEG treatment for 2 h; 14: H2O for 4 h; 15: 20% PEG for 4 h. |
对 TaWRKY44 基因亚细胞定位融合载体用基因枪轰击法转入洋葱表皮细胞, 用pEGAD表达载体作为对照。经过培养后, 在激光共聚焦显微镜下观察, 显示对照GFP蛋白可以在整个细胞中见到比较均一的明亮的绿色荧光(图4-a, b, c), 而pEGAD- TaWRKY44融合蛋白则位于细胞核中(图4-d, e), 说明TaWRKY44蛋白是核定位的转录因子。
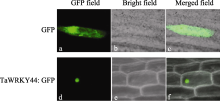 | 图4 TaWRKY44蛋白亚细胞定位GFP: pEGAD载体在洋葱表皮细胞中的瞬时表达在暗场(a)、明场(b)和暗场、明场叠加(c)观察。TaWRKY44:GFP: pEGAD-TaWRKY44融合表达载体在洋葱表皮细胞中的瞬时表达暗场(d)、明场(e)和暗场、明场叠加(f)观察。Fig. 4 Subcellular localization of TaWRKY44 proteinGFP: images of green fluorescence GFP of pEGAD vector in onion epidermal cells under dark-field (a)、bright-field (b) and overlapped field (c). TaWRKY44:GFP: images of green fluorescence GFP of pEGAD-TaWRKY44 vector in onion epidermal cells under dark-field (d)、bright-field (e) and overlapped field (f). |
为分析 TaWRKY44 转录因子基因的功能, 构建了 TaWRKY44 的拟南芥超表达载体, 并获得5个超表达后代纯系。对其中3个( 35S:TaWRKY44-4 、 35S: TaWRKY44-12 和 35S:TaWRKY44-16 )进行Southern blot鉴定, 发现转基因株系都含有一个目的基因拷贝, 说明 TaWRKY44 基因已经整合到拟南芥基因组中(图5-A)。RT-PCR表达分析结果表明, 3个转基因株系中都检测到外源目的基因的表达, 而野生型对照则无相应的扩增产物, 说明 TaWRKY44 在这些转基因植株中正常表达, 并没有发生基因沉默(图5-B)。
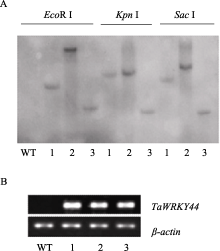 | 图 5 35S:TaWRKY44 转基因株系的Southern blot (A)和RT-PCR (B)Fig . 5 Analysis of 35S:TaWRKY44 transgenic linesWT: wild type; 1: 35S:TaWRKY44-4; 2: 35S:TaWRKY44-12; 3: 35S:TaWRKY44-16. |
与野生型相比, TaWRKY44 超表达拟南芥植株的叶片变小且叶柄缩短(图6)。细胞学观察结果表明, 超表达株系 35S:TaWRKY44-4、35S:TaWRKY44-12 和 35S:TaWRKY44-16 叶片表皮细胞大小分别为1502、1660和1997 µm2, 分别比野生型低49.5%、44.1%和32.8% (图7), 说明超表达株系中的叶片细胞明显变小。
甘露醇、NaCl和ABA逆境处理3 d后, 在添加ABA的MS培养基上, 转基因植株的两片子叶已经完全变白, 真叶也逐渐开始失绿白化, 而野生型植株叶片除子叶颜色开始变白外, 其余的保持正常绿色(图8-B); 在添加甘露醇的MS培养基上, 转基因植株的2片子叶已经完全黄化, 而WT植株的子叶颜色刚开始呈现变黄的趋势(图8-C); 在高盐NaCl处理条件下, 转基因植株顶端生长点处已经出现明显的褐化, 心叶逐渐死亡, 而WT植株还未出现顶端褐化的现象(图8-D)。
WRKY 转录因子是近年来研究较为广泛的植物转录因子基因。在许多植物中克隆了 WRKY 基因, 并对其功能进行了深入研究。近年来, Wu等[5]和Niu等[4]分别在小麦中克隆了15个和43个 WRKY 基因, 并在拟南芥中进行了功能验证。在本研究中, 我们克隆了一个新的小麦 WRKY 基因, 命名为 TaWRKY44 , 其所编码蛋白与水稻OsWRKY14同源性最高。该基因受干旱诱导表达, 并且在衰老的叶片中表达水平升高, 说明该基因可能参与了小麦逆境胁迫响应及叶片衰老过程。
叶片大小是植物形态的一个重要特征, 是由细胞数目和细胞大小相互协调的结果。在模式植物拟南芥中, 一些控制叶片细胞大小的关键基因最近相继被克隆和鉴定出来。例如, AtEXP10 、 ROTUNDIFOLIA 3 (ROT3) 、 ANGUSTIFOLIA(AN) 和 ARGOS- LIKE(ARL) 通过促进细胞的伸长来调节器官发育[11,12,13,14,15,16]。
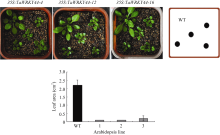 | 图6 35S:TaWRKY44 转基因株系和野生型叶片表型及叶片表面积统计Fig. 6 Leaf area of 35S:TaWRKY44 transgenic lines and WT with their phenotypeWT: wild type; 1: 35S:TaWRKY44-4; 2: 35S:TaWRKY44-12; 3: 35S:TaWRKY44-16. |
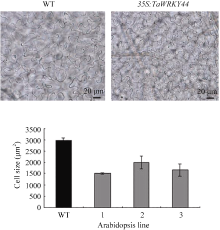 | 图7 35S:TaWRKY44 转基因株系和野生型叶片细胞观察Fig. 7 Leaf epidermis cell size of 35S:TaWRKY44 transgenic lines and WT with microscopic viewWT: wild type; 1: 35S:TaWRKY44-4; 2: 35S:TaWRKY44-12; 3: 35S:TaWRKY44-16. |
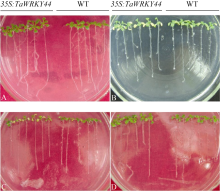 | 图8 35S:TaWRKY44 转基因株系和野生型(WT)胁迫处理后的表型A: MS培养基; B: ABA处理(30 µmol L-1); C: 甘露醇处理(400 mmol L-1); D: NaCl (100 mmol L-1)处理。Fig. 8 Phenotype of 35S:TaWRKY44 transgenic lines and WT under different stressesA: MS medium; B: MS+ABA (30 µmol L-1); C: MS+mennitol (400 mmol L-1); D: MS+NaCl (100 mmol L-1). |
但是, BIGPETALp (BPEp) 和 RPT2a 通过限制细胞的伸长来控制器官生长[17,18,19]。在本研究中, TaWRKY44 基因的拟南芥超表达株系叶片变小及叶柄缩短, 并且细胞也明显小于野生型, 说明该基因主要通过调控细胞大小来影响叶片发育。进一步的研究重点是深入解析该基因调控叶片发育的分子机制, 目前, 我们已建立超表达株系和野生型叶片转录组差异表达谱, 筛选出一些候选下游基因, 正在进行功能鉴定。
同源进化聚类结果显示, TaWRKY44与水稻的OsWRKY13、OsWRKY14及拟南芥的AtWRKY65和AtWRKY69归为一个小的类群。在水稻中, OsW- RKY13 通过调控水杨酸和茉莉酸依赖的防御相关基因提高抗病性[20]。 OsWRKY14 可能在MeOH诱导的Trp及其次生衍生物的生物合成中发挥关键调节作用[21]。迄今为止, 拟南芥的 AtWRKY65 和 AtWRKY69 基因的功能研究尚未见报道。我们发现 TaWRKY44 基因的拟南芥超表达株系叶片明显变小, 并且对ABA、甘露醇以及高盐处理更为敏感。我们推测 TaWRKY44 可能与水稻的同源基因 OsWRKY13 和 OsWRKY14 在功能上存在分化, 但需要进一步的实验证据。
获得了 TaWRKY44 基因, 编码Group II型核定位WRKY转录因子。超表达拟南芥植株表现出叶片变小、叶片细胞变小的现象, 并且对ABA、甘露醇以及盐胁迫处理更为敏感。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|



