盐胁迫是影响作物生长和发育的重要因素之一。一些棉属野生种具有较好的耐盐性, 是开展棉花耐盐性机制研究以及改良陆地棉耐盐性的重要资源。本研究基于cDNA-AFLP技术分离获得的旱地棉(
Salinity stress is one of the most important factors that impede the growth and development of various crops. Some
土壤盐渍化是影响农业生产的一个重要因素, 世界上约有3.33亿公顷土地具有不同程度的盐渍化。我国现有盐渍土面积约34.70×106hm2, 有17.33×106hm2盐碱荒地尚待开发[1]。棉花属中等耐盐作物, 是盐碱地先锋作物。近年来, 随着人口增加、耕地面积减少, 粮棉油安全供给的矛盾日益突出。进一步发掘棉花抗胁迫能力, 将棉花生产向沿海滩涂及内陆盐碱地转移, 对缓解粮棉争地矛盾, 稳定植棉面积, 实现农业生产的可持续发展具有十分重要的意义。
从棉花中克隆耐盐相关基因、开展耐盐机制研究是改良棉花耐盐性的重要基础。植物中与盐胁迫相关的基因主要有以下几类, 即与信号转导途径相关的基因[2,3,4,5,6,7], 与离子转运及离子平衡相关的基 因[8,9], 参与渗透保护物质的生物合成类基因, 主要涉及水分胁迫如水通道蛋白[10], 胚胎发育晚期丰富蛋白(LEA类蛋白)[11,12,13,14]以及抗氧化胁迫如超氧化物歧化酶(SOD)、过氧化氢酶、抗坏血酸、谷胱甘肽合成酶基因等[15,16,17,18,19]。
甜菜碱是植物抗非生物胁迫中一类重要的渗透保护性物质。当遇盐碱或水分胁迫时, 细胞质中积累大量有机渗透调节剂甜菜碱, 而将细胞质中的无机渗透调节剂被挤向液泡, 维持胞质与细胞内液泡渗透平衡, 从而避免了细胞质高浓度无机离子对酶和代谢的毒害。盐胁迫下植物体内甜菜碱的积累是一种有利于植物在胁迫下生长的重要生理现象, 其含量与植物耐盐性呈正相关[20,21,22,23]。研究表明苏氨酸醛缩酶是由苏氨酸至甜菜碱生物合成过程中的关键酶之一。在高等植物中, 苏氨酸醛缩酶普遍存在, 它参与高等植物的氮素代谢过程, 苏氨酸在其作用下, 裂解成甘氨酸和乙醛, 乙醛可氧化成乙酸再生成乙酰辅酶A, 而乙酰辅酶A则参与了脂类的合成。甘氨酸在甘氨酸N-甲基化转移酶的作用下, 经过三步甲基化作用合成甜菜碱, 从而提高植株的抗逆 性[24,25,26]。
目前植物中有关苏氨酸醛缩酶在耐盐机制中作用的研究较少[27], 在棉花中关于该基因的研究尚未见相关报道。在前期的研究中我们利用cDNA-AFLP技术从棉属野生种旱地棉( Gossypium aridum )中克隆了一个苏氨酸醛缩酶基因片段[28], 本研究拟利用电子克隆及RT-PCR技术克隆该基因的ORF全长序列, 分析该基因在盐胁迫下的功能, 为棉花耐盐性的改良提供新的基因资源。
试验材料棉属野生种旱地棉( G. aridum )种子由中国农业科学院棉花研究所海南岛野生棉种植园提供。将旱地棉种子播于盆钵中, 待长至4~5片真叶时将小苗从土中取出, 洗净根部泥土, 水培缓苗3~5 d。然后用含200 mmol L-1 NaCl (其中[Na+]∶[Ca2+]=15∶1)的营养液处理, 分别在处理0、1、3、6、12、24和48 h后, 取叶片以液氮速冻于-70℃保存备用。
拟南芥种子( Arabidopsis thaliana , wild-type, Col-0)由本实验室保存。将消毒灭菌处理的拟南芥种子播于1/2MS (含1.5%的蔗糖)培养基上, 4℃, 黑暗培养2~3 d后转移到培养箱培养(16 h光照/8 h黑暗) 5~7 d。再将一周龄幼苗转移到灭菌基质(草炭土∶蛭石=1∶1)中在22℃/18℃, 16 h光照/8 h黑暗下培养, 待植株长出花蕾时采用浸花法转化[29]。下文所提到拟南芥植物的正常培养都是在22℃光照16 h/18℃黑暗8 h的条件下。
用改良的CTAB法提取旱地棉叶片RNA[30], 采用TRIzol试剂盒提取拟南芥RNA。
以本实验室通过cDNA-AFLP技术获得的一个苏氨酸醛缩酶基因片段(153 bp)为探针[28], 利用电子克隆技术, 在NCBI中用BLAST程序(http://www. ncbi.nlm.nih.gov/genomes/PLANTS/PlantESTBLAST.shtml)对棉属的EST数据库进行Blastn比对, 检索出所有与查询探针高度同源的棉属EST序列(CD486154、DT567433、DN799983、DR463228、DR463773、DW477047、DW477048、DW513781、DW513782、ES828657、CO098604.1、CO090746.1、CO090745.1、FF403743.1、FG357312.1和CO 075985.1), 拼接后, 获得的序列经在线软件预测cDNA全长(http://genes.mit.edu/GENSCAN.html), 然后用在线软件ORF Finder (http://www.ncbi.nlm. nih.gov/gorf/gorf.html)预测完整开放阅读框(ORF)。
在ORF两端设计上游引物GarTHA-F: 5′-GAAA CAATGGTGACCAAAACAGTAG-3′和下游引物GarTHA-R: 5′-GTCTGACTTAGTTCCCATTTTCTT C-3′。以盐处理的旱地棉cDNA为模板采用TransGen Biotech公司的Easy Pfu DNA酶扩增目的基因。反应体系含2.5 U μL-1Easy Pfu DNA聚合酶 0.5 μL、10×Easy Pfu buffer 2.5 μL、2.5 mmol L-1 dNTPs 2.0 μL、模板1.0 μL, 上下游引物各1.0 μL, 加ddH2O至终体积25 μL。扩增程序为94℃ 3 min; 94℃ 30 s, 60℃ 30 s, 72℃ 2 min, 34个循环; 72℃ 10 min, 4℃保存。回收扩增产物并连接到PTG19-T载体上, 转入大肠杆菌, 以菌液PCR筛选阳性克隆, 送上海英骏生物技术有限公司测序。
利用NCBI网站的Blast程序进行数据比对, 利用GENSCAN (http://genes.mit.edu/GENSCAN.html)在线软件进行基因预测, 利用ORF Finder (http: //www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找完整的开放阅读框, 利用DNAMAN软件包与其他植物的THA氨基酸序列进行蛋白序列多重比对, 利用MEGA4.0.2构建系统进化树。利用Plants数据库(http://plantsp.genomics.purdue.edu/html/feature_scan.html)网站在线工具预测蛋白结构。
以半定量RT-PCR技术检测经200 mmol L-1 NaCl处理0、1、3、6、12、24和48 h后旱地棉叶片中 GarTHA 的表达差异, 按照TaKaRa公司的反转录试剂盒说明书进行反转录操作。PCR反应扩增程序为94℃ 3 min; 95℃ 45 s, 55℃ 45 s, 72℃ 1 min, 36个循环; 72℃ 10 min, 4℃保存。以1.2%的琼脂糖凝胶电泳检测。扩增目的基因引物为GarTHA-F和GarTHA-R, 内参选用 Histone3 (约300 bp): 上游引物序列为5′-TCAAGACTGATTTGCGTTTCCA-3′, 下游引物序列为5′-GCGCAAAGGTTGGTGTCT TC-3′。
以pCAMBIA2301 (http://www.cambia.org/)为载体基本骨架,拟南芥逆境胁迫诱导型启动子rd29A表达载体pCAMBIA2301-rd29A-rbc的构建方法见冯娟等[31]。
根据所得到的 GarTHA 的ORF序列设计构建载体所需的目的基因引物, 引物序列为VC-THA-F: 5′-GCTCTAGAGCGAAACAATGGTGACCAAAACAGTAG-3′ (下画线为 Xba I酶切位点); VC-THA-R: 5′-TCCCCCGGGGGAGTCTGACTTAGTTCCCATTTTCTTC-3′ (下画线为 Sma I酶切位点)。以盐处理12 h的旱地棉叶片cDNA为模板扩增 GarTHA 成熟蛋白编码区。将扩增产物回收, 克隆。提取测序正确的菌液的质粒, 进行 Xba I和 Sma I双酶切并回收目的片段, 同时对pCAMBIA2301-rd29A-rbc质粒也进行 Xba I和 Sma I双酶切并回收大片段, 然后将2次回收的片段连接构建植物表达载体pCAMBIA2301- rd29A-GarTHA。所有的效应质粒均经PCR、酶切鉴定正确。用电击法将pCAMBIA2301-rd29A-GarTHA质粒转入农杆菌菌株EHA105感受态细胞中, 获得用于植物转化实验的工程农杆菌。
通过浸花法将含重组质粒pCAMBIA2301- rd29A- GarTHA 的工程农杆菌EHA105转入Col-0野生型拟南芥, 于培养箱中正常培养, 3~4周后收获T0代成熟种子。将T0代种子播种于含100 mg L-1卡那霉素的1/2MS培养基上初筛选, 播种2周后, 将野生型和具有卡那抗性的T1代植株分别转移到基质(泥炭土∶蛭石=1∶1)中单株培养, 然后进行GUS染色和目的基因PCR检测, 得到T1代阳性转化植株, 收获种子。GUS染色过程是: 将新鲜的植物叶片放入GUS染色缓冲液[10 mL体系含0.5 mol L-1磷酸钠缓冲液(pH 7.2) 1 mL、10% Triton X-100 0.2 mL、100 mmol L-1亚铁氰化钾0.2 mL、100 mmol L-1铁氰化钾0.2 mL、100 mmol L-1 X-Gluc 0.2 mL、ddH2O 8.2 mL], 37℃ 2~5 h, 然后用移液器吸净染色液, 室温条件下, 将染色样品依次在20%、35%和50%酒精中分别浸泡30 min脱色处理, 脱色后在室温下用FAA固定液(100 mL体系含38%甲醛5 mL、冰醋酸5 mL、70%酒精90 mL)浸泡30 min, 然后将植物样品放在显微镜下观察。
将阳性T1代转基因植株的种子播于土质基质(蛭石∶泥炭土=1∶1)正常培养, 然后采集叶片进行RT-PCR验证。基于rd29A为逆境胁迫的诱导型启动子, 目的基因的RT-PCR检测在盐胁迫下进行, 具体方法为, 将PCR阳性的T1代种子播于土质基质(蛭石∶泥炭土=1∶1), 3周左右将植株转移到含150 mmol L-1 NaCl的营养液中处理12 h, 采集叶片进行RT-PCR验证。RT-PCR检测所使用的引物为GarTHA-F和GarTHA-R。RT-PCR反应采用TaKaRa的 r-Taq 酶进行扩增, 反应体系按照说明书配制, 扩增程序为94℃ 3 min; 95℃ 45 s, 55℃ 45 s, 72℃ 1 min, 36个循环; 72℃ 10 min, 4℃保存。以1.2%的琼脂糖凝胶电泳检测。
将野生型和转基因拟南芥T2代种子分别播于含0或150 mmol L-1NaCl的1/2MS培养基上, 置光照培养箱正常培养, 3次重复, 每重复50粒种子, 10 d后观察植株表型并记录转基因株系的发芽率, 每重复调查20株苗的根长。采用SPSS软件统计分析。
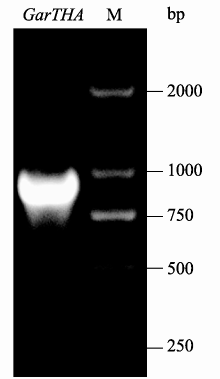
通过cDNA-AFLP和电子克隆方法获得一长为1897 bp的苏氨酸醛缩酶基因的cDNA Contig。利用GENSCAN和ORF Finder软件预测该cDNA全长为1018 bp, 并发现该序列包含一个822 bp的完整ORF。在ORF两端设计引物, 以盐处理旱地棉叶片的cDNA为模板, 进行全长基因的扩增(图1)。通过TA克隆, 测序获得该基因在旱地棉中的cDNA序 列, 测序结果经Blast比对, 证明所扩序列正确, 与电子克隆序列相比, 序列相似度为93.96%。将该基因命名为 GarTHA 并提交GenBank, 获得登录号为KC167360。
旱地棉苏氨酸醛缩酶基因 GarTHA cDNA全长为1018 bp, 包含822 bp的完整ORF, 编码273个氨基酸残基, 蛋白质分子量为82.57 kD, 等电点为4.89。将旱地棉苏氨酸醛缩酶基因编码的氨基酸序列进行BlastP比对(图2), 并构建系统发育树(图3)发现, GarTHA 与拟南芥、杨树、马铃薯和玉米同源基因的氨基酸相似度分别为77.7%、84.6%、83.2%和75.8%。氨基酸序列多重比对结果表明, 旱地棉苏氨酸醛缩酶和其他物种在C端的保守性均较低。
在Plants数据库(http://plantsp.genomics.purdue. edu/html/feature_scan.html)中分析表明, 该基因蛋白包含氨基酸转移酶位点和9个N-肉豆蔻酰化位点, 表明该蛋白可能参与膜上蛋白间的相互作用, 并介导氨基酸的跨膜转运, 其催化作用为催化苏氨酸裂解为甘氨酸和乙醛。NCBI CDS程序分析(图4)显 示 GarTHA 基因蛋白包含5′磷酸结合位点及四聚 物结合位点, 这表明该类基因的表达可能受磷酸化影响。
 | 图3 旱地棉苏氨酸醛缩酶氨基酸序列与其他物种同源序列的进化树分析Fig. 3 Phylogenetic tree of putative GarTHA and other THAs by MEGA4.0.2 program |
为研究 GarTHA 基因在盐胁迫下的表达量变化, 分别提取不同盐处理时期的叶片RNA, 并反转录成cDNA, 进行了半定量RT-PCR检测。结果表明, 随着盐处理时间的增加, GarTHA 的表达量也呈递增的趋势, 24 h达到最大, 48 h后 GarTHA 的表达丰度开始下降(图5)。
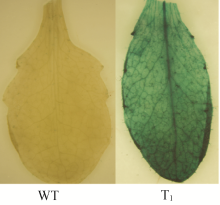
将收获的T0代种子播于含100 mg L-1卡那霉素的1/2MS培养基上, 2周后转基因植株长出真叶并呈绿色, 表型正常, 而非转基因植株生长停留在子叶期, 并且呈黄色, 叶绿素含量较低。分别采集野生型植株和卡那霉素抗性的T1代植株叶片进行GUS染色(图6)和PCR检测。获得GUS染色和PCR检测均为阳性的植株, 说明 GarTHA 基因已成功转入拟南芥基因组中。将T1代阳性转基因植株的种子播于土质基质, 采集叶片进行RT-PCR验证。结果显示 GarTHA 基因在2个株系(T2-1和T2-6)中具有较强的表达(图7)。因此选取这2个株系用于进一步的基因功能研究。
将野生型和2个转基因株系(T2-1和T2-6)的T3代种子分别播于含0, 150 mmol L-1 NaCl 1/2×MS上, 3次重复。10 d后, 野生型拟南芥种子平均萌发率分别为83%和35%, 而转 GarTHA 基因株系T2-1的平均萌发率分别为87%和77%, T2-6平均萌发率分别为91%和88% (图8)。统计分析表明盐胁迫下转基因株系的发芽率显著高于野生型(图9-A)。在不含NaCl的条件下, 野生型、T2-1和T2-6的平均根长分别为24.6、25.8和25.0 mm, 差异不显著。盐胁迫下转基因株系T2-1、T2-6的平均根长分别为7.45 mm和9.90 mm, 而野生型为5.05 mm, 差异达显著水平(图9-B)。且野生型植株出现的盐胁迫伤害和黄化现象较转基因植株明显, 侧根较少, 表明 GarTHA 基因可以增强拟南芥的耐盐性。
苏氨酸醛缩酶在高等植物中普遍存在, 是一类催化苏氨酸转化为甘氨酸和乙醛的酶, 参与高等植物的氮素代谢过程。研究表明植物在逆境下氨基酸的代谢较正常条件下更为活跃, 细胞内可溶性糖和氨基酸等含量明显提高, 并证明苏氨酸醛缩酶在这一过程中发挥了重要作用[32]。甘氨酸可经3次甲基化而合成甜菜碱, 而乙酰辅酶A则参与了多种脂类的合成, 从而提高植物耐逆性[25,33,34,35,36]。Waditee等[25]研究表明在拟南芥中, 除胆碱两步氧化反应可生成耐逆物质甜菜碱外, 由甘氨酸经两种N-端甲基化转移酶的作用, 也可以产生甜菜碱。而甜菜碱是植物抗非生物胁迫中一类重要的渗透保护性物质。研究表明盐胁迫下植物体内甜菜碱的含量迅速上升, 这种积累是一种有利于植物在胁迫下生长的重要生理现象, 其含量与植物耐盐性呈正相关[20,21,22,23]。本研究通过cDNA-AFLP和电子克隆技术从野生种旱地棉中克隆了 GarTHA 基因, 其结构与催化特性表明该基因编码苏氨酸醛缩酶。半定量PCR表明 GarTHA 基因受盐胁迫诱导表达。转 GarTHA 基因拟南芥发芽率和根长测定表明 GarTHA 基因能够提高植株的耐盐能力。另外, 我们利用 GarTHA 基因在拟南芥基因组中的同源基因 AtTHA1 (At1g08630)在ATTED (http://atted.jp/data/locus/At1g08630.shtml)中分析结果也表明该基因与脂类代谢酶类的共表达值最高, 且与逆境转录因子 MYB 家族中的 MYB13 (At1g 06180)基因有关联(数据未显示), 乔孟等[37]研究表明 MYB13 基因受高盐胁迫诱导反应。虽然目前有关 THA 基因在植物中的功能报道不多, 但本研究中对 GarTHA 基因的结构与功能分析均表明该基因编码的蛋白可能参与逆境胁迫下的生理生化反应, 从而提高植物抗逆性。
在植物抗逆基因工程研究中, 大多使用组成型启动子来驱动目的基因的表达, 但Kasuga等[38]报道组成型启动子CaMV35S驱动 DREB 基因在拟南芥中表达, 虽提高了抗逆性, 但植株矮化、生长畸形, 而由诱导型启动子rd29A启动的 DREB 基因在拟南芥中的表达不仅提高了植株的抗逆性, 而且避免了对生长的负面影响。朱丽萍等[39]报道用组成型启动子CaMV35S驱动 BADH 基因在烟草中表达, 转基因烟草的耐盐性提高了, 但生长延迟。Pellegrineschi等[40]用诱导型启动子rd29A驱动 DREBA/CBF3 的表达, 提高了转基因小麦的耐旱性, 而且没有引起明显的畸形。表明组成型启动子在驱动外源基因表达的同时, 对植物的一些生理代谢活动却有抑制作用, 而rd29A启动子由于只在逆境诱导下表达, 对植株生长的影响较小。为了降低外源基因的表达对植株正常生长的影响, 提高该基因在植物耐盐性改良中的应用价值, 我们构建了逆境胁迫特异启动子rd29A的表达载体并将 GarTHA 成熟的蛋白编码区转入拟南芥进行功能验证。研究结果表明, 由rd29A启动的 GarTHA 基因能在盐胁迫下正常表达, 并表现了一定的耐盐功能, 为下一步该基因在棉花耐盐性改良中的应用提供了理论与实践依据。
本试验通过对转基因拟南芥植株的表型观察研究了 GarTHA 在高盐胁迫下的抗逆性, 证明 GarTHA 基因在逆境胁迫下可能参与一系列生理生化反应, 从而提高植物的耐盐抗逆性。而在逆境胁迫下, GarTHA 基因如何参与转基因植株的生理、生化反应以及这些生理、生化特性与抗逆性的关系及该基因所编码的蛋白在旱地棉逆境胁迫信号转导途径中的作用还需进一步研究。
获得了旱地棉苏氨酸醛缩酶基因 GarTHA , 该基因包含一个822 bp完整的开放阅读框, 编码273个氨基酸残基。 GarTHA 基因受盐胁迫诱导表达量迅速上调, 该基因能提高植物的耐盐性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|