拟南芥类受体激酶BAK1 (BRI1-associated kinase 1)在调控生长发育和免疫信号中有十分重要的作用。本研究选择水稻中
Plant receptor-like kinase BAK1 (BRI1-associated kinase 1) plays an important role in Arabidopsis in regulating diverse physiological processes, including development and signals in innate immunity. In this study, we choose a homologous gene LOC_Os03g49620.4 in rice and tentatively name it as
植物通过细胞膜上的受体感知环境变化, 产生相应的信号调控机体生理变化。植物受体与动物生长因子受体类似, 也具有信号识别和转导的功能, 故称之为类受体激酶[1]。植物类受体激酶家族成员众多, 拟南芥和水稻中类受体激酶家族分别含有600和1000多个成员[2]。
BAK1 (也称ELG、RKS10)是其中研究最为深入的类受体激酶之一, 它属于富亮氨酸重复(Leucine- rich repeat, LRR)类受体激酶SERK家族。BAK1胞外是LRR结构域, 包含5个富亮氨酸重复模体, 但第一个并不保守; 其后是一个SPP模体, 由于富含丝氨酸和脯氨酸, 故归为SERK蛋白家族[1]。除此之外, BAK1还有一个单跨膜结构域, 以及胞内丝氨酸、苏氨酸和酪氨酸激酶域以及羧基端尾巴[1]。它是一个多功能的蛋白, 调控植物生长发育、免疫信号和细胞程序性死亡等[3,4,5,6]。
水稻中发现许多 SERK 基因家族成员, 如 OsSERK1-2 及 OsSERKL1-9 。2005年Ito等[7]和Hu等[8]分别在水稻中发现 OsSERK1-2 。Hu等[8]对 OsSERK1 进行RNAi和过表达研究, OsSERK1 受稻瘟病菌或外施水杨酸、茉莉酸诱导表达, 而且参与植物抗病反应并影响愈伤再生能力。2009年Singla等[9]以拟南芥和水稻 SERK 基因家族的氨基酸序列在数据库KOME、NCBI和TIGR中BALST比对, 发现用油菜素内酯(brassinosteroids, BRs)和脱落酸(abscisic acid, ABA)处理 OsSERKL1-9 后, 不同 OsSERKL 基因表达模式不同, 推断它们可能具有不同的功能。Li等[10]研究发现, OsSERK1 与 AtBAK1 高度同源, 因而把它又命名为 OsBAK1 。RNAi干扰研究发现OsBAK1调控水稻多个重要农艺性状, 如株高、叶夹角、粒形[9]。Park等[11]用OsBAK1激酶域构建干扰载体, 转基因植株中 OsSERK1-2 和 ORK1 基因表达量均被干扰, 表现出矮化、不正常发育并感稻瘟病病。
由于水稻中 OsSERKs 基因家族成员众多, 许多成员受到ABA和病原物侵染诱导表达, 但其功能有待证实[9]。许美容对将玉米 Rxo1 基因转入水稻感病植株9804获得的转基因植株9804- Rxo1 接种细菌性条斑病菌, 进行基因表达谱研究, 发现LOC_Os03g49620.4显著上调表达[12]。本实验以LOC_Os03g49620.4 (暂命名为 OsBAK1L )为对象, 分析其结构, 克隆并构建其GFP (green fluorescent protein)载体, 进行亚细胞定位; 以该基因cDNA特异区段构建RNAi载体转化9804- Rxo1 , 并对阳性转基因植株进行抗性鉴定和HR相关基因 OsMPK13 进行表达分析。我们综合实验结果认为, OsBAK1L 可能通过影响 OsMPK13 表达量, 推迟抗病水稻9804- Rxo1 对细菌性条斑病菌的HR反应。
粳稻9804- Rxo1 ( Rxo1 基因转入9804)、根癌农杆菌( Agrobacterium tumefaciens )菌株EHA105、细菌性条斑病菌Rs105均由本实验室保存。大肠杆菌( Escherichia coli )菌株DH5α购于北京博迈德公司。实验质粒载体(图1), 即Gateway中间载体pDONR201和RNAi载体pB7GWIWG2(II)[13], 均购于Invitrogen公司, 绿色荧光蛋白载体pN-GFP, 由中国农业科学院作物科学研究院傅永福研究员惠赠。
质粒提取试剂盒和琼脂糖胶回收试剂盒均购于天根公司。TRIzol购于Invitrogen公司, 反转录试剂盒和DNase I均购于Promega公司。荧光定量PCR试剂和PrimeSTAR DNA Polymerase均购于TaKaRa, Taq DNA聚合酶由本实验室保存。实验中所用引物(表1), 均由北京赛百盛基因技术有限公司合成。培养基均购于北京鼎国生物技术有限责任公司。
根据水稻基因LOC_Os03g49620.4序列, 使用Primer Premier 5.00设计引物OEBF/R。PrimeSTAR PCR扩增获得目的基因编码序列, 共1815 bp。以Gateway技术构建pN-GFP- OsBAK1L 融合载体[14]。
 | 图1 实验载体pDONR201: 中间载体, pB7GWIWG2(II): RNAi表达载体, pN-GFP: 亚细胞定位载体。Fig. 1 Vectors in the studypDONR201: entry vector, pB7GWIWG2(II): RNAi expression vector, pN-GFP: subcellular location vector. |
| 表1 构建载体和表达分析引物 Table 1 Primers for vector construction and expression analysis |
根据NCBI在线BLAST对 OsBAK1L 同源序列分析, 选择其中540 bp的特异核苷酸序列作为RNAi干扰区段。根据特异核苷酸序列设计引物RiBF/R, PrimeSTAR PCR扩增 OsBAK1L 干扰区段, 以Gateway技术构建 OsBAK1L -RNAi载体[14]。
PrimeSTAR PCR反应程序(根据扩增片段大小和引物 Tm值, 相应调整延伸时间和退火温度)为, 95℃ 4 min; 98℃ 10 s, 55℃ 10 s, 72℃ 2 min, 30个循环; 72℃ 10 min。琼脂糖凝胶电泳后切胶回收, 回收产物重组到pDONR201载体并转化大肠杆菌, PCR鉴定并测序验证。用DNAMAN软件比对分析测序结果, 将正确的克隆重组到相应的GFP载体pN-GFP和RNAi载体pB7GWIWG2(II)。
用基因枪介导法将目标基因载体pN-GFP- OsBAK1L 转化至洋葱表皮细胞中, 以不含目的基因的空载体pN-GFP为对照, 用激光共聚焦显微镜观察[15]。
拟南芥 AtSERK1-5 基因家族的氨基酸序列来自http://www.uniprot.org/, 水稻 OsBAK1L 基因的氨基酸序列来自http://www.gramene.org/。利用MEGA 5.0进行多序列比对, 利用BioEdit 7.1.6.0进行序列注释[16]。利用DNAMAN对LOC_Os03g49620基因座上 OsBAKL/ LOC_Os03g49620.4和 OsSERKL8 的氨基酸序列比对。
将pB7GWIWG2(II)- OsBAK1L 热击转化农杆菌EHA105, 农杆菌介导转化9804- Rxo1 的水稻愈伤组织, 以除草剂(50 mg L-1)筛选阳性愈伤组织, 进而再生获得转基因植株[17]。
为验证转基因阳性再生植株。取水稻再生植株叶片, 以CTAB法提取DNA, 水溶解后贮存于-20℃冰箱备用。根据除草剂基因设计引物BarF/R, PCR扩增731 bp的片段。根据载体启动子35S序列和特异干扰片段序列, 分别设计正向和反向引物35S和RiBR, PCR扩增1000 bp的片段, 用于鉴定阳性转基因植株。pB7GWIWG2(II)- OsBAK1L 和9804- Rxo1 的DNA、pB7GWIWG2(II)分别作阳性和阴性对照。1.0%琼脂糖凝胶电泳, 成像观察。
种植转基因苗的同时, 种植9804- Rxo1 和9804, 分别作为阳性和阴性对照。待水稻孕穗期采用针刺法接种, 每株选取3个分蘖每个分蘖选2片生长正常叶接种[18]。在主脉两侧接种6次, 接种点间隔3~5 cm。接种后每天喷雾保湿, 并观察记录表型变化。接种后24、48、72、96和120 h取样, 迅速用液氮冷冻并贮存于-80℃冰箱备用。
根据TRIzol试剂操作手册提取水稻组织的总RNA, DNase I处理后, 取约1~2 μg的总RNA用于cDNA第一链的合成, -20℃保存待表达分析。
以水稻 Actin (Os03g0718100)作为内参, ActinF/ R为引物半定量PCR扩增后, 调整反应体系, 均一化反应浓度。用目的基因特异引物RTBF/R检测转基因植株中 OsBAK1L 基因的表达, 以ActinF/R的PCR扩增产物为对照。用1.0%琼脂糖凝胶电泳, 成像观察。
植物过敏性坏死反应基因 OsMPK13 设计引物RTMPK13F/R, PCR扩增检测引物稳定后用于荧光定量PCR分析, Actin (Os03g0718100)作为内参, ActinF/R为引物荧光定量PCR做为对照。荧光定量PCR参照TaKaRa说明书DRR041A。
Gramene数据库LOC_Os03g49620.4注释为BRASSINOSTEROID INSENSITIVE 1-associated receptor kinase 1 precursor, 因此, 将该基因暂命名为 OsBAK1L 。用引物OEBF/R扩增9804水稻的cDNA片段, 与数据库(http://www.gramene.org/)中LOC_Os03g49620.4的CDS编码序列一致, 共1815 bp (图2)。
根据NCBI在线BLAST对 OsBAK1L 同源序列分析, 选择其中540 bp特异核苷酸序列5'-GGTGA GGAGGTGAAGTGGGAGAGGCGGCGTGGACCTGCGACGACCTGCTTGCTGCCCAGCCTGCGAGGGCAAGCCACTGGTAGGTGCCATACTGGACTGGCTTGCTTGTTAACTGGGTTAGCCAGGGACTCCGGTATTATACTACTATGATCAGTTCGTGTACTTTTTTTCG
CCGGGCAAGTTTCCCCAAGGAACTCTTTTGATGCTGTAATTATAACTGAAGAGTCATGGATCTGCTCAGCGTCCTCCTAATTATAGCATCTCTGCTCCCATTTTCAGCATCTGACCGTCAAGGTGATGCACTATATGATATGAAGCTGAAGCTGAATGCTACTGGTAACCAGCTTTCTGACTGGAACCAAAATCAAGTTAACCCATGCACTTGGAATTCTGTTATTTGTGACAACAACTACAATGTTGTGCAAGTAACATTGGCATCTATGGGATTCACTGGAGTTCTATCACCACGAATTGGAGAGCTTCAGTTTTTGAATGTTTTGTCCTTGCCTGGTAATAAGATTACTGGTGGCATACCTGA GC-3'
作为RNAi干扰区段。用引物Att-RiBF/R扩增 OsBAK1L 干扰区段序列, 共540 bp。以Gateway技术将扩增片段导入pDONR201载体, 经测序验证RNAi干扰区段导入pB7GWIWG2(II)构建RNAi载体(图2)。
用基因枪将pN-GFP- OsBAK1L 载体转化洋葱表皮细胞, 其中pN-GFP空载体作为阴性对照。亚细胞定位显示GFP-OsBAK1L融合蛋白定位在细胞膜(图3)。
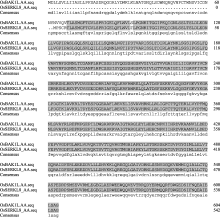
将水稻基因 OsBAK1L 的氨基酸序列与拟南芥 SERK1-5 基因家族成员的氨基酸结构比对发现: 它们结构类似, 都具有信号肽、亮氨酸拉链、LRR结构、跨膜域和膜内RD激酶域, 但OsBAK1L在LRR C-末端结构域上不含有SPP模体(图4)。由于SERK家族成员是以SPP模体作为分类标志, 所以OsBAK1L不属于SERK家族成员。
Singla等[9]发现 OsSERKL1-9 中 OsSERKL8 的基因座位号与 OsBAK1L 相同, 均为LOC_Os03g49620。将 OsSERKL8 和 OsBAK1L 的DNA、cDNA和氨基酸序列比对, 发现两者DNA序列一致, 但cDNA和氨基酸之间均存在差异。两者主要差异是 OsSERKL8 的CDS序列5°端部分序列缺失, 致使OsSERKL8肽链中无信号肽和LRRNT结构域(图5), 两者可能是同一基因位点不同的转录形式。
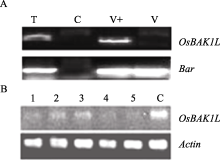
利用农杆菌EHA105转化水稻9804 -Rxo1 的愈伤组织, 经除草剂筛选后获得58个转化体, 其中9个转化体再生转基因苗, PCR检测确认1个阳性转化体共9株。
根据载体启动子35S序列和特异干扰片段序列, 分别设计正向和反向引物35S和RiBR。它们和载体 Bar 基因引物BarF/R分别扩增转基因阳性植株、9804- Rxo1 、pB7GWIWG2(II)- OsBAK1L 质粒和pB7G WIWG2(II)。其中只在阳性植株和pB7 GWIWG2(II)- OsBAK1L 获得35S和RiBR的 1000 bp目的片段。此外, Bar 基因检测结果发现, 只在9804- Rxo1 没有扩增出731 bp的目的片段(图6-A)。
用干扰的目的基因引物RTBF/R和 Actin 引物ActinF/R扩增。RNAi转基因植株与抗病对照相比, OsBAK1L 基因的表达量下降(图6-B)。
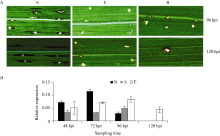
孕穗期接种细菌性条斑病菌后连续2周观察发病情况。抗病品种9804- Rxo1 接种4 d后出现过敏性褐色坏死反应, 第5天病斑更加明显且停止进一步扩展。转基因植株第4天侵染点坏死干枯, 没有水浸状细条形病斑出现, 也没有像抗病品种9804- Rxo1 那样出现明显褐色HR反应。接种第5天出现明显过敏性褐色HR反应, 与抗病品种第4天HR反应病斑表型类似。感病品种9804第4天出现明显水浸状细条形病斑, 第5天感病品种细条形病斑扩展(图7-A)。
Song等[19]发现 OsMPK13 / OsBIMK2 调控植物过敏性坏死反应, OsMPK13 过表达植株表现严重的细胞坏死反应, 而 OsMPK13 抑制表达植株细胞坏死反应减弱。因此, 本研究选择植物类受体激酶下游的基因 OsMPK13 进行实时定量RT-PCR分析, 感病植物中 OsMPK13 表达量几乎没有变化, 而且处于较低水平。转基因植株与抗病对照9804- Rxo1 相比, OsMPK13 表达变化与抗病表型变化趋势一致, 但是同一时间点转基因植株 OsMPK13 表达量比抗病对照低(图7-B)。
结构分析表明OsBAK1L不含SPP模体, 故不属于SERK家族, 但OsBAK1L结构与AtSERK家族成员类似。此外, OsBAK1L 和 OsSERKL8 的DNA序列一致, 蛋白结构存在外显子组合差异, 它们是LOC_Os03g49620不同转录形式。另外, 亚细胞定位表明, OsBAK1L定位在细胞膜上, 与SERKL家族成员定位一致。综上所述, OsBAK1L属于OsSERKL家族。
序列比对结果也表明OsBAK1L和OsSERKL8主要在5°端区段存在差异。本研究 OsBAK1L 选择特异区段5° UTR的227 bp序列和CDS的5°端313 bp序列为RNAi片段。转基因材料中 OsBAK1L 表达下调。表型鉴定结果和表达结果变化趋势一致, 说明 OsBAK1L 调控9804- Rxo1 抗细菌性条斑病菌的细胞坏死。
研究发现 OsMPK13 参与调控植物抗病过程中HR反应[19]。本研究发现接种细菌性条斑病菌后, 感病品种 OsMPK13 的表达几乎没有变化; 转基因植株中 OsMPK13 与抗病对照的表达变化趋势类似, 但表达时间推迟, 表达量下调。另外, 转基因植物和抗病对照表型一致, 都对侵染产生HR反应, 接种细菌性条斑病菌后, 转基因植株中 OsBAK1L 基因表达受到抑制。转基因材料中OsBAK1L蛋白可能是逐渐表达积累, 它对下游 OsMPK13 表达调控作用要比抗病材料慢, 影响 OsMPK13 基因的表达量, HR反应也因此推迟。
本实验中9804- Rxo1 接种细菌性条斑病菌后, 侵染点表现HR反应。HR反应一方面可能由OsBAK1L直接影响 OsMPK13 表达, 另一方面由于RXO1间接影响 OsMPK13 表达。转基因植株的RNAi抑制程度一致, 如果 OsMPK13 的表达受到OsBAK1L调控的话, 它在96 h后的表达水平应该都比抗病材料的低, 但是事实上它一直处在较高的表达水平。由于抗病HR反应往往通过R蛋白抗病反应, 转基因材料中 OsBAK1L 基因的敲除很可能有助于RXO1的功能稳定, 而OsMPK13处于这一途径的下游, 从而能较长时间地维持较高水平的表达。因此, OsBAK1L可能通过影响RXO1对OsMPK13表达调控, 进而影响HR反应。
水稻类受体激酶基因 OsBAK1L 定位于细胞膜, 属于SERKL家族成员。 OsBAK1L- RNAi转基因水稻中 OsBAK1L 下调表达, 接种细菌性条斑病菌后HR推迟。此外, HR相关基因 OsMPK13 表达模式与HR变化趋势一致, 在转基因苗中也出现推迟现象, 表明 OsBAK1L 可能通过调节 OsMPK13 表达而调控9804- Rxo1 对细菌性条斑病菌的HR反应。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|