以转
2-Cys Peroxiredoxins (
逆境下植物光合电子传递链中会积累过多的电子, 如不及时清除会攻击单价氧分子而在叶绿体类囊体膜内生成超氧阴离子[1]。高等植物叶绿体基质和内腔中的SOD可清除超氧阴离子形成H2O2和O2[2,3], H2O2能损坏细胞中的DNA、蛋白质、碳水化合物和脂类等[4], 又能通过金属催化的Haber-Weiss反应生成高度活泼、破坏极强的羟基自由基(•OH)[5], •OH会破坏放氧复合体(OEC)的构成亚基并且妨碍其周转而降低PSII的功能[6]。总之, 植物叶绿体内的ROS是由光合电子传递链上的电子过剩引起的, 而ROS反过来会通过攻击电子传递体而阻碍光合电子的正常传递, 抑制植物光合作用的正常进行[7], 因此, 清除叶绿体内的活性氧特别是H2O2是保护逆境下植物光合作用的基础。
高等植物叶绿体中并不存在清除H2O2的过氧化氢酶(CAT), 而是由抗坏血酸过氧化物酶(APX)承担清除H2O2的作用[8,9]。但是, APX对极端逆境下产生的过量ROS相当敏感[10], 易钝化[11], 利用APX突变体证实, 严重氧化胁迫会明显降低以抗坏血酸介导的APX活性[12]。Peroxiredoxins ( Prxs )是广泛存在于各种生物体内的一类抗氧化酶系[13], 在清除H2O2方面的研究备受关注, 而且在 Salmonella typhimurium 和 E. coli 中克隆了 Prxs 基因。Baier等[14]在植物中发现了Prxs[15], 它具有分子伴侣的功能。高等植物Prxs家族含有 1-Cys Prx 、 2-Cys Prx 、 Prx II 和 Prx Q 4个成员, 其中只有 2-Cys Prx 位于叶绿体的类囊体膜上[16], 因其52位和172位上分别有一个高度保守的半胱氨酸残基(-Cys)而被命名为 2-Cys Prx[17]。
在松嫩平原盐碱土地区, 植物经常受到盐和高光的共同威胁, 叶绿体内的ROS特别是H2O2不但会造成其膜质过氧化产物丙二醛(MDA)的积累[18], 还会攻击D1蛋白上的His残基而抑制光合电子传递链上的电子传递、降低PSII反应中心的活性、抑制植物的光合作用等[19]。因此, 2-Cys Prx 具有清除叶绿体内ROS的能力, 在盐和高光逆境下就可能具有保护植物叶绿体PSII的作用。为证明该作用, 本试验以转 2-Cys Prx 基因烟草( Nicotiana tabacum ) (品种为龙江911)为材料, 研究了盐和高光强对叶片活性氧代谢和光合PSII功能的影响及 2-Cys Prx 在植物光破坏防御机制中的作用。
转 2-Cys Prx 基因的烟草幼苗(TCPrx), 以非转基因幼苗为对照(CK)。转 2-Cys Prx 基因植株通过PCR进行阳性植株筛选(图1), 证明外源 2-Cys Prx 基因已经整合到烟草的染色体中。选择PCR结果带型清晰明亮的阳性植株放在生根培养基上培养, 培养条件为温度25/23℃(光/暗)、光照强度200 μmol m-2 s-1、光周期12 h /12 h(光/暗)、相对湿度75%左右, 待植株生根后, 洗净根系表面的培养基, 放入1/2 Hoagland溶液中水培, 在光照200 μmol m-2 s-1, 室温25~30℃的室内培养20 d。
2012年8月10日将长势相对一致的转基因 和CK幼苗分别放入NaCl浓度为50、100、150和200 mmol L-1的溶液中盐激处理, 每处理6次重复, 分为2组, 每组3次重复。其中一组幼苗放在光照强度为200 μmol m-2 s-1, 光源为微波硫灯(白光, 沈阳市永峰灯具厂)室内培养, 另外一组放在光照强度为1000 μmol m-2 s-1, 光源为LED照明灯(红蓝混合光, 深圳联邦重科电子科技有限公司)室内培养, 由于微波硫灯为热光源, 而LED照明灯为冷光源, 因此为消除光源引起的温度不同, 试验材料放置在距离光源1 m处, 2种光源的光周期均设定为12 h / 12 h (光/暗), 培养48 h后, 对照组在高盐强光下出现盐害症状后, 测定叶绿素荧光参数和H2O2以及MDA含量。
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定, 以单位时间内(1 h) 1 mL反应液中抑NBT光化还原50%酶量为一个酶活力单位(U), 则鲜样的酶活性为U g-1 [20]; 抗坏血酸过氧化物酶(APX)活性采用沈文飚等[21]的方法测定, 酶活力单位(U)定义为1 min催化1 μmol抗坏血酸氧化的酶量, 则鲜样的酶活性为U g-1; H2O2含量采用林植芳等[22]的方法测定; MDA含量采用王晶英等[23]方法测定。
于9:00至11:00采用便携式脉冲调制荧光仪FMS-2 (Hansatch公司, 英国)参照Hu等[24]方法选择经不同光照强度光照后的幼苗, 测定倒数第2片完全展开叶片的实际光化学效率( ϕPSII)和电子传递速率( ETR ); 然后将各处理烟草幼苗叶片暗适应0.5 h后测定其初始荧光( Fo)、最大荧光( Fm)和PSII最大光化学效率( Fv/ Fm), 利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100max, 捷克)测定各处理叶片的OJIP曲线, 得到OJIP曲线上J点的相对可变荧光强度( VJ)、QA被还原的最大速率( Mo)等。测定部位为从叶基部数第3与第4叶脉之间, 距离主叶脉2 cm左右处, 每次测定重复5次。
图中数据为5次重复的平均值±标准差(SE), 运用Microsoft Excel和DPS软件统计分析数据, 并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
由图2可以看出, 随着盐浓度的增加, 转基因烟草和CK叶片的SOD活性均明显增加, 1000 μmol m-2 s-1的光强下比200 μmol m-2 s-1光强下叶片的SOD活性明显高, 但转基因烟草叶片的SOD活性与CK之间均无明显差异。随着盐浓度的增加, 200 μmol m-2 s-1光强下幼苗叶片的APX活性呈先增加后降低的趋势, 但其变化幅度较小, 并且2种烟草间差异也不明显, 而在1000 μmol m-2 s-1光强下, 幼苗叶片的APX活性却随着盐浓度的增加而呈明显的降低趋势, 当盐浓度增加到100 mmol L-1时, 2种烟草幼苗叶片的APX活性均较无盐胁迫时降低了50%左右。
图3显示, 不同光强下2种烟草幼苗叶片中的H2O2和MDA含量随着盐浓度的增加而增加。在1000 μmol m-2 s-1光强下, CK叶片中的H2O2和MDA含量明显高于转基因烟草, 但在200 μmol m-2 s-1光强下, 2种烟草间却无明显差异, 甚至1000 μmol m-2 s-1光强下转基因烟草叶片中的H2O2和MDA含量与光强200 μmol m-2 s-1下相差不大。
 | 图2 不同光强下转基因烟草叶片SOD和APX活性对盐胁迫的响应Fig. 2 Responses of SOD and APX activities in transgenic tobacco leaves to salt stress under different light intensities |
由图4可以看出, 随着盐浓度的升高, 不同光强下转基因烟草和CK叶片的 ϕPSII均明显下降。1000 μmol m-2 s-1光强下, 2种烟草幼苗叶片的 ETR 明显降低, 但200 μmol m-2 s-1光强下, 2种烟草幼苗叶片的 ETR 均维持在60左右, 不同盐浓度下无明显变化。TCPrx和CK比较, 200 μmol m-2 s-1光强下, 幼苗叶片的 ϕPSII和 ETR 之间均无明显差异; 1000 μmol m-2 s-1光强下, NaCl浓度低于50 mmol L-1时, 转基因烟草叶片的 ϕPSII和 ETR 虽均高于CK, 但差异不明显, 当NaCl浓度增加到100和200 mmol L-1时, 转基因烟草叶片的 ϕPSII和 ETR 均明显高于CK。
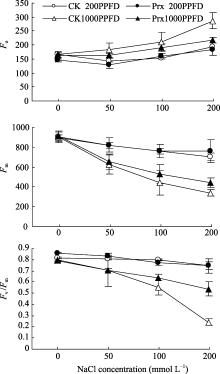
图5显示, 随着盐浓度的增加, 不同光强下的2种烟草幼苗叶片的 Fo增加, 而 Fm和 Fv /Fm则明显降低。200 μmol m-2 s-1光强下烟草幼苗叶片的 Fo、 Fm和 Fv /Fm的变化幅度明显小于光强1000 μmol m-2 s-1时。另外, 200 μmol m-2 s-1光强下, 转基因烟草叶片的 Fo、 Fm和 Fv /Fm在盐胁迫下与CK无明显差异, 但1000 μmol m-2 s-1光强下, 当盐浓度增加到200 mmol L-1时, 转基因烟草叶片的 Fo低于CK 24.39%, 而 Fm和 Fv /Fm分别高于CK 29.93%和124.35%。
 | 图4 不同光强下转基因烟草叶片 ϕPSII和 ETR 对盐胁迫的响应Fig. 4 Responses of ϕPSII and ETR in transgenic tobacco leaves to salt stress under different light intensities |
图6显示, 不同光照强度下烟草叶片的 VJ和 Mo表现相同的变化趋势, 并随着盐浓度的增加明显增加, 但是, 在1000 μmol m-2 s-1光强下的变化幅度明显大于光强200 μmol m-2 s-1时。在200 μmol m-2 s-1光强下, 不同盐浓度处理对2种烟草幼苗叶片的 VJ和 Mo影响不大。1000 μmol m-2 s-1光强下, 不同盐浓度下转基因烟草叶片的 VJ和 Mo均低于CK, 并且随着盐浓度的增加, 二者之间的差异加大。
植物细胞中的H2O2是水裂解放氧过程的中间产物, 当水裂解复合体的功能受到抑制时, H2O2大量生成, 而水裂解复合体的功能正常时, 大部分H2O2都是来源于超氧物歧化酶(SOD)的歧化作用[25]。叶绿体中的H2O2通过Haber-Weiss反应产生的羟自由基(•OH)会引起叶绿体的膜脂过氧化, 造成叶绿体膜脂过氧化产物MDA的增加[26]。因此, 清除叶绿体内H2O2对减轻逆境下植物氧化胁迫具有重要的作用。本试验中, 随着盐浓度的升高, 高光强(1000 μmol m-2 s-1)下, 细胞中SOD活性增强(图2), 歧化超氧物阴离子形成H2O2含量增加, 此时, 用于清除H2O2的APX活性却显著降低(图2), 过量H2O2导致了烟草叶片膜质过氧化产物MDA增加, 细胞受到了严重的氧化胁迫。姜波等[27]研究结果发现, 增强 2-Cys Prx 基因的表达, 可以明显提高转基因烟草种子在盐胁迫下的萌发率和幼苗抗氧化水平, Kiba等[28]在玉米( Zea mays )中超表达过氧还蛋白基因( PrxQ )也增强了玉米的抗真菌侵染和抗氧化能力。在本试验中, 高光强(1000 μmol m-2 s-1)下, 细胞中SOD活性增强, 而APX活性受到抑制, 通过SOD和APX途径清除叶绿体中的超氧阴离子自由基明显受到抑制, 烟草叶片中会积累过多的H2O2, 类囊体膜会发生脂质过氧化, 但转 2-Cys Prx 基因烟草幼苗叶片的H2O2含量和MDA含量均明显低于对照, 这说明2-Cys Prx清除了在盐和高光胁迫下产生的H2O2, 在APX失去活性的情况下发挥了清除H2O2的作用, 减轻了烟草幼苗的氧化伤害, 但弱光下APX活性没有受到抑制的情况下, 2-Cys Prx 与APX是否具有协同作用有待进一步研究。
 | 图6 不同光强下转基因烟草叶片 VJ和 Mo对盐胁迫的响应Fig. 6 Responses of VJand Mo in transgenic tobacco leaves to salt stress under different light intensities |
为了进一步分析 2-Cys Prx 清除H2O2对光合机构的保护作用是否与APX具有相似性, 利用叶绿素荧光技术分析了高光和盐胁迫下光合机构的变化。一般情况下, 在较低浓度盐不会引起植物的PSII光抑制[29], 但强光会引起盐胁迫下植物光合的抑制作用[30,31]。当盐和强光胁迫共同作用时, PSII反应中心活性降低, 产生光抑制, 甚至出现光氧化和光漂白而致植株死亡[32]。盐胁迫对植物光合作用的影响主要是较高浓度的盐诱导植物细胞中ROS不平衡引起的[33], 盐胁迫下植物核酮糖-1,5-二磷酸羧化酶(Rubisco)活性和RuBP再生速率下降[34], 光合作用的暗反应受到抑制, 即固定碳的能力降低, 暗反应利用同化力(ATP和NADPH)的能力降低, 从而反馈抑制光合电子传递链中的电子传递[35], 引发过剩电子的积累, ROS的产生; 另外在强光下, P680捕获的光量子数量增加, 电荷分离速率就会增大, 增加电子传递链的压力[36]。本试验中, 弱光(200 μmol m-2 s-1)下不同浓度盐处理的烟草叶片 ETR 、 ϕPSII和 Fv/ Fm明显低于强光(1000 μmol m-2 s-1)下, 且弱光下烟草幼苗叶片的 Fv/ Fm在不同盐浓度下未发生明显的变化, 即弱光下较高浓度的盐胁迫也未能引起烟草幼苗叶片的PSII光抑制。强光下, 烟草叶片的 ETR 和 ϕPSII随着盐浓度的增加明显降低, 叶片的 Fm和 Fv/ Fm也明显下降, Fo显著上升, 暗示强光加剧了盐胁迫下烟草叶片PSII的光抑制。不同浓度盐处理下, 转 2-Cys Prx 基因烟草幼苗叶片 Fv/ Fm在弱光下与对照之间无明显差异, 但在强光下却明显高于对照, 且 ETR 和 ϕPSII也明显高于对照, 暗示转 2-Cys Prx 基因在缓解盐和高光胁迫引起的电子传递受阻中发挥了作用, 减轻了PSII反应中心的光抑制程度。盐和高光胁迫下, 烟草幼苗叶片的电子传递速率下降(图4), 这与盐胁迫下抑制了PSII电子供体侧[37]和(或)受体侧[38]的电子传递有关。在OJIP曲线上, VJ表示关闭反应中心的数量或QA的还原量, 即QA-的积累量, Mo表示相对荧光的初始斜率, 可以用来表示QA被还原的相对速率, 通过 VJ和 Mo可以分析PSII受体侧QA到QB电子传递速率[39]。本试验中, 盐胁迫下烟草幼苗叶片的 VJ和 Mo均呈明显的增加趋势, 说明增加了QA-的积累量和QA的还原速率, 即PSII反应中心电子受体侧的电子传递受阻, 而对于PSII供体侧放氧复合体(OEC)的伤害较小, 通过光合水裂解产生H2O2的数量较少, 细胞中积累的H2O2大部分来自SOD歧化作用。同时发现, 强光下的 VJ和 Mo变化幅度随盐浓度的增加明显大于弱光条件下, 暗示盐胁迫抑制了烟草幼苗叶片PSII反应中心电子受体侧的电子传递速率。但是, 强光下转 2-Cys Prx 基因烟草幼苗叶片的 VJ和 Mo增加幅度低于对照, 随盐浓度的增加表现的更加明显, 暗示 2-Cys Prx 可以明显提高盐和高光胁迫下烟草幼苗叶片PSII反应中心电子受体侧的电子传递速率, 降低PSII反应中心的激发能压力。
增强 2-Cys Prx 基因在烟草叶片中的表达, 可减轻烟草叶片在高光和盐胁迫共同作用下的氧化伤害, 在高光和盐胁迫抑制APX活性的情况下, 2-Cys Prx 可以有效清除细胞中过量H2O2, 提高光合电子传递链的稳定性, 降低PSII的光抑制程度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|