为探讨高产杂交稻两优培九在衰老过程中, 剑叶光合膜蛋白质复合物的含量变化规律及其与光能吸收、转化、传递的关系, 以大田栽培自然衰老剑叶为材料, 利用活体叶绿素荧光动力学技术, 并结合类囊体膜蛋白质复合物蓝绿温和胶电泳分析。结果表明, 两优培九剑叶叶绿素含量、光合性能、类囊体膜蛋白稳定性等都在抽穗期达到顶峰, 随后开始衰退, 在扬花期、灌浆期尚保持较高水平, 而进入籽粒成熟阶段衰退明显; 随着衰老进程, 光合膜蛋白质复合物有序非同步降解, 稳定性为LHCII > PSIIcore > PSIcore > ATPase & Cyt
The purpose of this study was to explore the content variation of thylakoid membrane protein complexes and its relationship with light absorption, transformation and transfer in flag leaves of high-yield hybrid rice Liangyoupeijiu during senescence. A rice cultivar, Liangyoupeijiu was grown in the field. Through chlorophyll a fluorescence transient, physiological and biochemical techniques, we studied the function of photosynthetic membrane. The content changes of thylakoid membrane protein complexes were also investigated by Blue-native polyacrylamide gel-electrophoresis (BN-PAGE). The results showed that chlorophyll content, photosynthesis and thylakoid membrane protein content of flag leaves rose and peaked at heading stage, then began to decline. It still maintained a high level at flowering and filling stages, and the significant decline appeared untill the stage of milky and wax ripeness. The stability of protein complexes (i.e. inverse degradation rate) during leaf senescence showed an order of LHCII > PSIIcore > PSIcore > ATPase & Cyt
在水稻生长过程中, 叶片衰老是伴随生殖生长进程而必然发生的, 衰老发生的早晚、衰老进程的急缓会严重影响水稻的产量, 特别对于杂交水稻, 早衰已成为限制其产量进一步提高的重要因素[1]。叶片光合性能下降和光合机构改变是衰老最典型的特征, 衰老与叶绿体类囊体膜即光合膜各个色素蛋白质复合物和相关电子载体中的一系列光能吸收、转化、传递过程的变化密切相关。
两优培九具有产量高、米质优和抗性强等优点, 其功能叶片叶绿体结构优势明显, 全展初期类囊体数量丰富且结构稳定, 基粒类囊体膜垛叠程度高[2], 光能转化和被膜转运光合产物的能力较强, 但在生育后期易出现早衰现象, 特别在低温或水分逆境条件下更明显[3]。剑叶是两优培九功能期最长、衰老最晚、对产量影响最大的叶片[4], 对于其衰退进程相关光合作用效率、抗氧化系统、光合暗反应关键酶、叶绿体超微结构和类囊体膜脂肪酸成分变化等已有相关报道[5,6,7], 但对光合膜功能性大分子蛋白质复合物的变化及其与衰老过程光反应变化间的相互关系还有待进一步探索。
类囊体膜主要有4种高丰度的多亚基膜整合蛋白质复合物, 即光系统I (Photosystem I, PSI)、光系统II (Photosystem II, PSII)、细胞色素b6/f复合体(cytochrome b6/ f complex, Cyt b6/ f )和ATP合酶复合体(ATP synthase complex, ATPase)[8], 这些复合物参与完成原初光化学反应、电子传递和光合磷酸化, 并为叶绿体囊腔酶系统完成卡尔文循环提供ATP与还原力。为分离这类疏水性强的大分子膜蛋白, Schägger等[9]建立了蓝绿温和凝胶电泳系统(blue- native polyacrylamide gel-electrophoresis, BN-PAGE), 利用该技术可以近似天然的形态分离复合物, 真实反应复合体的大小、数量、组成及相对丰度等。目前BN-PAGE常用于拟南芥、水稻等叶绿体突变型的类囊体膜构成分析[10,11], 而关于对水稻类囊体膜蛋白组分响应衰老等逆境的过程性变化研究尚较少。
本研究利用无损伤叶绿素荧光动力学技术和离体光合电子传递活性反应测定技术, 分析两优培九剑叶类囊体膜在田间自然衰老进程中的功能变化, 并结合蛋白质复合物的蓝绿温和胶电泳分离, 从蛋白质水平分析和解释这些变化, 为两优培九生殖后期的衰老特性提供理论补充。
杂交稻两优培九种子由江苏省农业科学院粮食作物研究所提供, 2011年和2012年在其试验基地大田栽培, 5月中旬播种, 6月中旬栽插, 常规水作管理, 及时防治杂草和病虫害。从剑叶全展起每隔9 d于上午10:00左右测定指标, 并采集剑叶, 及时以鲜叶实验, 或者将完整叶片-80℃冷冻保存备用。采样从8月中旬起至9月底止, 于拔节孕穗期(剑叶刚全展)、抽穗期、扬花期、灌浆期、乳熟期、蜡熟期采样。到10月两优培九进入完熟期剑叶已全黄或枯萎衰亡, 故不再取样分析。
参照Arnon[12]的方法稍做改动。取0.1 g去中脉剑叶加入预冷的80%丙酮充分研磨成匀浆, 6000转 min-1冷冻离心10 min留上清液, 继续用80%丙酮洗涤沉淀1~2次, 至沉淀灰白色, 将每次离心的上清液混匀定容至10 mL, 用Thermo GENESYS 10UV紫外-可见分光光度计测定645 nm和663 nm吸光值。设立5组重复, 每组测量5次, 取平均值。
使用英国Hansatech公司连续激发式荧光仪Handy PEA测定剑叶荧光参数。于上午10:00左右暗适应叶片20 min, 用3000 μmol m-2 s-1饱和红闪光照射, 仪器自动记录从10 μs到1 s之间高分辨率间隔荧光信号, 测得叶绿素荧光诱导参数。每次随机选用20片叶, 测定重复3次。利用配套软件PEA Plus V1.04处理分析数据。参考Strasser等[13]和魏晓东等[14]的方法计算相关参数。
参照Dunahay等[15]的方法加以改进制备类囊体膜。称取2 g去脉剑叶于研钵中, 加入预冷的缓冲液B1 (0.4 mol L-1 Sucrose, 2 mmol L-1 MgCl2, 0.2% BSA, 20 mmol L-1 Tricine pH 8.0), 冰浴研磨, 4层纱布过滤; 滤液经300× g 冷冻离心2 min去除组织沉淀, 再经4000× g 冷冻离心10 min, 得破碎叶绿体沉淀; 沉淀与缓冲液B2 (0.15 mol L-1 Sucrose, 5 mmol L-1 MgCl2, 0.2% BSA, 20 mmol L-1 Tricine pH 8.0)匀浆, 以4000× g 冷冻离心10 min得沉淀; 再用B3 (15 mmol L-1 NaCl, 5 mmol L-1 MgCl2, 20 mmol L-1 MES pH 6.5) 匀浆, 即得类囊体膜悬浮液; 参照Coombs等[16]的方法, 在反应基质(0.2 mol L-1 Sucrose, 5 mmol L-1 MgCl2, 5 mmol L-1 NaCl, 5 mmol L-1 NH4Cl, 25 mmol L-1 Tricine-NaOH pH 7.6)中加入不同反应介质、电子传递抑制剂、人工电子受体和等叶绿素浓度的类囊体膜悬浮液, 用Hansatech Chlorolab-2 Clark型液相氧电极测定电子传递链活性。
参照Chen等[11]的方法加以改进。将去中脉剑叶剪碎, 加入提取缓冲液(330 mmol L-1 Sorbitol, 50 mmol L-1 HEPES-KOH pH 7.8, 2 mmol L-1 EDTA, 2 mmol L-1 MgCl2, 10 mmol L-1 NaHCO3, 0.05% BSA, 5 mmol L-1 Ascorbic acid), 低温条件下用高速组织捣碎机进行5次2 s研磨, 4层纱布过滤, 200× g 离心2 min去除组织沉淀, 2000× g 离心5 min得到粗叶绿体沉淀。用悬浮缓冲液(330 mmol L-1 Sorbitol, 50 mmol L-1 HEPES-KOH pH 7.6, 2 mmol L-1 MgCl2, 1 mmol L-1 DTT)悬浮叶绿体并加入到35%/70% (1︰1) Percoll梯度介质中, 用Beckman L8离心机SW28水平转子4500× g , 4℃离心10 min抽取中间绿色层即为完整叶绿体。
将完整叶绿体在低渗裂解液(50 mmol L-1 HEPES-KOH pH 7.6, 2 mmol L-1 MgCl2, 1 mmol L-1 EDTA, 1 mmol L-1 PMSF)中冰浴涨破, 14 000× g 离心3 min得到类囊体膜沉淀。用适量样品缓冲液(25 mmol L-1 BisTris-HCl pH 7.0, 20% Glycerol)悬浮类囊体膜并调整叶绿素浓度至1 mg mL-1, 缓慢滴加等体积含2% ( W/V ) DM的样品缓冲液, 混匀冰浴增溶30 min, 15 000× g 离心10 min去除不溶物质, 即得到类囊体膜蛋白溶液。
采用北京六一仪器厂DYCZ-28A型单板夹芯式垂直电泳仪制胶和电泳。灌制1 mm厚度5%~12%非变性梯度聚丙烯酰胺分离胶和4%浓缩胶, 凝胶中均含有50 mmol L-1 BisTris pH 7.0和500 mmol L-1 6-amino-n-caproic acid。类囊体膜蛋白样品中加入1/10体积上样缓冲液(5% Coomassie brilliant blue G250, 100 mmol L-1 BisTris-HCl pH 7.0, 500 mmol L-1 6-amino-n-caproic acid, 30% Glycerol)混匀后上样电泳, 阴极缓冲液中含0.01% Coomassie brilliant blue G250。在4℃条件下, 浓缩胶以100 V恒压运行, 分离胶以180 V恒压运行, 并于进行到1/2时更换为不含考马斯亮蓝的阴极缓冲液, 大约2~3 h完成电泳。
采用Microsoft Excel 2007及IBM SPSS Statistics 20分析数据, 1D BN-PAGE电泳结果经GE Image Scanner III扫描仪获取图像, Bio-Rad Quantity One V4.6.2进行分析, 采用OriginPro 8作图。
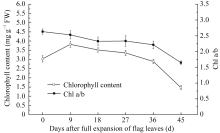
叶片衰老最明显的特征是叶绿素的丧失[17]。图1显示, 自全展开始, 两优培九剑叶叶绿素含量先上升, 到抽穗期达最大, 随后逐渐下降, 全展35 d后下降明显, 到蜡熟期叶绿素含量仅为峰值的38.3%。剑叶叶绿素a与b的比值(Chl a/b)同样呈下降趋势, 总体降低37.4%, 说明叶片衰老过程中叶绿素a的降解速度较叶绿素b更快。
在活体叶片中叶绿素均以叶绿素-蛋白质复合物的形式存在, 结合于类囊体膜上, 其中叶绿素a主要存在于PSI和PSII核心复合体中, 而叶绿素b主要存在于捕光色素复合物中[18]。实验显示, 两优培九剑叶叶绿素a在衰老过程中更快速减少, 可以推测在光合膜相关色素蛋白复合物中, 光系统核心的降解先于捕光天线发生。
叶片经过暗适应后加以强光照射发出的荧光随时间变化形成的多相上升曲线, 即为快速叶绿素荧光诱导动力学曲线, 通常会出现O (20~50 µs)、J (2× 103 µs)、I (3×104 µs)、P (3~10×105 µs) 4个特征性位点。O点为初始荧光( F0), 即PSII反应中心完全开放, 所有电子受体(QA、QB、PQ等)处于最大程度氧化态时的荧光, O点荧光强弱与天线色素含量的多少及作用中心的活性状态有关。J点为PSII反应中心被激发使QA第一次处于瞬时最大程度还原态时的荧光[19]。如图2, 两优培九剑叶全展后各时期O-J-I-P曲线在J点相交, 表明电子从QA向QB的传递状态没有明显受到衰老的影响, 而 F0呈整体上升趋势, 到腊熟期上升30.5%, 说明反应中心接受光量子的能力逐渐衰退, 且其失活快于天线色素的降解[20]。J-I段荧光值变化不明显, 而I-P段荧光值先上升, 抽穗期后开始下降, P点即PSII电子受体处于最大程度还原态时的荧光( Fm)在衰老后期下降速度逐渐增大。
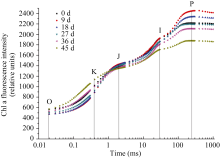 | 图2 剑叶衰老过程快速叶绿素荧光诱导动力学曲线变化Fig. 2 Changes in chlorophyll a fluorescence transient of flag leaves during senescence |
到生长后期, 荧光曲线表现出O-K-J-I-P特征, K点是O-J之间大约300 µs处的位点。对OJIP曲线进行O-J、O-K标准化[21], 以全展9 d剑叶荧光值为基准得到Δ WO-J、Δ WO-K以表现K点和L点(图3)。在抽穗至灌浆期剑叶荧光曲线没有明显K点, 随后开始出现K点, Δ WO-J值急剧增高。K点的出现是叶绿体放氧复合体(OEC)受到伤害的特异性标志[22], 说明两优培九进入乳熟生长期后, 剑叶PSII供体侧光抑制显著增强。100~120 μs处的L点从全展初期至灌浆期均不明显, 而到乳熟期迅速升高, 随后继续上升但幅度小于K点的上升。L点上升为类囊体解离的特异性标志[23], 说明剑叶全展后PSII可以维持20 d左右基本稳定随后发生变化, 到衰老进入后期稳定性大幅度下降, 能量交流受到抑制, 结合腊熟期I、P点荧光值的明显降低的现象, 推测此时PSII的整体结构可能已经基本瓦解。
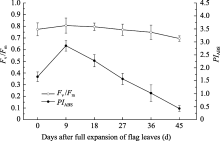
两优培九剑叶PSII最大光化学效率( Fv/ Fm)及以光吸收为基础的光合性能指数( PIABS)在整个过程中先上升, 至全展9 d左右开始下降, 两者呈显著正相关性, 相关系数0.955 ( P<0.01)。 Fv/ Fm常用来衡量植物受外界胁迫的程度[19], 在衰老进程中整体变化幅度不大, 如图4, 腊熟期较抽穗期降低13.8%; 而性能指数 PIABS综合了反应中心密度、原初光化学量子产率和电子在2个光系统之间的传递效率, 可以更准确地反映光合机构的状态, 敏感性更强[24], 从抽穗期起以每期20%左右的速率下降, 最终仅剩峰值的15.1%。
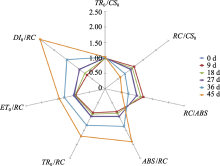
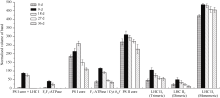
图5以剑叶刚全展时各荧光参数为基准做雷达图, 显示PSII和能量分配相关指标的变化。单位叶面积PSII反应中心数( RC / CS0)及活性反应中心数( RC / ABS )从全展9 d左右之后开始下降, 到乳熟期后下降剧烈, 并且活性反应中心数下降更明显。单位反应中心吸收的光能( ABS / RC )、用于还原QA的能量( TR0/ RC )和用于电子传递的能量( ET0/ RC )随衰老上升, 说明每一个有活性的反应中心随着叶片衰老承担了更多的光能转化任务; ET0/ RC 后期下降较前两者慢, 可见活性反应中心捕获的光能优先保证推动PSII电子传递; ET0/ RC 变化趋势与图3中L点变化相吻合(显著正相关性, 相关系数0.979, P<0.01), 说明类囊体结构的稳定性、光系统亚单位之间的稳固性对于光合电子传递具有很大影响。而在整个过程中单位叶面积捕获的光能( TR0/ CS0)几乎没有差异, 单位反应中心耗散的能量( DI0/ RC )急剧增大, 可见随着不断衰老, 光合能量收支愈渐失衡, 结合图1叶绿素a/b的变化可以推测两优培九剑叶在衰老进程中捕光系统功能维持时间较反应中心长, 以维持能量的吸收并通过协助剩余能量耗散的机制保护反应中心。
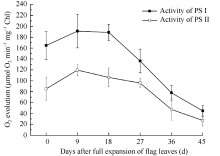
反应介质添加人工电子受体和供体DCPIP→ MV发生的耗氧反应速率用以测定PSI电子传递活性, H2O→K3Fe(CN)6发生的放氧反应速率用以测定PSII电子传递活性, 结果如图6。
PSI和PSII电子传递活性均呈先上升后下降趋势, PSI耗氧活性始终高于PSII放氧活性, 但两者变化趋势有较大差异。PSI活性在剑叶全展18 d左右后开始快速下降, 而PSII活性维持较高水平的时间更长, 在全展27 d左右快速下降。电子传递活性降低可能是伴随衰老而产生的光合膜组分降解或不可逆失活造成的, 而PSI和PSII电子传递活性变化的失衡也可能加速衰老的进程。
2.5.1 以BN-PAGE分离鉴别类囊体膜蛋白质复 合物 蓝绿温和胶电泳中, 类囊体膜结合叶绿素
的蛋白质复合物呈绿色, 不含叶绿素的蛋白质复合物呈蓝色, 直观反映结果。两优培九剑叶类囊体膜以1% ( W/V ) DM增溶膜蛋白, 在5%~12%梯度凝胶范围内分离到9条主要的蛋白质复合物条带, 因衰老各个时期蛋白质复合物有差异, 故选取条带最丰富清晰的抽穗期样品进行鉴别。电泳后直接脱去考马斯亮蓝底色, 即可以清晰观察到3条蓝绿色条带、3条蓝色条带、3条绿色条带(图7)。
图7最上方的大分子量条带丰度极低, 是类 囊体膜结构最稳定时分离到的超级复合物(supercomplexes), 在两优培九类囊体膜中出现较少; 最下方的蓝色线为上样缓冲液中的考马斯亮蓝指示前沿。电泳相对分子量标准采用Amersham High Molecular Weight Calibration Kit for Native Electro-
phoresis。利用Bio-Rad Quantity One V4.6.2对图像预测分子量, 参考Shao等[25]和Chen等[26]的研究, 鉴别各复合物条带(表1)。
经过优化的BN-PAGE可以完整分离出两优培九剑叶类囊体膜上各种膜整合功能性蛋白质复合物, 为进一步对光合膜蛋白质组学研究提供条件。
| 表1 蛋白质复合物表观分子量 Table 1 Apparent MW of thylakoid membrane protein complexes |
2.5.2 两优培九剑叶衰老过程中类囊体膜蛋白质复合物的变化 利用蓝绿温和胶电泳分析衰老各时期两优培九剑叶类囊体膜蛋白质复合物含量变化, 其中蜡熟期剑叶(全展45 d样品)因叶绿素含量过低, 无法获得足够浓度的完整叶绿体而未比较。如图8-a, 每条泳道均以等叶绿素含量(1 mg mL-1, 20 μL)的类囊体膜进行蛋白质增溶处理后上样, 单泳道蛋白质总量约30~50 μg。为分析各条带蛋白质相对含量, 用1D凝胶分析软件Bio-Rad Quantity One V4.6.2处理电泳图像, 得到光密度曲线如图8-b, 可以直观对比显示各条带光密度值大小和面积, 用以半定量分析。
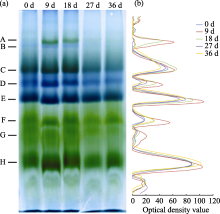 | 图8 衰老各时期类囊体膜蛋白质复合物在蓝绿温和胶电泳中的变化Fig. 8 Changes of thylakoid membrane protein complexes in BN-PAGE during senescence |
经过3组重复实验, 得到蛋白质电泳条带相对含量变化(图9)。可以看出两优培九剑叶类囊体膜上丰度最高的蛋白质复合物为光系统II捕光色素蛋白复合体(LHCII), 包括三聚体、二聚体、单体3种形式, 以单体最多, 3种形式的LHCII数量在衰老过程中都有所减少但并不显著。光系统II核心复合体(PSIIcore)数量先上升, 到抽穗期后下降, 至乳熟期后下降迅速, 与前述荧光参数 RC / CS0反映的结果吻合。电泳结果显示, 光系统I在整个过程中出现降解更早, 扬花期后开始大幅度减少, 并且非常明显的光系统I捕光色素蛋白复合体(LHCI)较之其核心复合体(PSIcore)先减少且幅度极大, 扬花期后LHCI几乎难以从BN-PAGE中得到展现。另外ATP合酶复合
体(ATPase)及细胞色素b6/f复合体(Cyt b6/ f )也在扬花期后快速减少, 随后降解速度减缓, 但因1D BN-PAGE分辨率制约, F1-ATPase与Cyt b6/ f 出现条带位置相近, 无法准确区分, 需要进一步做二维分离才可具体判断。
叶片叶绿素含量和光合性能的相对稳定时间可以用于衡量水稻光合功能期的长短[27], 进而对衰老阶段评价。本研究显示, 两优培九剑叶在水稻拔节孕穗期开始逐步全展后, 先出现光合性能的提升, 到抽穗期达到顶峰, 随后开始下降, 总体在扬花期、灌浆期尚能保持较高水平, 为高产打下基础[28], 而进入籽粒成熟阶段, 剑叶衰退明显。叶片类囊体膜蛋白质复合物的增减与此过程保持同步, 可以看出光合膜结构功能的变化与衰老进程有密切的因果关系。
叶绿素a与b降解速度的差异在类囊体膜蛋白蓝绿温和胶电泳结果中得到解释, 富含Chl b的捕光天线比富含Chl a的反应中心维持含量的时间更长。PSI和PSII的降解模式也存在显著区别, 对于PSII而言, 其捕光天线LHCII在衰老过程中的稳定性高于PSIIcore的稳定性, 而PSI情况相反, LHCI的降解速率快于PSIcore。PSII主要分布在垛叠的基粒类囊体膜上, 在光下介导水到质醌的电子传递; PSI则分布在非垛叠的基质类囊体上, 除进行非循环电子传递生成NADPH外还介导循环式电子传递[18]。两优培九剑叶光合膜上, PSI丰度较PSII低, PSI数量与相应的电子传递活性衰减与PSII存在异步性, PSI衰退发生在扬花期后且幅度较大, 而PSII从剑叶光合性能到达峰值(即抽穗期)就开始下降但幅度较小, 直到衰老后期才明显衰退。2个光系统变化的不协调可能打破原初反应和同化力形成过程中原本的平衡关系, 增加活性氧自由基产生的机会, 加速衰老发生[29]。
衰老过程中PSII光化学效率呈现与相关蛋白质复合物变化相一致的趋势。叶绿素荧光动力学曲线L点在乳熟期开始大幅度上升, 表明PSII亚单位之间的连接开始松散, 稳固性减弱, 从可逆保护性失活开始转向不可逆失活[30]; K点的变化显示PSII供体侧放氧复合体的显著破坏发生在衰老的末期。关于各蛋白亚基具体的变化情况, 需要对一维蓝绿胶电泳作二向分离鉴定才可得出。
PSII在衰老进程中最为典型的是对光能捕获与利用之间变化的不平衡, 这是LHCII在生殖后期始终保持较高相对含量的结果。LHCII是光合膜含量最丰富的蛋白质, 并且结合PSII近60%的叶绿素, 天然生理状态主要以三聚体存在, 离体分离后会出现解聚[31], 除了光能的吸收与传递, LHCII在维持类囊体膜垛叠, 调节两个光系统之间的能量分布和光保护等方面起着重要作用。两优培九剑叶LHCII在衰老过程中表现出最稳定的特征使叶片光能捕获始终保持一定水平, 同时LHCII通过磷酸化和迁移调节激发能在PSI和PSII之间的分配, 保证光能最大程度传递到反应中心[32]。过剩光能的耗散( DI0/ RC )在衰老前期较小, 到后期明显增大可能与依赖叶黄素循环的热耗散的增加相对应, 而叶黄素循环主要在LHCII中进行[33], 因此衰老过程中LHCII的相对稳定性有利于减轻光合机构遭受光破坏。但LHCII的大小和稳态也并非越高越好, 许晓明等[34]对于低叶绿素b突变体水稻的研究显示, 保持合适的捕光天线与反应中心比例才能提高光能利用效率, 降低光抑制, 减少光氧化, 维持衰老过程中的光合作用水平。
两优培九进入抽穗期后, 剑叶光合膜蛋白质复合物开始有序降解, 随衰老进程其稳定性呈LHCII > PSIIcore > PSIcore > ATPase & Cyt b6/ f > LHCI, 光能转化水平在衰老前期缓慢下降, 而到籽粒成熟阶段明显衰退, PSII捕光色素复合物系统的相对稳定可能在维持光合膜功能中起重要作用。但是类囊体膜复杂的功能蛋白质系统如何在衰老过程中改变和调节, 有待对蛋白质复合物亚基以及BN-PAGE无法分离的各种膜附着小分子蛋白质进一步分析。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|