细胞悬浮系的中短期保存广泛需要。本文应用中花15细胞悬浮系, 比较了AA、N6、MS三种固体培养基对水稻细胞悬浮系的繁殖保存效果, 结果表明, AA固体培养基保存效果最好。细胞系可以在AA0培养基上4个月、在AA0.5培养基上6个月(中间45 d左右继代一次)连续保存后仍然保持其可重悬性。通过比较AA固体培养基繁殖保存、冷冻保存、连续悬浮培养3种保存方法, 表明AA固体培养基繁殖保存细胞系2~9个月内, 既可保持细胞的可悬浮性, 又对细胞系的POD、SOD活性和植株再生率影响较小, 是一种理想的细胞悬浮系中短期保存方法。
The preservation of cell suspension in short-medium term is widely needed in cell biology. In this paper, the preservation effects of cell suspension of rice cultivar Zhonghua 15 on AA, N6, and MS solid culture media were compared. The results showed that AA medium was suitable for suspension cells preservation. The cell suspension still kept resuspensible after growing continuously on AA solid medium for 4 months, and then on AA medium supplemented with 0.5 mg L-1 2,4-D for 6 months (subcultured at about 45 d interval). Three kinds of methods of suspension cells preservation, namely preservation on AA solid medium, cryopreservation, and continuously suspending culture, were compared. The results indicated that the first method kept good suspensible property, had high regeneration rate, and had a little influence on activities of POD and SOD, even though the suspension cells grew on AA medium for 2-9 months. AA solid medium is ideal for the preservation of suspension cells in short-middle-term.
水稻细胞悬浮系是用来开展水稻遗传学、蛋白质组学和遗传改良研究的重要材料[1,2]。从愈伤组织的诱导到悬浮系的建立一般需要4~6个月时间[3], 过程繁琐。悬浮系的保存多年来一直是人们想解决而又没有解决好的问题, 目前常用的保存方法是超低温保存法。自Sakai 1960年首次报道植物超低温保存以来, 目前已建立了两步冷冻法[4,5,6,7]、玻璃化法[8,9]、包埋脱水法[10,11,12]和包埋玻璃化法[13]等多种方法, 并不断有改进冷冻保存方法的研究[14]。在超低温条件下, 细胞的分裂和生理代谢近乎停止, 理论上可以保持其遗传稳定性[15,16,17]。因此, 超低温保存被视为长期保存细胞悬浮系最理想、有效的方法[18,19,20,21,22]。
细胞悬浮系如果作为资源材料长期保存, 超低温保存非常合适, 但是作为生物工程的实验材料, 经常仅需做短期或中短期保存, 例如, 试验中经常遇到细胞悬浮系已经建好, 但2~3个月, 或者3~4个月时间内暂不应用的情况, 如何在这一时间内保存细胞悬浮系, 一般做法是要么冷冻保存, 要么继续悬浮培养, 但超低温保存处理操作较复杂、再悬成活率低, 不适于悬浮系的中短期保存, 继代悬浮培养又费时费力。对于细胞悬浮系的中短期保存的研究一直未见报道。笔者将植物繁殖保存的概念引入细胞系的保存, 以繁殖保存为思路, 将悬浮细胞系继代到不同固体培养基, 通过在固体培养基上的简单继代, 和后期的过氧化氢酶、超氧化物歧化酶测定及细胞系再生能力的检测, 找到了一种既能维持细胞的适宜悬浮状态, 又操作方便、简单实用的中短期保存方法。
粳稻品种中花15种子由中国农业科学院作物科学研究所赵志超博士提供, 细胞悬浮系由本实验室用成熟胚诱导建立。
实验设置固体培养基保存、冷冻保存和液体培养基悬浮保存3种保存方法, 每个方法设3次重复。
1.1.1 固体培养基保存 以AA、N6和MS培养基为基本培养基, 分别添加0 mg L-1、0.5 mg L-1、 1.0 mg L-1和2.0 mg L-1的2,4-D, 形成AA0、AA0.5、AA1.0、AA2.0、N60、N60.5、N61.0、N62.0、MS0、MS0.5、MS1.0、MS2.012种固体培养基, pH5.8, 蔗糖3%, 琼脂0.5%。培养基经高压灭菌后倒入直径6 cm的培养皿, 每个培养皿16.0 g。称取0.1 g细胞悬浮系分别接种到上述12种培养基上, 25℃暗培养。观察细胞团生长情况, 测定30 d的生长量, 根据其在培养基上的生长情况, 确定适宜的基本培养基及2,4-D用量。然后改用9 cm培养皿, 每皿加入36 g培养基, 接种0.3 g细胞团, 根据愈伤组织质量和生长量情况继代。记录每次继代间隔时间、适宜培养基的2,4-D用量。
1.1.2 冷冻保存 用AA + 0.26 μg L-1 ABA + 10%Pro + 5% DMSO + 10% 蔗糖预培养液对水稻悬浮细胞预培养2 d, 然后利用冷冻保护剂10% DMSO + 10% PEG + 10% 蔗糖对悬浮细胞系冷冻前处理 1 h, 倒掉冷冻保护剂, 用滤纸吸去多余水分和冷冻保护剂, 装入无菌冷冻管, 在液氮中速冻之后, 放入-80℃冰箱保存。
用AA 10%蔗糖 + 2 mg L-1 2,4-D、AA + 8%蔗糖 + 2 mg L-1 2,4-D、AA + 5%蔗糖 + 2 mg L-1 2,4-D依次对悬浮细胞洗涤复苏, 每次20 min, 最后用AA2.0液体培养基悬浮培养[5]。
1.1.3 悬浮继代保存 用AA2.0液体培养基悬浮培养, 每隔4~5 d继代一次。
对固体培养基培养和冷冻保存的细胞系, 分别于6个月、9个月、12个月重新悬浮。每个细胞系称取0.4 g细胞团, 接种于60 mL 瓶-1 AA2.0液体培养基中, 25℃, 110转 min-1暗培养, 并3~5 d继代一次, 每次继代时弃去下面大颗粒和静止后不能迅速下沉的衰败细胞, 更换相同体积的新鲜培养液, 当细胞分裂速度达到4 d增殖一倍时, 表明细胞团再次进入快速分裂状态, 重悬成功。
称取每个重悬完毕的细胞系0.5 g接种于MS + 6BA 4.0 mg L-1 + KT 2.0 mg L-1 + NAA 0.2 mg L-1 + CuSO4•5H2O 1.5 mg L-1诱导分化培养基, 诱导植株再生, 并于接种到分化培养基上的第0、4、8、12、16、20 d, 用南京建成生物工程研究所的植物组织铜锌-超氧化物歧化酶(SOD)测定试剂盒、过氧化物酶(POD)测试盒, 测定不同时期细胞团的SOD和POD的活性。
细胞团接种到分化培养基上后仍处于不断分裂生长过程中, 每隔25~30 d将没有分化芽的愈伤组织在分化培养基上继代, 有分化芽的愈伤组织留在原培养基上, 待芽长1 cm左右, 接种到生根培养基。经过连续3至4次继代, 完成植株分化。
悬浮细胞团在固体培养基上经过1个月的培养, 沙状愈伤组织逐渐减少, 形成松散、松软程度不等、 颜色由乳白色到浅黄色、黄色不同的团块(图1)。可以看出不同基本培养基对悬浮细胞系的培养效果差异非常明显。其中AA培养基上的愈伤组织颜色乳白、松脆、鲜艳亮泽, 分裂旺盛。MS培养基上的愈伤组织浅黄、松散, 边缘颗粒黄色、较致密, 生长较旺盛。N6上的愈伤组织后期生长速度较慢、褐化早, 愈伤组织状态介于AA、MS之间。
2.1.1 不同培养基对细胞系可重悬性状的影响
以适宜重新悬浮为质量标准, 从14 d、22 d、30 d的愈伤组织颜色、光泽、松脆程度来判断愈伤组织的质量, 从高到低的顺序为: AA > N6 > MS, 且AA培养基上的愈伤组织质量远远高于N6和MS, 非常适合重新建立悬浮系; AA0、AA0.5、AA1.0、AA2.04种培养基上的愈伤组织质量相近, 在适悬性上差别很小。从适合悬浮角度看, 不同培养基的选择效果优于不同2,4-D剂量的选择效果。
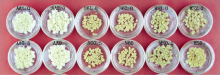 | 图1 不同固体培养基对水稻悬浮细胞团的培养效果Fig. 1 Culture effects of different culture media on the rice suspension cells |
2.1.2 不同培养基的保存效果 从30 d称重结果看, 愈伤组织生长速度从高到低的顺序为: AA2.0 > AA1.0 > AA0.5 > AA0 > MS2.0 > MS1.0 > MS0.5 > N62.0 > N61.0 ≈ MS0 > N60.5 > N60 (图2)。从保存过程中需要降低生长速度来看, 愈伤在N6培养基上生长最慢, 但从愈伤组织适于悬浮质量看, AA培养基上的愈伤组织最佳, 所以下一步实验选用AA培养基进行了继代保存方法的探索。
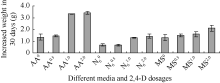 | 图2 细胞悬浮系在不同培养基、不同2,4-D剂量上的增重Fig. 2 Increased weight of suspension cells on different culture media, different 2,4-D levels |
在4种AA培养基中, AA0既保存了细胞团的可悬浮性, 又使细胞团分裂最慢, 适于悬浮细胞系继代保存; MS培养基上生长的愈伤组织是朝分化方向发展的, 可以用于悬浮细胞系的胚性恢复和分化。
根据悬浮细胞系第一次接种到固体培养基上的生长情况, 后面的继代只在AA0、AA0.5、AA1.0、AA2.0 4种培养基上进行。以保持愈伤组织适于悬浮培养状态为前提、以降低细胞分裂速度、延长继代间隔时间为原则, 选取生长量大约1.5 g以上、最低2,4-D剂量培养基上的愈伤组织进行继代。
结果显示, 细胞悬浮系在AA0培养基上连续继代3次, 降低分裂速度, 然后继代到AA0.5培养基上, 可以持续保持1.5 g 月-1以上的生长速度, 并使继代间隔时间达到40~50 d, 这样一年内只需继代9次。具体保存方式为: AA液2.0→AA030 d →AA045 d →AA045 d →AA0.550 d →AA0.545 d →AA0.545 d →AA0.540 d →AA1.045 d →AA2.020 d →AA液2.0重悬, 见表1。并且, 悬浮系在AA培养基的继代过程中, 没有明显的颗粒褐化现象。
参照表1, 可以推算细胞系在AA培养基上保存的时间, 以确定选用2,4-D的愈用量和继代的次数。例如, 需要保存4个月的, 直接将细胞系继代到没有激素的AA 固体培养基上, 继代3次, 即可。
| 表1 悬浮细胞团在AA培养基上多次继代的生长情况 Table 1 Growth situation of rice suspension cells on AA media in the course of subculture |
结果显示, 保存时间不同的细胞系重悬成功所需时间不同, 无论是固体培养基还是冷冻保存的细胞系, 保存的时间越长, 细胞再次进入高速分裂状态所需时间越长(表2)。在固体培养基上保存的细胞系, 重悬速度显著快于冷冻保存的细胞系。6~9个月之内固体AA培养基上的细胞团可悬浮性很好, 重新悬浮培养时没有褐化现象, 可以在一个月之内得到一个良好的细胞悬浮系。在-80℃冷冻保存的细胞悬浮系复苏、重悬时细胞团生长启动慢, 褐化、衰败的细胞多, 重悬需要50 d左右。
| 表2 不同方式保存细胞系的重悬和植株再生情况 Table 2 Resuspension and regeneration of rice suspension cells preserved in different ways |
不同保存方法、不同保存时间重悬建立起来的悬浮系的SOD和POD活性没有明显差异(图3-A~F中0 d的结果), 显示悬浮系细胞的状态相似, 没有受到冷冻、长期悬浮和固体培养基保存3种不同方式的影响。
3种保存方法的重悬细胞系在分化培养基上的POD活性规律明显。一是来自不同保存方法的细胞系在分化培养基上4 d时的POD活性都呈上升趋势,后期, 随着重悬之前保存时间和分化培养时间的延长, POD活性上升趋势越来越明显。二是来自悬浮培养的愈伤组织POD活性最高, 变化最大, 来自冷冻保存的重悬细胞系在4 d时快速累积后, 后期POD活性最低, 变化幅度最小。来自固体培养基的愈伤组织POD活性也逐渐增强, 增加幅度居于二者之间。三是随着保存时间和分化培养时间的延长, 3种保存方法重悬细胞系的POD活性差异越来越大。
分化培养基对细胞系的胁迫作用和细胞系分化能力的差异是引起POD累积和3种来源细胞系POD值差异的主要原因。因此, 6个月繁殖保存与冷冻保存细胞系的POD差别较小, 显示其对分化培养基的适应能力相近; 12个月繁殖保存细胞系的POD值明显高于冷冻保存细胞系的POD值, 说明繁殖保存细胞系的分化培养基适应能力已远不如冷冻保存细胞系; 9个月繁殖保存与冷冻保存的POD变化趋势居于6个月与12个月之间, 分化培养后期POD值差别增大。
SOD的活性4 d时上升, 之后保持了下降趋势, 随着在分化培养基上培养时间的延长, 悬浮保存与繁殖保存细胞系SOD下降趋势增强。3种保存方法相比较, 细胞团重悬之前保存时间越长, SOD活性下降幅度越大。悬浮保存细胞团下降最多, 冷冻保存的细胞团变化最小, 固体培养基保存的细胞系下降的幅度居中。SOD与POD的基本规律相似, 后期变化方向相反, 6个月冷冻保存和繁殖保存的细胞系SOD值相近, 9个月开始出现差异, 12个月差异非常明显。
保存6个月时固体培养基繁殖保存和冷冻保存的幼苗分化数量没有显著差异(表2); 9个月时, 繁殖保存和冷冻保存分化幼苗数量差异显著(未达极显著水平); 12个月时, 繁殖保存幼苗分化率急剧下降, 冷冻保存的分化率也有下降。繁殖保存9个月与冷冻保存12个月时的幼苗分化率相近。从进入分化培养基到出现1 cm左右幼苗的时间看, 冷冻保存较繁殖保存所用时间短, 从重悬到第一株再生苗出现的时间看, 6个月和9个月两个保存期都是繁殖保存较冷冻保存所用时间短。
细胞悬浮系的保存主要是降低细胞分裂速度并维持其可悬浮性。本实验采用了降低2,4-D用量的方式来降低细胞分裂速度, 用固体培养基代替悬浮培养简化了操作过程。还可以采用降低生长温度的方式来降低生长速度[23], 或二者同时并用。
AA固体培养基适于细胞悬浮系的保存, 可能原因之一是悬浮系来自AA2.0液体培养基, 细胞团已经适应了这种培养基的营养吸收过程, 再者, 从AA、MS和N6三种基本培养基的氮素营养来分析, MS的NH4+/ NO3-比例较N6高, 一般情况下还原态氮有利于细胞分裂, 但NH4+会伤害单细胞或小细胞团的质膜[24], 所以MS培养基上的细胞团生长快, 并更容易形成大的硬质颗粒来保护自己, 而AA培养基的有机营养更利于小细胞团的吸收利用, 且作用缓和, 这可能也是以氨基酸为氮源的培养基有助于降低水稻悬浮细胞褐化程度的主要原因之一[25]。
与冷冻保存、继代悬浮培养比较, AA固体培养基对细胞悬浮系的中短期保存, 避免了冷冻保存处理的繁杂操作和再悬成活率低的问题, 节省了继代悬浮的工作量。与重新诱导成熟胚建立细胞悬浮系比较, 固体培养基保存节省了3~5个月的时间和工作量。固体培养基繁殖保存的问题, 是随着细胞系繁殖代数增多, 引起遗传变异的几率增大, 因此, 适于资源创新和遗传改良工作。
超氧化物歧化酶(SOD)和过氧化氢酶(POD)是植物组织抗冻生理反应和愈伤组织分化生理反应的重要指标[26,27,28]。来自不同保存方法重悬细胞系的SOD和POD值没有明显差异, 说明重悬过程选择了具有快速分裂能力的细胞, 这些细胞进入快速分裂状态后的生理状态相近, 冷冻和冷冻保护剂DMSO的伤害作用已消失。9个月之后的冷冻保存与固体培养基保存的重悬细胞团在分化培养基上的POD、SOD活性差异增大, 与其分化活力的差异相一致。重悬细胞团接种到分化培养基前后的POD差异说明, 分裂状态相近细胞团的分化能力可能存在很大差异。
对于适应了AA2.0液体培养基中有机氮源的细胞团, 分化培养基中营养成分和激素的改变成为一种逆境。长期悬浮细胞团在不断继代过程中, 分化能力逐渐丧失, 因此在分化培养上大量累积POD, 来减轻伤害。保存12个月的细胞团在分化培养基上培养20 d时, 大量细胞褐化死亡, POD活性降低。来自冷冻保存的愈伤组织更多的细胞具有分化功能, 随着分化功能基因启动, 细胞内发生复杂的生理生化变化, 来调节、适应新的培养基成分, POD积累速度变小。固体培养基保存的愈伤组织在分化培养基上的POD活性居于二者之间。
SOD具有清除超氧阴离子自由基、保护组织免受活性氧伤害的作用。细胞团继代到分化培养基4 d时, SOD活性提高, 随着培养时间延长, 具有分化功能的细胞活化, 适应了分化环境, SOD活性恢复到继代时的状态, 不具有分化能力的细胞很快衰败, SOD活性降低。
AA固体培养基6~9个月之内保存的细胞团重悬性好, 可以在1个月之内重悬出一个良好的细胞系。AA固体培养基保存与冷冻保存相比, 保存6个月细胞系的POD、SOD活性和植株再生率没有显著差异, 保存9个月的细胞系POD、SOD活性和植株再生率出现显著(未达极显著)差异。AA固体培养基中短期保存细胞悬浮系的方法简单、实用, 是保存悬浮细胞系的理想培养基, 适于2~9个月, 尤其适于2~6个月细胞悬浮系的保存。本实验室利用固体AA培养基对日本晴和中花11悬浮系保存了8个月, 结果显示重悬和分化效果均较理想。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|



