以野生型番茄(cv. Moneymaker)和转
The effects of
高温是影响植物生长发育的一个重要因素。高温能够影响植物光合作用、增加细胞膜的通透性、抑制蛋白质的合成进而抑制植株生长[1]。番茄是保护地栽培的主要蔬菜之一, 对温度敏感, 温度过高会使其生长发育受阻。番茄植株生长发育的最适温度为昼温24~26℃, 夜温18℃左右, 30℃则过高, 到40℃就停止生长, 如果高温达到45℃时, 在短时间内茎叶就会出现日灼, 叶脉泛白, 以致坏死[2]。甜菜碱作为一种渗透调节物质, 参与植物对许多环境胁迫的响应[3]。 codA 基因是合成甜菜碱的重要基因, 可以催化胆碱直接合成甜菜碱。因此研究转 codA 基因对植物耐热性的影响, 探讨转 codA 基因番茄的耐热性机制有重要意义。有研究表明, 转 codA 基因番茄通过合成甜菜碱能够缓解低温胁迫对番茄幼苗生长发育以及开花的影响, 是因为在低温下甜菜碱能够维持一些抗氧化酶的活性, 降低细胞膜的膜脂过氧化作用, 减缓PSII最大光化学效率的降低程度[4]。Kathuria等[5]认为转 codA 基因水稻通过合成甜菜碱能够增加一些胁迫响应基因的表达来提高水稻植株的抗旱能力。另外一些研究发现甜菜碱能够缓解盐胁迫对卡尔文循环中一些酶的损伤, 从而提高转基因烟草的耐盐性[6]。Yang等[7,8]指出在高温胁迫下, 甜菜碱能够通过提高烟草的光合能力和PSII活性来增强其耐热性。Li等[9]发现在高温胁迫下外源甜菜碱能够促进番茄种子的萌发和幼苗的生长。关于高温胁迫下甜菜碱增强番茄耐热性与热响应基因表达及D1蛋白关系的研究目前仍未见报道。本文拟研究高温胁迫下, 野生型和转 codA 基因番茄叶片的净光合速率、荧光参数、MDA含量、REC、抗氧化酶活性、热响应基因和D1蛋白的变化, 探讨甜菜碱提高番茄耐热性与热胁迫基因表达和D1蛋白积累间的关系。
以自交获得的第5代野生型番茄(cv . Moneymaker)和转 codA (胆碱氧化酶)基因番茄为材料, 根据转 codA 基因番茄株系表达量的差异, 选择3个株系, 分别是CL1、CL2和CL4, 其中转 codA 基因番茄以野生型番茄(cv . Moneymaker)为受体获得。转 codA 番茄由美国俄勒冈州立大学Tony Chen实验室提供, 该基因定位于叶绿体和细胞质[10]。将番茄种子种于MS培养基中, 于25℃条件下生长15 d后移至内含蛭石的花盆(直径15 cm, 高10 cm)中, 用Hoagland营养液培养, 在昼夜温度为25/20℃、光周期为光照16 h/黑暗8 h、相对湿度为65%~70%、光强为300 μmol m-2 s-1的温室中培养。
选取生长至八叶期长势一致的番茄植株在光照培养箱中进行高温处理。将在温室生长6周后的番茄植株置不同温度(25、30、35、40、45和50℃)的光照培养箱中分别处理2 h或者于42℃的培养箱中处理0、3和6 h, 培养箱光照保持在300 μmol m-2 s-1, 湿度保持在65%~70%。从每处理选用4~6株, 选取完全展开的从上向下第3片或第4片叶子测定相关生理指标。3次重复测定, 取平均值。
1.3.1 甜菜碱含量的测定 参考Rhodes等[11]的方法提取和测定甜菜碱
1.3.2 光合速率和气孔导度的测定 采用CIRAS-2便携式光合系统(PP Systems, 英国)测定净光合速率( Pn)、气孔导度( Gs)。控制光强为800 μmol m-2 s-1, CO2 浓度为380 μL L-1, 温度为25℃, 空气相对湿度65%~70%[7]。
1.3.3 荧光参数的测定 采用便携脉冲调制式荧光仪(FMS-2, Hansatech, 英国)测定[12]。叶片暗适应30 min后测定其荧光参数, 其中, Fo为初始荧光, Fm为最大荧光, 光系统II最大光化学效率 Fv/ Fm= ( Fm- Fo)/ Fm。然后将叶片暴露在300 μmol m-2 s-1的光强下大约8 min后, 测定光适应下的稳态荧光( Fs), 然后施加8000 µmol m-2 s-1的强脉冲光, 测定光适应下的最大荧光( Fm'), 最后远红光照射3 s后测定光适应下的最小荧光( Fo')。实际光化学效率 ФPSII= ( Fm- Fo)/ Fm'。
1.3.4 过氧化氢(H2O2)含量的测定 参照 Brennan和Frenkel[13]的方法测定。
1.3.5 丙二醛(MDA)含量和相对电导率(REC)的测定
参照赵世杰等[14]的硫代巴比妥酸(TBA)比色法测定MDA含量, 参照Clarke等[15]的方法测定REC。
1.3.6 酶活性测定 称取剪碎的番茄叶片0.5 g, 加入5 mL预冷的提取液(pH 7.8磷酸缓冲液, 含 0.1 mmol L-1 EDTA, 1% PVP), 冰浴研磨, 于4℃下12 000× g 离心20 min, 上清液即为酶提取液。按Aebi[16]的方法测定过氧化氢酶(CAT)活性, 按Giannopolitis和Ries[17]的方法测定超氧化物歧化酶(SOD)活性, 按愈创木酚法[18]测定过氧化物酶(POD)活性, 按Nakano和Asada[19]的方法测定抗坏血酸过氧化物酶(APX)活性。
1.3.7 实时定量PCR分析 利用TRIzol试剂盒提取总RNA, 取1 μg总RNA进行DNase I处理, 采用cDNA第一链合成试剂盒反转录为cDNA。
将反转录所得cDNA样品稀释至0.5~2.0 ng μL-1, 作为实时定量PCR反应的模板, 参照SYBR Green Real time PCR Master Mix(QPK-201)说明书, 反应体系含2.5 μL cDNA, 9 μL SYBR Green, 0.5 μL正向/反向引物, 7.5 μL ddH2O, 反应条件和步骤为预变性95˚C 30 s, 变性95˚C 10 s, 退火59˚C 30 s, 延伸72˚C 20 s, 变性到退火过程为43个循环, 以番茄 Actin 作为内参, 基因相对表达量由Bio-Rad CFX 96实时定量PCR仪器自带软件分析, 扩增曲线及样品Ct值由软件自动生成。引物由生工生物工程(上海)有限公司合成, 引物序列见表1。
| 表1 实时定量PCR所用引物 Table 1 Primers for the real-time PCR |
1.3.8 D1蛋白的测定 按文献[20-21], 取新鲜番茄叶片1 g, 在液氮中研磨成粉末, 加预冷的提取缓冲液(50 mol L-1 Hepes, pH 7.8, 10 mol L-1 NaCl, 2 mol L-1 EDTA, 2 mol L-1 MgCl2和400 mol L-1蔗糖), 经3层纱布过滤匀浆, 用提取缓冲液冲洗类囊体颗粒后在5000× g 离心10 min, 将所得类囊体膜最后悬浮于贮存缓冲液中, 于-80℃保存备用。采用赵世杰等[22]的方法测定叶绿素含量。
D1蛋白的分离与测定: 采用SDS-PAGE(聚丙烯酰胺凝胶电泳)和Western blot(免疫印迹)法[23]。分离胶15%, 浓缩胶5%, 均含6 mol m-2 s-1尿素。上样量以叶绿素含量为准, 保证每泳道一致的叶绿素含量[24]。
在Western blot分析中, 一抗为叶绿体D1蛋白多克隆抗体, 二抗为碱性磷酶标记羊抗兔抗体IgG, 用半干法蛋白转移法转膜。
采用Microsoft Excel 2003, Sigmaplot 10.0与SPSS 13.0软件的LSD法对数据进行方差分析和差异显著性检验。
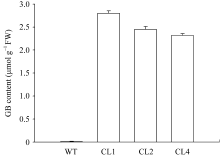
在正常条件下, 转 codA 基因番茄在叶片中积累甜菜碱。如图1所示, 野生型番茄叶片中不能检测到甜菜碱, 而不同转基因番茄株系叶片中甜菜碱含量也不
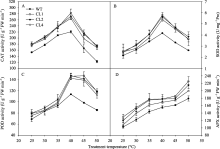
当温度低于30℃时, 野生型和转基因株系的 Pn均呈增加趋势, 当温度超过30℃时, 随处理温度提高, 番茄叶片 Pn下降, 且野生型下降的幅度明显高于转基因株系( P<0.01)。45℃处理2 h后, 野生型番茄的 Pn比25℃时降低62%, 而转基因CL1、CL2和CL4株系分别降低34%、22%和40%。50℃处理2 h后, 野生型番茄的 Pn比25℃时降低80%, 而转基因株系分别降低59%、54%和64% (图2-A)。在高温处理下, 番茄各株系 Gs均下降, 且野生型下降幅度均高于各转基因株系(图2-B)。
Fv/ Fm是暗适应下PSII的最大光化学效率, 反映了PSII反应中心最大光能转化效率[25]。当温度低于40℃时, 温度处理对番茄 Fv/ Fm没有显著影响, 而且野生型和转 codA 基因番茄的 Fv/ Fm没有显著差异。当处理温度高于40℃时, 野生型和转基因番茄叶片的 Fv/ Fm均下降, 且转基因番茄的下降幅度明显低于野生型( P<0.01)。45℃处理2 h后, 野生型番茄的 Fv/ Fm比25℃时降低22%, 而转基因CL1、CL2和CL4株系分别降低11%、10%和13%。50℃处理2 h后, 野生型番茄的 Fv/ Fm比25℃时降低96%, 而转基因株系分别降低56%、57%和58% (图2-C)。各个株系的 Fo与 Fv/ Fm呈相反的变化趋势。45℃高温胁迫2 h后, Fo均上升, 而野生型番茄叶片 Fo显著高于转基因株系( P<0.01)(图2-D)。
以上结果表明, 转 codA 基因番茄在高温胁迫下比野生型番茄能够维持较高的光合速率和PSII活性。
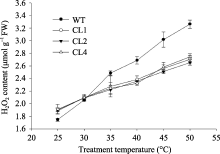
转 codA 番茄在合成甜菜碱时有副产物H2O2产生[4], 而在胁迫条件下细胞中活性氧的积累与细胞膜的氧化损伤有关[26]。图3所示, 常温下, 转基因番茄叶片中H2O2含量比野生型高8%~10%。随着处理温度的升高, 野生型和转基因番茄H2O2含量均逐渐增加, 且前者明显高于后者( P<0.01), 50℃处理2 h后, 野生型番茄叶片中H2O2含量比25℃时增加87%, 而转基因CL1、CL2和CL4株系分别增加了43%、40%和44%。同野生型番茄相比, 高温胁迫下转 codA 基因番茄叶片中H2O2积累较少。
丙二醛(MDA)含量是膜脂过氧化的一个重要指标, 相对电导率(REC)是胁迫条件下膜稳定性的重要指标, 它们均反映了胁迫对细胞膜的伤害程度。如图4所示, 在25℃条件下, 野生型和转基因番茄叶片中的MDA含量没有显著差异, 30℃以上随处理温度的升高, 番茄叶片MDA含量增加, 野生型番茄MDA含量增加幅度较转基因番茄高。50℃胁迫2 h后, 野生型番茄叶片中MDA含量增加了87%, 而各转基因CL1、CL2和CL4株系分别增加了61%、50%和52% (图4-A)。番茄叶片相对电导率的变化趋势与MDA的变化趋势相似, 当温度高于35℃时, 番茄叶片的相对电导率明显升高, 而野生型番茄叶片REC增加幅度明显高于转基因株系( P<0.01)(图4-B)。以上结果表明, 在高温胁迫下, 转 codA 基因番茄叶片膜脂过氧化程度较轻, 电解质外渗较少, 高温胁迫下膜的伤害程度较野生型轻。
在正常条件下, 转 codA 基因番茄叶片中CAT活性比野生型高16%~17%。随着处理温度的升高, 各株系CAT活性呈先上升后下降的趋势, 转基因番茄CAT活性始终显著高于野生型( P<0.01)(图5-A)。SOD和POD活性随温度升高各株系均呈先上升后下降的趋势, 当处理温度低于35℃时, 野生型和转基因株系之间SOD和POD活性无显著差异, 处理温度高于35℃时, 野生型番茄中SOD和POD活性均低于各转基因株系(图5-B~C)。番茄叶片中APX活性随温度升高呈逐渐上升的趋势, 野生型番茄APX活性低于转基因株系(图5-D)。以上结果表明, 同野生型番茄相比, 转 codA 基因番茄在高温胁迫下具有较高的抗氧化酶活性。
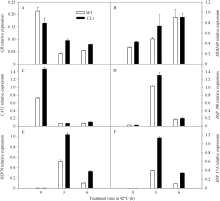
以番茄 Actin 基因为内参基因, 分别对高温胁迫下谷胱甘肽还原酶(GR)、脱氢抗坏血酸还原酶(MDHAR)、过氧化氢酶(CAT)、热激蛋白100 (HSP100)、热激蛋白70 (HSP70)以及小分子热激蛋白17.6 (HSP17.6)的基因进行实时定量PCR分析。在正常条件下, 野生型番茄叶片中 GR 的表达量高于转基因番茄叶片, 但是在42℃处理后, 转基因番茄叶片的表达量高于野生型番茄叶片(图6-A)。 MDHAR 在42℃处理3 h后, 转基因番茄叶片的表达量也明显高于野生型番茄叶片(图6-B)。 CAT1 在正常条件下, 转基因番茄的表达量比野生型明显高, 在42℃处理后, 野生型和转基因的表达量都大幅度地降低(图6-C)。 HSP100 、 HSP70 和 HSP17.6 基因在正常条件下表达量均很低, 但是在42℃处理3 h后, 野生型和转基因番茄的表达量均大幅度地增加, 在42℃处理6 h后, 野生型和转基因番茄的表达量又大幅降低, 在42℃高温处理之后, 转基因番茄的表达量始终高于野生型(图6-D~F)。这些结果表明, 在高温胁迫下, 抗氧化酶基因和热激蛋白基因在转 codA 基因番茄中的表达量高于野生型。
如图7所示, 正常条件下, 野生型和转基因番茄叶片D1蛋白含量没有显著差别, 当42℃高温处理后含量均明显降低, 但转基因叶片中含量明显高于野生型番茄( P<0.01)。
本研究结果表明, 高温胁迫导致番茄叶片净光合速率、PSII最大光化学效率降低(图2)。高温胁迫下转基因番茄叶片维持了较高的光合速率, 而较高的光合速率与较高的气孔导度有关(图2-A~B)。前人研究表明较高浓度的H2O2能够诱导气孔关闭[27,28]。甜菜碱的积累显著降低了高温胁迫下番茄叶片H2O2的积累(图3)。这可能是高温胁迫下转 codA 基因番茄维持较高气孔导度和光合速率的原因之一。另外, 前人对转基因烟草[6]和芸薹属植物[29]的研究认为, 在胁迫条件下, 甜菜碱能够通过保护光合机构增强光合能力。
 | 图7 42℃高温胁迫对野生型和转 codA 基因番茄D1蛋白含量的影响Fig. 7 Effects of 42℃ treatment on D1 content in wild type and codA transgenic tomato plants |
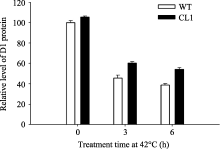 | 图8 42℃高温胁迫下野生型和转 codA 基因番茄D1蛋白的相对含量Fig. 8 Effects of 42℃ treatment on relative content of D1 protein in wild type and codA transgenic tomato plants |
高温对PSII的伤害主要包括放氧复合体和光化学反应中心的构象变化[30]。在本研究中, 高温胁迫下, Fv/ Fm的降低和 Fo的增高表明PSII反应中心受到了损伤。而转 codA 基因番茄植株中甜菜碱的积累缓解了 Fv/ Fm的降低和 Fo的增高(图2-C~D), 保护了PSII反应中心使其免受高温的伤害。Park等[4]对冷胁迫下转 codA 基因番茄的研究和Kathuria等[5]对干旱胁迫下转 codA 基因水稻的研究也得出了同样的结果; Allakhverdiev等[31]的研究证实, 在高温下转 codA 基因蓝藻的放氧复合体和光反应中心的半失活温度均有所提高。而进一步研究表明, 高温对PSII的抑制作用主要是通过干扰D1蛋白的合成而抑制PSII的修复, 而不是直接通过光损伤来损伤PSII的[32]。本研究结果表明, 高温胁迫严重抑制了D1蛋白的合成, 转 codA 基因番茄体内合成的甜菜碱有效缓解了高温胁迫对D1蛋白合成的抑制作用(图7), 减轻了高温胁迫对PSII的损伤(图2)。Allakhverdiev等[31]通过对转 codA 蓝藻的研究表明甜菜碱能够通过促进D1蛋白的合成而保护PSII反应中心。
在光合细胞的电子传递过程中会产生活性氧, 而高温对PSII的损伤主要是由活性氧的积累造成的[33]。前人研究证实, H2O2在胁迫中起着双重作用, 即浓度较低时, 作为一种信号物质, 而浓度超过一定限度时作为一种毒害物质[4]。在正常条件下, 转基因番茄比野生型积累的H2O2高出16%, 当冷处理后, 转基因番茄仍维持正常条件下的H2O2含量, 而野生型比正常条件下的H2O2含量增高了0.5倍[4]。本研究发现, 在正常条件下, 野生型番茄叶片中H2O2含量比转基因番茄低8%~10%, 高温胁迫之后, 野生型番茄叶片中H2O2含量明显高于转基因番茄(图3)。这是由于正常条件下转基因番茄产生甜菜碱的过程中有副产物H2O2产生, 而在高温胁迫下, 体内甜菜碱能够减轻活性氧的积累。
甜菜碱可通过提高抗氧化酶的活性清除ROS[8]。CAT是通过将H2O2分解为H2O和O2而直接清除H2O2的酶, 在正常条件下, CAT酶的活性在转基因番茄叶片中始终高于野生型, 可能是转基因番茄叶片中较高的H2O2含量诱导所致[10]。高温胁迫下, CAT、SOD、POD和APX的活性在转基因番茄叶片中均高于野生型(图5)。在强光胁迫下, 转 codA 基因拟南芥的CAT、APX和GR的活性均明显高于野生型[34]。研究表明在高温胁迫下, 转基因番茄体内甜菜碱的积累提高了抗氧化酶的活性, 从而减少了活性氧的积累。
Kathuria等[5]对转 codA 基因水稻转录组分析发现, 与野生型相比, 转基因水稻中有165个基因上调表达, 这些基因与胁迫响应、跨膜转运、激素信号、植物生长发育以及细胞代谢等过程有关。Park等[35]通过cDNA芯片技术也证明, 与野生型相比, 转 codA 基因番茄花芽中30个基因的表达增强, 这些基因的表达与细胞分裂有关。本研究结果表明, 在高温胁迫下, 转 codA 基因番茄叶片的 CAT1 、 GR 、 MDHAR 、 HSP100 、 HSP70 和 HSP17.6 基因的表达均高于野生型(图6)。Li等[9]在转 codA 基因番茄种子中研究发现, 热激蛋白的转录水平和HSP70的积累量均高于野生型种子, 推测甜菜碱可能通过某种机制上调抗氧化酶基因和热激蛋白等基因的表达以提高耐热性。
胆碱在胆碱氧化酶的作用下合成甜菜碱和副产物H2O2, 因此, 转基因番茄叶片中H2O2的含量高于野生型(图3), 有研究表明, 低浓度的H2O2可以通过诱导抗氧化酶基因 CAT 的表达来对氧化胁迫起到保护作用[36]。本实验也表明, 转基因番茄叶片中较高的H2O2诱导了正常条件下较高的CAT活性(图5-A), 而且, 在正常条件下, 转基因番茄叶片中 CAT1 基因的表达量也明显高于野生型番茄(图6-C)。低浓度的H2O2可作为信号分子激活一系列抗氧化保护机制[37,38]。推测在转 codA 番茄叶片中, H2O2与甜菜碱共同增强番茄的抗热性, 但对于H2O2在热胁迫条件下增强抗热性的机制还有待更深入研究。
转 codA 基因缓解了高温胁迫对番茄叶片气孔导度的影响, 维持了较高的光合速率。较高气孔导度的维持与转 codA 基因能够抑制高温胁迫下番茄体内活性氧的产生有关; 转 codA 基因提高了高温胁迫下抗氧化酶活性, 降低了膜脂过氧化程度, 维持了膜的稳定性, 促进了D1蛋白的修复循环, 减轻了活性氧对PSII的损伤, 提高了PSII的耐热性; 高温胁迫下, 转 codA 基因番茄提高了抗氧化酶基因和热胁迫基因的表达以应对高温胁迫。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|