以3个荚果和子仁生长发育正常的花生栽培品种(系)和种子皱缩变异品系05D677为材料, 测定其荚果和子仁生长发育过程中激素含量与干物质积累变化特征, 分析其内源激素含量变化与干物质积累关系, 探讨变异品系05D677中内源激素含量变化对荚果和子仁生长发育的影响。主要结果如下: (1)果针入土24~60 d是荚果和子仁干物质快速积累期, 期间山花15、05D610和白沙1016荚果干物质积累速率(PKW)平均值与子仁干物质积累速率(KKW)平均值均极显著大于05D677; 3个正常品种(系)PKW和KKW最大值均出现在果针入土30 d, 05D677出现在果针入土36 d。(2)4个品种(系)幼果或子仁内细胞分裂素(Z+ZR)、赤霉素(GA)、生长素(IAA)、脱落酸(ABA)含量变化趋势基本相同, 其中05D677的GA含量峰值出现时间比3个正常品种(系)晚6 d; 05D677的Z+ZR、GA、ABA含量最高值均极显著低于3个正常品种(系), 其IAA含量最高值极显著高于3个正常品种(系)。(3)荚果膨大中后期,PKW和KKW与Z+ZR、GA、ABA含量呈极显著正相关, 与IAA呈极显著负相关; 荚果充实初期, Z+ZR含量与PKW和KKW呈极显著正相关; GA含量在荚果充实后期和成熟期与PKW呈极显著正相关; ABA含量在荚果充实后期与PKW和KKW均呈极显著负相关, 在成熟期与PKW呈极显著正相关。(4)与3个荚果和子仁发育正常的品种(系)相比较, 05D677幼果迅速膨大期和子仁充实初期的IAA含量明显升高, 且Z+ZR、GA和ABA含量不足可能引起内源激素比例失衡, 影响荚果和子仁的生长, 致使荚果和子仁发育进程延迟、干物质积累速率的极显著降低, 表现为收获时荚果充实度差, 种子皱缩。
Endogenous hormones play important roles in plant growth and development, and yield formation. To reveal the relationship between dry matter accumulation and hormones content in developing pods and kernels, we conducted an experiment using three peanut varieties (lines) with normal seeds and one wrinkled mutant line 05D677. The main results were as follows: (1) The period of 24-60 days after peg penetration was a rapid dry weight accumulation phase, during which the average of both pod dry matter accumulation rate (PKW) and the corresponding kernel dry matter accumulation rate (KKW) of Shanhua 15, 05D610 and Baisha 1016 was significantly higher than that of 05D677; thePKW andKKW of the three normal varieties peaked at 30 days, different from those of 05D677 at 36 days. (2) The four varieties shared much the same dynamic changes trends of cytokinin (Z+ZR), gibberellin (GA), auxin (IAA) and abscisic acid (ABA) in the young pods or kernels. However, GA content of 05D677 peaked six days later than those of other three normal varieties (lines); the peak values of Z+ZR, GA and ABA contents of 05D677 were all very significantly lower than those of other three, while the opposite result was discovered as to IAA content. (3) In the middle and late periods of pod expansion, Z+ZR, GA and ABA contents were in very significantly positive correlation withPKW andKKW, while the opposite for IAA content. Z+ZR content had very significantly positive correlation withPKW andKKW in the early pod filling period, and the same result was found between GA content andPKW in the late filling and mature period. ABA content had very significantly negative correlation withPKW andKKW in the late pod filling, while had a very significantly positive correlation withPKW in the mature period. (4) Compared with other three normal varieties (lines), IAA content of 05D677 was significantly increased in the early pod and kernel expansion period accompanied by insufficient Z+ZR, GA and ABA contents, and the proportion imbalances of endogenous hormones possibly led to development process delay and significantly reduced dry matter accumulation rate of pods and kernels, which may be the reason for plumpness shortage and shrink seeds of 05D677.
植物内源激素作为信息传递物质, 通过促进、抑制或改变生理过程等功能对植物生长发育发挥调控作用[1]。不同发育时期内源激素含量的变化特征是决定作物种子产量和品质的关键因素之一。细胞分裂素(CTK)是一种促进型植物激素, 促进细胞分裂和延缓植株衰老, 对胚胎和种子发育起关键调控作用[2-4]。关于CTK对禾本科作物籽粒灌浆的调控作用, 存在两种观点, 一种认为整个灌浆期籽粒CTK含量的高低决定了粒重的大小[5-6]; 另一种则认为, CTK对粒重的决定作用, 主要在开花受精后的胚乳细胞增殖期[7]。在大豆种子的生长发育中, 高含量的CTK不仅能够促进幼荚前期细胞的迅速分裂, 同时还吸引大量同化物向幼荚转运[8]。生长素(IAA)也属于促进型植物激素, 最基本的生理作用是促进生长, 但是与IAA的浓度、植物的种类与器官、细胞的年龄等因素有关。IAA浓度较低时可促进生长, 较高浓度时则抑制生长。李文阳等[9]研究表明, 小粒型小麦的IAA含量高于大粒型小麦, 认为较高含量的IAA对最终籽粒重的形成不利。赤霉素(GA)突出的生理作用是促进茎的伸长, 引起植株快速生长, 并能延缓籽粒衰老, 延长灌浆时间, 有利于胚乳细胞的发育, 从而促进籽粒灌浆充实。脱落酸(ABA)对作物籽粒的发育充实起正调控作用, 可以促进碳水化合物向库的运输, 控制籽粒成熟, 加快籽粒灌浆[10]。Lee等[11]研究认为ABA既可以促进同化物向籽粒运转, 又可加速成熟, 与灌浆前、中期ABA含量不同, 后期ABA含量促进籽粒成熟和衰老。Kato等[12]观察到, 在水稻籽粒灌浆过程中, 大籽粒比小籽粒ABA含量高。Acketson[13]研究认为ABA通过调节ATP酶的活性, 减少H+穿过膜的运转动力, 增加H+蔗糖共运输, 进而促进同化物向籽粒的运输。张上隆等[14]的研究表明, ABA通过调节库中酸性转化酶的活性促进蔗糖分解为葡萄糖和果糖, 从而促进库对蔗糖的吸收和卸载。另外, ABA还能够促进有机物韧皮部卸载并和GA一起共同调控籽粒灌浆。在水稻[15]、小麦[1]等作物的籽粒中ABA和GA含量变化对籽粒灌浆起着“开关”作用, 在灌浆初期适当提高籽粒中ABA含量和ABA/GA比值, 有促进籽粒灌浆的作用。植物在生长发育过程中引起生理变化的某一个反应往往是激素间协同作用的结果, 而不是某一种激素单独作用的结果[16-17]。
花生收获期种子的饱满程度直接关系到其产量和品质。选育成熟饱满度高的优良品种和研发促进荚果和子仁生长的栽培技术是提高花生产量和品质的关键途径。前人的研究主要是分析单一品种子仁发育不同时期内源激素的变化及其对种子活力的影响[18-20]。关于不同品种间激素含量是否存在差异以及激素含量的变化与荚果和子仁生长量关系的研究未见报导。本研究对比花生荚果和子仁生长发育过程中4种内源激素(CTK、IAA、GA、ABA)的含量变化及干物质积累特征, 旨在探讨期间的关系及皱缩变异体05D677种子皱缩的原因, 以期揭示内源激素决定花生荚果大小、种子饱满度的生理机制, 为花生高产品种选育和栽培技术研究提供参考。
山花15为荚果普通型的特大果花生品种, 是由品系98H101 (A596×海花1号)与98H269 (来宾大豆×7709-22)杂交后经系谱法选育而成, 于2012年通过山东省审定, 审定编号为鲁农审2012028号。白沙1016为荚果茧型的小果品种, 是1963年由广东省澄海县白沙农场以伏花生为母本, 以狮头企为父本杂交育成。05D610为荚果普通型的大果品系, 05D677是05D610的变异系[21](表1)。4份材料均由山东农业大学花生研究所提供。
| 表1 试验材料的部分特征 Table 1 Some characteristics of the materials |
2011—2012年在山东农业大学农学实验站起垄覆膜种植, 畦宽90 cm, 墩距17 cm。每个材料设置3个重复, 每个重复种植160墩, 每墩2株。
参照崔光军等[21]的方法标记果针和取样。标记果针入土第6天取样, 每6 d取样一次, 白沙1016生育期短, 取样11次, 另外3个品种(系)取样12次。每个重复每次取30个标记果针形成的发育均匀一致的荚果, 洗净, 用吸水纸擦干, 其中20个荚果用于测定荚果鲜重、子仁鲜重、荚果干重与子仁干重, 另10个(第1~3次取样的荚果和第4次及后期取样剥取的子仁)经液氮速冻, -80℃保存, 用于内源激素含量的测定。
取10个荚果称量鲜重, 荚果剥去果壳后称量子仁鲜重。将荚果和子仁烘干称量, 并计算单果重和单仁重。干物质积累速率 KW(g d-1)=( Mn+1- Mn )/( Tn+1- Tn ), 公式中( Mn+1 -Mn )为连续2次取样干重增加重量, ( Tn+1 -Tn )为连续2次取样间隔天数[21]。荚果和子仁干物质积累速率分别表示为PKW和KKW。
参照杨卫兵的方法[1], 采用高效液相色谱测定内源激素吲哚乙酸(IAA)、细胞分裂素(Z+ZR)、赤霉素(GA)与脱落酸(ABA)的含量。色谱柱为Symmetry C18 (150.0 mm×4.6 mm, 5 μm), 流动相为甲醇∶水(5‰冰醋酸)=45∶55, 流速为0.9 mL min-1, 柱温为25℃, 进样量为15 μL, 紫外检测波长为254 nm。
使用Microsoft Excel 2003处理数据, SigmaPlot 10.0作图, DPS软件检验数据的差异显著性, SPSS 17.0软件进行相关性分析。
2.1.1 荚果鲜重变化特征分析 在果针入土6~72 d期间, 4个花生品种(系)荚果鲜重变化趋势基本一致(表2)。果针入土0~24 d内, 荚果鲜重缓慢增加, 增幅较小。24 d后快速增长, 果针入土30 d达到最大值, 此后时期基本不变。以2011年荚果鲜重为例, 山花15、白沙1016、05D610荚果鲜重最大值分别是5.369、3.020和4.238 g, 05D677 (2.598 g)极显著小于3个正常品种(系)。2012年荚果鲜重大小及变化趋势与2011年结果基本一致, 差异不显著。
2.1.2 荚果干重变化特征分析 在果针入土6~72 d期间, 3个荚果和子仁生长发育正常的花生品种(系)荚果干重增长趋势基本一致, 种子皱缩品系05D677荚果干重增长速度明显低于上述品种(系)(图1)。果针入土0~24 d时期内4种花生荚果干重增加缓慢, 且四者差异不大。自果针入土后24~60 d内, 山花15、白沙1016与05D610的荚果干重迅速增加, 而后至成熟时荚果干重变化不大, 05D677荚果干重增加缓慢。以2011年结果(图1-A)为例, 成熟期, 4个品种(系)间单果干重差异极显著, 05D677单果干重为0.962 g, 是山花15的37.9%, 白沙1016的61.3%, 05D610的46.2%; 小果品种白沙1016的单果干重为特大果品种山花15、大果品系05D610的61.9%、75.3%。
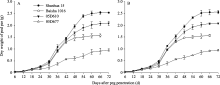 | 图1 花生荚果干重的动态变化A: 2011年数据; B: 2012年数据。A: data in 2011; B: data in 2012.Fig. 1 Dynamic changes of pod dry weight in peanut |
| 表1 花生荚果鲜重动态变化 Table 2 Dynamic changes of pod fresh weight in peanut |
分析不同品种(系)间荚果的干物质积累速率(图2)表明, 果针入土后24~60 d是荚果干重的快速积累时期, 果针入土0~24 d和果针入土60~72 d则是荚果干重的缓慢积累时期。山花15、白沙1016、05D610的荚果干物质积累速率(PKW)都是在果针入土24 d开始迅速增加, 30 d最大, 然后降低, 呈现“中间快、两头慢”的模式。05D677的PKW则是果针入土24 d开始增加, 36 d最大, 然后迅速降低再增加, 在果针入土54 d达到顶点, 呈现“M型”的模式。
比较2011年4个品种(系)的PKW(图2-A), 05D677的最大值出现在果针入土36 d, 为33.0 mg d-1, 山花15、白沙1016、05D610等3个品种(系)的最大值出现在第30 天; 3个品种(系)间最大值差异不显著, 均极显著高于05D677, 分别是05D677的3.02、2.64和2.55倍。在荚果整个生长发育期内, 山花15、白沙1016、05D610和05D677的PKW的平均值分别是37.7、25.7、28.3和13.3 mg d-1, 前3个品种(系)间差异显著, 前3个品种(系)极显著高于05D677, 分别是05D677的2.83、1.93和2.13倍。在荚果干物质的快速积累时期即果针入土24~60 d内, 山花15、白沙1016、05D610和05D677的PKW的平均值分别是53.7、31.9、43.3和18.1 mg d-1, 前3个品种(系)间差异极显著, 前3个品种(系)极显著高于05D677, 分别是05D677的2.97、1.76和2.39倍。
2.1.3 子仁的生长动态 子仁干重的增长趋势与荚果干重的增长趋势基本一致, 在果针入土6~18 d内, 子仁生长量很小, 果针入土24~60 d期间子仁干重迅速增加, 60~72 d生长缓慢(图3)。与荚果干物质积累速率的变化趋势一样, 山花15、白沙1016、05D610的子仁干物质积累速率(KKW)也呈“中间快、两头慢”的趋势, 05D677的则呈“M型”趋势(图4)。
 | 图3 花生子仁干重的动态变化A: 2011年数据; B: 2012年数据。Fig. 3 Dynamic changes of dry matter accumulation rate in peanut podA: data in 2011; B: data in 2012. |
以2011年子仁生长动态为例, 在子仁生长发育期内, 山花15、白沙1016、05D610、05D677的KKW平均值分别是16.9、12.8、13.9和6.4 mg d-1, 前3个品种(系)KKW平均值分别是05D677的2.64、2.00和2.17倍。山花15、白沙1016、05D610 的KKW最大值出现在果针入土30 d, 分别为34.7、32.8和34.3 mg d-1, 05D677的KKW最大值出现在果针入土36 d, 为14.2 mg d-1。山花15、白沙1016、05D610的KKW最大值分别是05D677的2.44倍、2.31倍和2.42倍(图4-A)。在子仁干物质快速增长期(果针入土24~60 d)内, 山花15、白沙1016、05D610、05D677KKW的平均值分别为20.9、14.3、17.5和7.8 mg d-1, 前3个品种(系)间差异极显著, 前3个品种(系)极显著高于05D677, 分别是05D677的2.68、1.83和2.24倍。根据Daynard等[22]的计算山花15、白沙1016、05D610和05D677的有效灌浆期分别为43.7、43.1、43.0和43.9 d, 差异不显著。
果针入土6~18 d期间4个品种(系)幼果内激素含量的变化、果针入土24~66 d期间早熟品种白沙1016子仁中激素含量的变化、以及果针入土24~72 d期间山花15、05D610和05D677等4个品种(系)子仁中激素含量的变化(图5), 两年趋势基本一致, 文中重点描述2011年的结果。
2.2.1 细胞分裂素(Z+ZR)含量的变化 在果针入土6~18 d期间, 山花15、05D610、白沙1016和05D677幼果内细胞分裂素(Z+ZR)含量逐渐升高, 前3个品种(系) Z+ZR含量极显著高于05D677。4个品种(系)子仁Z+ZR含量的最高值均是在果针入土24 d, 该时期品种(系)间Z+ZR含量的差异最大, 山花15、白沙1016、05D610、05D677的Z+ZR含量比例为1.84∶1.71∶2.05∶1.00, 前三者的Z+ZR含量极显著大于05D677, 3个正常品种(系)间Z+ZR含量差异显著, 小果品种白沙1016最小(图5-A)。
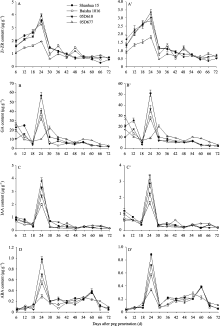 | 图5 花生荚果和子仁内源激素含量变化A、B、C、D为2011年数据; A’、B’、C’、D’为2012年数据。Fig. 5 A, B, C, D: the data in 2011; A’, B’, C’, D’: the data in 2012.Dynamic changes of endogenous hormones of pods and kernels in peanut |
2.2.2 GA含量的变化 分析果针入土6~18 d期间幼果的GA含量差异(图5-B)表明, 4个品种(系)幼果GA含量的最低值均在果针入土18 d; 大花生品种(系)山花15和05D610的变化趋势一致, 山花15在果针入土6 d、12 d的含量极显著高于05D610, 小花生品种白沙1016和种子皱缩品系05D677的变化趋势一致, 白沙1016在果针入土6 d、12 d的含量极显著高于05D677。荚果和子仁生长发育正常的3个品种(系)子仁GA含量的最高值均在果针入土24 d, 该时期山花15子仁GA含量极显著高于05D610和白沙1016; 05D677子仁GA含量的最高值在果针入土30 d, 05D677的GA最大含量极显著低于其他3个品种的最高值; 在果针入土30 d之后, 05D677子仁的GA含量一直高于其他3个品种(系)。
2.2.3 IAA含量的变化 在荚果和子仁全生育期内, 4个品种(品系)的幼果或子仁IAA含量的变化趋势基本一致, IAA含量最大值出现在果针入土24 d, 该时期IAA含量的大小顺序依次是05D677、山花15、05D610、白沙1016, 4个品种(系)间差异达极显著水平(图5-C)。
2.2.4 ABA含量的变化 在荚果和子仁全生育期内, 山花15、白沙1016和05D610幼果或子仁中ABA含量的变化趋势基本一致, 均在果针入土24 d和60 d出现2个峰, 24 d时ABA含量从大到小依次为山花15、05D610、白沙1016, 60 d时3个品种(系)间ABA含量无显著差异; 05D677的幼果或子仁中ABA含量变化趋势与其他3个品种(系)存在差异, ABA含量变化的第一个峰也出现在24 d, 其含量极显著低于其他3个品种(系), 仅为山花15的30.0%、白沙1016的53.8%、05D610的42.4%, 其ABA含量变化的第2个峰持续时间较长, 在果针入土36~ 72 d, 峰值出现在54 d, 且峰值ABA含量比其他3个品种(系)的低(图5-D)。
各内源激素含量与荚果和子仁干物质积累速率之间的相关性因不同阶段而异(表3)。
2.3.1 细胞分裂素(Z+ZR)含量与干物质积累速率的相关性 在果针入土18~42 d, 对应荚果迅速膨大期和子仁充实早期, Z+ZR含量与荚果和子仁干物质积累速率呈显著或极显著正相关; 在果针入土
42~66 d, 对应荚果和子仁充实中后期, Z+ZR含量与荚果和子仁干物质积累速率呈负相关。
2.3.2 GA含量与干物质积累速率的相关性 在果针入土12~30 d, 对应荚果迅速膨大期, GA含量与荚果和子仁干物质积累速率呈显著或极显著正相关; 在果针入土30~54 d, 对应荚果和子仁充实早期和中期, GA含量与荚果和子仁干物质积累速率呈负相关; 在果针入土54~72 d, 对应荚果和子仁充实后期, GA含量与荚果和子仁干物质积累速率呈正相关。
2.3.3 IAA含量与干物质积累速率的相关性 在果针入土18~24 d, 对应荚果迅速膨大期, IAA含量与荚果干物质积累速率呈极显著负相关; 在果针入土30~36 d, 对应子仁充实早期, IAA含量与子仁干物质积累速率呈显著正相关。
2.3.4 ABA含量与干物质积累速率的相关性 在果针入土18~30 d, 对应荚果迅速膨大期, ABA含量与荚果和子仁干物质积累速率呈极显著正相关; 在果针入土54~60 d, 对应荚果和子仁充实后期, ABA含量与荚果和子仁干物质积累速率呈极显著负相关。在果针入土66~72 d, 对应荚果成熟期, ABA含量与荚果干物质积累速率呈极显著正相关。
| 表3 荚果和子仁激素含量与干物质积累速率的相关系数 Table 3 Correlation coefficients between hormones levels and dry matter accumulation rates of pods and kernels (d) |
本试验发现, 荚果发育可分为2个阶段。第一阶段是果针入土后30 d左右。此段时间内荚果鲜重迅速增至最大, 但其荚果干重却依然较小, 这一阶段主要是荚果体积急剧增加至最大, 以果壳增长为主, 子仁已开始形成, 但是经济价值极小。第二阶段则是果针入土30 d至成熟。这时荚果鲜重基本不变, 主要表现为子仁充实, 荚果体积不再增大, 荚果干重尤其是子仁干重迅速增加。这与禹山林等[23]根据花生荚果外部形态的变化, 将荚果发育过程分为荚果膨大阶段和荚果充实阶段的结论是一致的。
张晓龙[24]研究表明, 小麦粒重受籽粒充实速率和充实持续期的制约。李世清等[25]认为在相同地区粒重的差异主要与灌浆速率的差别密切相关, 而在不同地区粒重的差异除与灌浆速率有关外, 还与灌浆持续时间的长短有关。本试验中, 在子仁快速发育时期即果针入土24~60 d内, 05D677的子仁干物质积累速率平均值远低于山花15、白沙1016和05D610, 差异极显著; 3个荚果和子仁发育正常品种(系)间干物质积累速率差异极显著, 小果品种白沙1016的子仁干物质积累速率平均值最小; 但四者的有效灌浆期却相差不大, 差异不显著。这符合李世清“在相同地区不同基因型间粒重的差异主要与籽粒充实速率有关”的说法。一般认为, 灌浆速率越大, 越有利于籽粒内干物质的积累, 该状态下籽粒的饱满程度越高; 相反, 会造成籽粒皱缩, 饱满程度下降[26,27]。本试验中, 在子仁整个生长发育期内, 皱缩变异品系05D677的子仁干物质积累速率的平均值极显著小于3个正常品种(系)的平均值。因此, 05D677子仁干物质积累速率的降低应当是其种子皱缩、饱满度下降的主要原因。
在荚果和子仁生长发育过程中, 其内源激素含量在变化。在果针入土6~18 d, 对应荚果迅速膨大前期阶段, 幼果内Z+ZR含量初始值较高, 且随着荚果膨大阶段的进行不断升高; GA与IAA含量有所下降; ABA含量变化不大, 处于较低水平。本试验发现, 只有GA在果针入土12~18 d与荚果干物质积累速率成极显著正相关, 其他3种激素与积累速率的相关性均未达显著水平。表明GA在荚果迅速膨大初期对荚果干物质积累起明显的促进作用。
4个品种(系)间内源激素差异较大的时期出现在果针入土18~30 d, 对应荚果迅速膨大后期, 4个品种(系)的激素含量均出现峰值, 除IAA峰值是05D677极显著大于3个正常品种(系)外, Z+ZR、GA与ABA峰值均是05D677极显著小于3个正常品种(系); 该时期小果品种白沙1016的Z+ZR、GA、IAA与ABA峰值均显著小于2个大果品种(系)。相关性分析表明, 在果针入土18~30 d, 对应荚果迅速膨大后期, Z+ZR含量、GA含量、ABA含量与荚果或子仁干物质积累速率呈显著或极显著正相关, IAA含量与荚果干物质积累速率呈极显著负相关。前人对小麦[28,29]、大豆[8]、水稻[6]等作物的研究中发现细胞分裂素控制着种子发育前期的细胞分裂, 调节着种子的早期发育并决定种子的最终体积。种子中ABA和GA含量变化对种子发育起着“开关”的作用[1,15]。提高种子发育初期ABA和Z+ZR含量有利于提高种子干物质积累速率, 是促进种子发育、提高种子充实度一个有效途径。本试验中, 在花生荚果迅速膨大阶段(果针入土6~30 d), GA对荚果的干物质积累最早起促进作用, 并在荚果膨大中后期(果针入土18~30 d)与Z+ZR和ABA共同对荚果和子仁干物质积累起正调控作用。种子皱缩品系05D677与小果品种白沙1016此时Z+ZR、GA和ABA含量显著小于特大果品种山花15和大果品系05D610, 不利于其荚果的膨大。
刘霞等[30]在对小麦的研究中发现各内源激素与小麦籽粒的平均灌浆速率之间的相关性具有明显的阶段特异性。本试验中, 在荚果充实阶段初期(果针入土30~42 d), Z+ZR含量与荚果和子仁干物质积累速率均呈极显著正相关, GA含量与干物质积累速率呈显著或极显著负相关, IAA和ABA含量与其相关性未达显著水平。在荚果充实后期(果针入土54~60 d), GA含量与荚果和子仁干物质积累速率呈极显著或显著正相关, ABA含量与荚果和子仁干物质积累速率均呈极显著负相关。在果针入土66~72 d, 对应荚果成熟期, GA与ABA含量与荚果干物质积累速率均呈极显著正相关。表明, Z+ZR主要在荚果充实初期对干物质积累起促进作用, GA对干物质积累的促进时期在荚果充实后期和成熟期, ABA的作用则在荚果成熟期, 在荚果充实后期ABA抑制荚果的发育。在荚果的充实阶段, IAA含量与荚果和子仁的干物质积累速率的相关性未达显著水平, 对荚果的发育充实作用不大。
花生荚果和子仁的生长发育与其内源激素含量有密切关系。各内源激素含量与荚果和子仁干物质积累速率之间的相关性因不同阶段而异。Z+ZR主要在荚果膨大阶段和充实初期对荚果干物质积累起促进作用, GA在荚果膨大阶段最早对荚果发育起正调控作用, 并在荚果充实后期和成熟期也对其起促进作用, ABA则在荚果膨大阶段和成熟期起促进作用, IAA在荚果膨大阶段对荚果的发育起负调控作用。与荚果和种子发育正常的3个品种(系)相比较, 05D677幼果迅速膨大期和子仁充实初期的IAA含量明显升高, 且ABA、Z+ZR和GA含量不足可能引起内源激素比例失衡, 影响了荚果和子仁的生长, 致使荚果和种子发育进程延迟、干物质积累速率的极显著降低, 表现为收获时荚果充实度差, 种子皱缩。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|




