* 通讯作者(Corresponding author): 陈明, E-mail:chenming02@caas.cn, Tel: 13683360891
第一作者联系方式: E-mail:mdh2493@126.com, Tel: 13609123593 **同等贡献(Contributed equally to this work)
PP2Cs (2C type protein phosphatases)是一种单体丝氨酸/苏氨酸蛋白磷酸酶, 在真核生物中, PP2Cs在脱落酸(ABA)、茉莉酸(JA)、水杨酸(SA)等激素信号传导途径中起着重要的调控作用。本研究通过序列比对, 从谷子基因组中筛选出80个
PP2Cs are a group of monomeric serine/threonine protein phosphatases, which play an important role in regulation of hormone signaling pathways such as abscisic acid (ABA), jasmonic acid (JA) and salicylic acid (SA) in eukaryotes. In this study, we identified 80 candidate
蛋白磷酸酶和蛋白激酶介导的蛋白质可逆磷酸化在植物逆境信号传递过程中发挥重要作用[ 1]。PP2C类蛋白是一种依赖Mg2+或Mn2+的单体丝氨酸/苏氨酸蛋白磷酸酶[ 1, 2]。与其他类型的蛋白磷酸酶相比, 植物中PP2C类蛋白数量最为丰富, 在PP2C类蛋白的N-或C-末端含有一个保守的催化结构域, 另一端含有一个复杂多变的区域, 其结构的多样性表明PP2C类蛋白在信号传导机制中具有不同的功能, 其表达模式及细胞定位特性也各不相同[ 3, 4, 5]。在真核生物中PP2C类蛋白参与ABA、JA、SA等多种信号传导途径[ 3, 6, 7, 8, 9]。在拟南芥中ABI1、ABI2、AHG1、AHG3/AtPP2CA、HAB1及HAB2等PP2C类蛋白属于A亚族, 对ABA信号起负调控作用[10-14][ 7]。山毛榉中FsPP2C1、FsPP2C2对ABA信号途径起正调控作用, 在拟南芥中过表达 PP2C基因可增强转基因植株对非生物胁迫的抗性[ 15, 16]。Liu等[ 17]在拟南芥中过表达玉米基因 ZmPP2C后发现, 转基因植株对干旱和盐的耐受能力以及对ABA的敏感性降低。Liu等[ 18]报道了一个拟南芥基因 AtPP2CG1, 该基因编码的蛋白属于PP2C家族的G亚族, 能够调控拟南芥对盐胁迫的响应, 且其调控依赖于ABA。Jia等[ 19]的研究表明, FaABI1对草莓的成熟起负调控作用。
系统研究 PP2C基因家族在各种逆境胁迫下的表达将有助于揭示植物逆境响应的分子机制。Xue等[ 20]从拟南芥基因组中鉴定出80个 PP2C候选基因, 并根据进化关系将其分为13个亚族(A-J, 其中E亚族分为Ea、Eb两个亚族, F亚族分为F1、F2两个亚族), 其中, A亚族的9个成员中包含上述6个负调ABA信号的蛋白, 另外3个成员HAI1、HAI2/AIP1、HAI3对胁迫的响应与该亚族其他6个成员不同[ 21]; B亚族调控MAPK途径; C亚族与花器发育相关。对水稻PP2C家族表达模式的分析表明, A亚族成员能够不同程度响应ABA、高盐、低温等逆境胁迫[ 20]。
谷子( Setaria italica)耐逆性强、适应性广、基因组小、遗传多样性丰富[ 22, 23], 是克隆抗逆基因, 研究植物抗逆分子机制的理想材料。2012年, 谷子基因组序列公布[ 24, 25], 加快了谷子功能基因组研究的步伐。然而, 目前关于谷子抗逆基因的研究还较少, 特别是关于抗逆相关的重要基因家族的研究少见报道。本研究的系统进化树分析证明谷子的 PP2C基因家族同样被分为12个亚族, 其中, A亚族包括10个成员。表达特性分析证明A亚族中 SiPP2CA6、 SiPP2CA8在5种胁迫处理条件下诱导表达量都较高, 且 SiPP2CA8在低氮胁迫下一直处于较高的表达水平。谷子中 PP2C基因家族的系统分析为克隆抗逆基因, 研究谷子的抗逆分子机制创造了条件。
谷子种子由中国农业科学院作物科学研究所刁现民研究员课题组提供, 拟南芥Col-0种子、GFP载体、pSPYCE-35S及pSPYNE-35S载体由本实验室保存。在温室中培养谷子和拟南芥幼苗, 培养温度为22℃, 湿度为65%, 光照周期为16 h/8 h。
将谷子培养10 d后, 取长势一致的植株, 用100 μmol L-1 ABA、20% PEG、150 mmol L-1 NaCl、4℃低温、0.05 mmol L-1总氮处理(LN), 低氮表达谱分析取样时间点为处理后0、1、4、12、24和48 h。其他处理取样分别在处理后0 h和4 h, 样品用液氮迅速冷冻保存于-80℃冰箱备用。
以Pfam数据库中拟南芥和水稻的典型PP2C结构域为递交序列, 在Phytozome数据库中进行BlastP比对, 搜索具有完整阅读框的谷子同源序列, 获得谷子所有的 PP2C基因。基因和蛋白序列来源于Phytozome数据库。利用软件MEGA5.1采用相邻法构建系统发育树; 用fancyGENE、MEME (Multiple Em for Motif Elicitation)在线工具分别进行基因结构作图和蛋白序列分析; 以起始密码子上游1500 bp的序列为启动子序列, 用PLACE在线软件分析。
用植物总RNA提取试剂盒(天根生化科技有限公司)提取植株总RNA, 用TaKaRa公司和Invitrogen的反转录试剂盒合成cDNA第一链。
以谷子 SiACTIN (Si001873m.g)为内参基因, 检测各基因在不同处理下的相对表达量。各基因的引物序列见表1。扩增循环参数为94℃预变性5 min; 94℃ 15 s, 58℃ 20 s, 72℃ 31 s, 40个循环。
| 表1 谷子 PP2C基因实时荧光定量PCR所用引物 Table 1 Primers of PP2C genes in foxtail millet used for Real-time PCR |
分别构建GFP-SiPP2CA8和GFP-SiRCAR3载体进行亚细胞定位分析, 构建pSPYCE-SiPP2CA8和pSPYNE-SiRCAR3载体进行蛋白质互作分析。以生长3周的拟南芥叶片为材料制备原生质体, 原生质体制备及转化过程参考Yoo等[ 26]的方法。
通过序列比对和分析, 从谷子中筛选出104个具有完整阅读框的PP2C蛋白序列, 由80个基因编码。对80个谷子PP2C蛋白的氨基酸序列进行聚类分析, 参考前人研究结果命名各亚族[ 3, 20](图1-A)。谷子PP2C家族中的74个成员可被分为12个亚族(A、B、C、D、E1、E2、F1、F2、G、H、I、J), 其中C和D、E1和E2、F1和F2的Bootstrap在85%以上, 其余6个基因( Si000606m.g、 Si001589m.g、 Si020423m.g、 Si029313m.g、 Si030278m.g和 Si025857m.g)为独立的分枝。12个亚族中共有50个基因形成25个同源基因对(Bootstrap大于85%), 其中19对的Bootstrap为100%。
基因结构分析显示, 谷子 PP2C基因的长度在1.4~14.0 kb之间, 外显子数量在1~20之间, 不同亚族间有较大变化(图1-C)。在亚族内部, 除E2亚族外, 其他各亚族中多数成员外显子数目相近, G、I、J亚族各自成员的基因结构相似度更高, 分别含有相同的外显子个数(外显子数目分别为4、11和9)。25个同源基因对中, 有15个同源基因对的外显子数目相同, 长度相近, 基因结构的差异主要由内含子和非翻译区长度的变化引起。
对谷子PP2C蛋白结构的分析预测出15个motif (表2), 不同亚族中的motif组成有一定的差异(图1-D)。其中motif 4、6和12在各蛋白序列中广泛分布, 80%以上的蛋白都含有该序列, 而motif 7、9、10、11的分布则表现出一定的亚族特异性。motif 7主要存在于A和H亚族, motif 9只存在于C亚族和D亚族, motif 11主要存在于D亚族, 而motif 10则是H亚族的特异序列。在同一亚族的不同成员中, 其主要的motif相同, 部分亚族(如D、G)的组成非常保守, 除个别成员外, 蛋白的motif组成完全相同。
用80个谷子的PP2C蛋白和80个拟南芥的PP2C蛋白序列构建的系统进化树(图2)显示, A-I亚族均含有谷子和拟南芥的基因, 且每一亚族中谷子和拟南芥的基因趋向于形成独立的分枝, 即谷子的基因聚在一起, 拟南芥的基因聚在一起。J亚族只有谷子基因, L亚族只含拟南芥基因, K亚族中有3个拟南芥基因, 而只有一个谷子基因 Si025857m.g, 在谷子的基因分类中将其列为独立的分支。
系统进化树分析表明, 谷子A亚族有10个成员, 根据基因座位号将其命名为 SiPP2CA1~ 10, 各基因基本信息如表3所示。由表可知, A亚族各基因的氨基酸数在376~486之间, 分子量在25.5~49.7 kD之间, 等电点在4.47~8.37之间, 外显子个数为1~5个, 保守的motif为2、3、4、5、6和8。进一步分析发现, SiPP2CA1和 SiPP2CA5分别位于第5和第3染色体, 在进化上处于同源分支, 其外显子个数相同, 蛋白质的氨基酸数、分子量、等电点以及保守域的位置和长度都相近, 同样, SiPP2CA2和 SiPP2CA8在染色体的分布、基因和蛋白结构上也相似。
 | 图1 谷子 PP2C基因家族分析A: 谷子PP2C蛋白系统进化树; B: 谷子 PP2C基因座位号; C: 谷子 PP2C基因结构, 黑色方框、灰色细线、白色方框分别代表外显子、内含子、非翻译区, 上方的比例尺总长为14 kb的基因长度, 每格代表1 kb; D: 谷子PP2C蛋白质结构。黑色圆球内数字对应表2中的保守序列数, 黑色球之间的数字代表保守序列间的氨基酸残基数。Fig. 1 Analysis of PP2C gene family in foxtail milletA: phylogenetic tree of PP2C proteins in foxtail millet; B: locus number of PP2C genes in foxtail millet; C: structure of PP2C genes in foxtail millet. The black boxes, gray lines and white boxes represent exon, intron, and UTR, respectively, and ruler at the top represents 14 kb with each scale of 1 kb gene length; D: structure of PP2C proteins in foxtail millet. Each black ball with a number corresponding with the number of conservative sequences shown in Table 2, and number between the balls represents the number of amino acid residues between the two motifs. |
| 表2 谷子PP2C蛋白氨基酸保守序列 Table 2 Conserved motifs of PP2C proteins in foxtail millet |
| 表3 谷子A亚族 PP2C基因的基本信息 Table 3 Basic information of PP2C genes within subfamily A in foxtail millet |
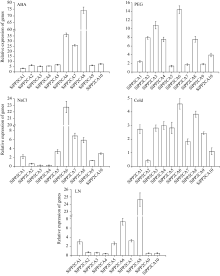
对10个谷子A亚族基因在不同处理下的表达分析表明, 所有谷子A亚族基因都能够受ABA诱导表达, 其中 SiPP2CA6、 SiPP2CA7、 SiPP2CA8响应强烈, 表达量在25倍以上, 最高的 SiPP2CA8表达为74.26倍; 在PEG处理下, SiPP2CA2、 SiPP2CA3、 SiPP2CA4、 SiPP2CA6、 SiPP2CA8、 SiPP2CA10相对表达量在2倍以上; 在高盐胁迫下, 各基因都有一定的响应, 其中, SiPP2CA6表达量达到22.73倍, 远高于其他基因; 在低温胁迫下, 除 SiPP2CA2外, 所有基因表达量都升高, 其中 SiPP2CA6最高, 为4.58倍; 在低氮处理下, SiPP2CA1、 SiPP2CA5、 SiPP2CA6、 SiPP2CA7、 SiPP2CA8表达量都在2倍以上, 其中, SiPP2CA8表达量最高, 达24.63倍(图3)。
如表4所示, 谷子A亚族基因启动子中包含ABRE、MYB、MYC、WRKY等多种顺式作用元件, 90%的成员启动子中含有DRE或LTRE元件, 说明A亚族基因对多种逆境胁迫响应可能与这些顺式作用元件相关。此外, 在4个基因 SiPP2CA5、 SiPP2CA6、 SiPP2CA7、 SiPP2CA8的启动子中还各有一个VD序列[GGCCCCGGG], 该序列最早发现于衣藻基因 NIA1的启动子中, 参与铵盐的响应[ 27], 则这4个基因对低氮胁迫的响应可能与该元件相关。
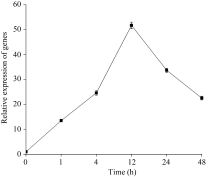
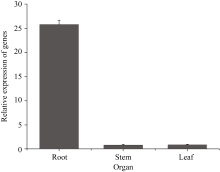
实时定量PCR结果表明, 在低氮处理条件下(总氮浓度为0.05 mmol L-1) SiPP2CA8的表达量在1 h明显增加, 在12 h达到最高, 在12 h以后下降(图4)。组织特异性表达分析发现, SiPP2CA8在根、茎、叶中都表达, 但表达量有明显差异, 其中, 在根中表达量最高, 在茎和叶中的表达量相近且都比较低 (图5)。
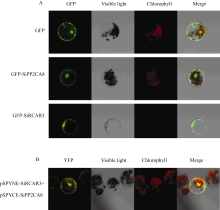
SiPP2CA8与拟南芥HAI类PP2C蛋白进化关系较近(图2), 已有研究证明HAI2/AIP1能够与ABA受体RCAR3/PYL8 (At5G53160)互作[ 28, 29]。本研究通过序列比对发现谷子中Si018317m.g的蛋白序列与RACR3/PYL8同源性最高, 并将Si018317m.g命名为SiRCAR3。亚细胞定位分析表明SiPP2CA8和SiRCAR3在细胞膜、细胞质和细胞核上都有定位(图6-A)。BiFC结果显示SiPP2CA8能够和SiRCAR3在细胞膜、细胞质、细胞核上互作(图6-B)。
2C型蛋白磷酸酶(PP2C)是植物最大的蛋白磷酸酶家族, 现已在拟南芥和水稻基因组分别鉴定出80和78个成员, 进化树分析分别将其归为13个和11个亚族, 基因组进化过程中发生的基因组和染色体片段的重复是导致该家族成员众多的主要因素[ 20]。本研究在谷子基因组中鉴定出80个 PP2C类候选基因, 聚类分析将其分为12个亚族。谷子 PP2C基因的数量与拟南芥和水稻的相近, 进化树分析表明大部分亚族都同时含有谷子和拟南芥的基因, 同一亚族中谷子和拟南芥成员数目相近, 且2个物种的成员趋向于分开聚类, 这一结果说明 PP2C基因家族起源于单、双子叶植物分化之前。分析还发现, J亚族的基因只存在于谷子基因组中, L亚族的基因只存在于拟南芥中, 这可能是由于两个物种在分化后形成了新的成员, 表现出一定的物种特异性。与拟南芥基因结构和蛋白序列相比, 谷子 PP2C不同亚族间的基因长度、外显子数目和保守氨基酸序列变化较大, 这可能与谷子遗传变异大、驯化程度低、具有较强的环境适应性相关。
| 表4 谷子A亚族 PP2C基因启动子中ABRE、DRE、LTRE、MYB、MYC、WRKY和VD等顺式作用元件分布 Table 4 Distribution of ABRE, DRE, LTRE, MYB, MYC, WRKY, and VD cis-acting elements in promoters of subfamily A PP2C genes in foxtail millet |
Zhang等[ 25]的研究表明, 在谷子染色体中的第2和第9、第4和第1、第7和第1、第6和第2、第5和第3之间发生过复制事件。本研究发现, 谷子 PP2C中, 有12对同源基因对的成员分布在这些染色体上, 具体为1对(Si029911m.g和Si035800m.g)、4对(Si007044m.g和Si017687m.g、Si006835m.g和Si017565m.g、Si006767m.g和Si017649m.g、Si006 734m.g和Si017582m.g)、3对(Si010098m.g和Si017 198m.g、Si009847m.g和Si016901m.g、Si010320m.g和Si017437m.g)和4对(Si001263m.g和Si0221 34m.g、Si001708m.g和Si024914m.g、Si001936m.g和Si021863m.g、Si001741m.g和Si022279m.g)同源基因分别位于第2和第9、第4和第1、第7和第1、第5和第3染色体, 且同源基因的结构和蛋白保守序列相近, 这可能与谷子在进化中发生的染色体的复制相关。同时发现, 在这12个同源基因对中, 有9对同源基因的蛋白motif组成有差异。如A亚族中 SiPP2CA2和 SiPP2CA8为同源基因, 其蛋白结构的差异主要为SiPP2CA2含有motif 3, 而SiPP2CA8在相应位置为motif 13, 且分析发现二者在不同胁迫处理下表达谱明显不同, 这些变化可能与染色体复制后的一部分基因发生了新功能的分化或亚功能化有关[ 25]。
在本研究中, 所有谷子A亚族的 PP2C基因都能响应ABA处理, 部分成员受干旱、高盐、低温诱导, 表明这些基因在谷子响应非生物胁迫的过程中发挥重要作用。这一现象与水稻及拟南芥的PP2C类基因家族的表达特性类似[ 20]。本研究还发现5个A亚族的基因( SiPP2CA1、 SiPP2CA5、 SiPP2CA6、 SiPP2CA7和 SiPP2CA8)对氮营养胁迫有响应, 其中 SiPP2CA8主要在根部表达, 且在低氮胁迫下表达强烈, 处理48 h后仍维持较高的表达水平, 表明 SiPP2CA8可能在低氮应答中起重要作用。
进化树分析发现SiPP2CA8与拟南芥HAI类PP2C蛋白同源关系较近。已有研究表明, HAI类PP2C蛋白参与ABA信号的传导途径, 对ABA及干旱胁迫都存在响应[ 21]。序列比对表明SiRCAR3 (Si018317m.g)可能是谷子中的ABA受体, 亚细胞定位及互作试验表明SiPP2CA8和SiRCAR3在细胞膜、细胞质和细胞核上都有定位, 二者能够在细胞膜、细胞质和细胞核互作, 表明SiPP2CA8可能在谷子中与ABA受体(SiRCAR3)互作从而参与ABA信号传导过程。
从谷子基因组中鉴定出80个 PP2C候选基因, 这些候选基因被分为12个亚族。A亚族成员能够不同程度响应ABA、干旱、高盐、低温和低氮处理, 其中, SiPP2CA8主要在根中表达, 对5种处理都有较强响应。SiPP2CA8能够与谷子ABA受体类似蛋白SiRCAR3互作, 表明该基因可能参与谷子中ABA信号传导途径。
B
D
A
C
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|