以强休眠性玉米自交系08-641为材料, 2个弱休眠性玉米自交系为对照, 利用蛋白质双向电泳技术, 对处于休眠状态下的新鲜收获种子和经过15 d后熟处理破除休眠的3个自交系种子进行了蛋白质差异表达分析。结果表明, 在3次重复试验下共检测到9个与休眠相关的蛋白点, 其中新增诱导表达蛋白质1个, 缺失表达蛋白质2个, 上调表达蛋白质5个, 下调表达蛋白质1个。在9个蛋白质中, 有5个蛋白点得到鉴定。包括3个globulin-1 S allele precursor、1个2-isopropylmalate synthase B和1个translationally-controlled tumor protein。种子休眠破除过程中的蛋白质的变化说明种子经历了一系列生理生化活动, 深入研究这些蛋白质的生物学功能将有助于更清楚地认识玉米种子休眠问题。
Because the special natural climate of overabundant rain and poor sunshine in the southwest, pre-harvest sprouting has seriously affected the quality and yield of maize, looking for a good material with resistance to pre-harvest sprouting is the urgent need for improvement of existing maize strains. The results of this study indicated that proteome of 08-641, 008, and 127 seeds significantly changed during post-ripening. Nine differentially expressed proteins related to dormancy in the seeds of maize inbred line 08-641 with 15 days afterripening process were analysed through 2-DE, including one newly induced expressed protein, two missing expressed proteins, five up-regulated expressed proteins, and one down-regulated expressed protein. Among the nine proteins, five proteins were identified by mass spectrometry, including three globulin-1 S allele precursor of storage proteins, one 2-isopropylmalate synthase B and one translationally-controlled tumor protein involved in regulating protein structure and cell function. The changes of proteins during dry ripening process of seeds indicated that the seeds undergo a series of physiological and biochemical activities befor they can germinate normally, and the deeply study on the biological function of these proteins will help us understand maize seed dormancy more clearly.
种子休眠是指在适宜环境条件下具有生活力的种子不发芽或延迟发芽的现象[ 1, 2], 是植物界普遍存在的现象, 是一种在植物系统发育演化进程中形成的生物学特征, 涉及到种子萌发过程中一系列复杂的基因表达与调控[ 3, 4]。受到种子内在因素和外部条件共同影响[ 5, 6, 7]。目前普遍认为皮层吸水障碍、胚休眠和种子内存在抑制萌发物质是种子休眠的三大原因[ 8]。长期以来, 众多学者对种子休眠的调控机制进行了广泛的探索和描述, 形成了多种假说, 其中内源激素学说被广泛认可。Karssen等[ 9]进一步发展了该假说, 提出了调控种子萌发与休眠的“三因子学说”。Handricks等[ 10]提出了植物种子休眠机制学说的代谢途径均衡论, 即种子休眠的解除与呼吸途径有关。休眠状态的种子新陈代谢缓慢, 基本处于不活动的状态[ 4]。种子破除休眠开始萌发后, 种胚中的各种酶的活性增强, 使胚乳中的营养物质分解, 并使可溶性分解产物迅速向正在生长的胚中转移[ 11]。Roberts等[ 12]通过对种子休眠的研究提出了PPP途径假说, 即“休眠的解除是糖代谢方式从糖酵解途径转向磷酸戊糖途径(PPP)的结果”。
蛋白质是植物体内多种生命活动的直接作用元件, 种子内相关蛋白质的存在将决定种子的生理状态。Gallardo等[ 13]以干燥成熟的拟南芥种子为研究对象, 通过蛋白质组学方法对种子休眠和萌发过程中的蛋白质组进行了分析, 共分离得到1300种蛋白质。发现其中有74种蛋白质在种子吸胀阶段或在胚突破过程中改变了丰度; 同时也新发现了一些与萌发有关的蛋白质, 如肌动蛋白异构体和WD-40重复蛋白等。Chibani等[ 14]研究发现拟南芥休眠种子和经后熟的非休眠种子中存在32种差异蛋白。张海萍等[ 15]通过双向电泳-质谱技术, 对小麦胚休眠中ABA信号转导的蛋白质组进行了分析, 发现有18个ABA反应型蛋白点的表达存在显著差异, 其中2个未知蛋白在籽粒发育中后期大量合成, 与胚休眠性的获得具有时间上的一致性。
玉米种子的休眠性是容易受环境影响的复杂数量性状, 也是重要的农艺性状[ 16]。种子休眠性的强弱直接决定了玉米的抗穗发芽性, 因此从农业生产的实际出发, 迫切需要深入研究其休眠机制, 以减少玉米生产上的穗发芽危害。本试验以强休眠性玉米自交系08-641为材料, 通过与2个弱休眠玉米自交系相对照, 对种子休眠破除前后种子蛋白质组的差异表达进行了比较和分析, 力求鉴定出与玉米种子休眠性密切相关的蛋白, 为进一步研究玉米种子的休眠机制奠定基础。
强休眠性玉米自交系08-641 (R08), 2个休眠性较弱的玉米自交系008 (9LY5041)和127 (9LY5028)。取田间套袋自交授粉后35 d的果穗, 每个材料随机取3个果穗。等量剥取新鲜玉米籽粒混合, 用于休眠状态下的蛋白质组分析; 余下籽粒带轴自然风干15 d至安全含水量, 等量剥取籽粒混合, 用于种子干燥后熟破除休眠后的蛋白质组分析。
1.2.1 蛋白质样品制备 取1 g左右玉米籽粒加液氮研磨至细粉状, 加入预冷的蛋白质提取液(丙酮, 内含10% TCA, 0.07%巯基乙醇), 涡旋振荡后于-20℃下放置1 h以上, 在4℃下20 400× g离心30 min, 弃上清液; 再加入预冷蛋白质提取液(丙酮, 内含0.07%巯基乙醇), 悬浮、振荡后于-20℃放置1 h, 离心同上, 弃上清液, 重复3次, 最后加入80%预冷丙酮, -20℃下放置1 h以上, 离心同上, 弃上清液, 风干沉淀; 精确称取样品蛋白质干粉, 按1 mg蛋白干粉与20 μL裂解液充分混合, 悬浮、振荡2 min后在液氮与35℃水浴中反复冻融3次, 每融1次涡旋振荡2 min, 24℃下20 200× g离心10 min。取上清液保存于-80℃冰箱备用。
1.2.2 双向电泳及其图谱分析 将蛋白质样品用适量水化上样缓冲液稀释至300 μL上样量, 充分混匀后沿聚焦槽边缘线性加入样品, 采用Bio-Rad生产的17 cm、pH 3~10的非线性IPG胶条。等电聚焦电压设置为500 V水化12 h, 然后依次经过250 V 1 h、1000 V 3 h、10 000 V 5 h, 最后稳定在10 000 V 6 h, 最终总电压时间积为90 000 V h。等电聚焦结束后将胶条移至平衡槽中, 先后在胶条平衡缓冲液I和II中平衡15 min, 然后进行第二向SDS-PAGE电泳。初始以5 mA gel-1低电流电泳1 h, 再加大电流至20~30 mA gel-1, 待溴酚蓝指示剂到达距凝胶底部边缘1 cm左右时停止电泳。用UMAX2100扫描仪扫描双向电泳凝胶并保存图像, 每个蛋白质样品重复3次。使用Bio- Rad公司的PDQuest 8.0凝胶图象分析软件分析双向电泳图谱, 图谱上表达量相差2.0倍以上的蛋白点作为真实存在的差异表达蛋白点, 并将差异蛋白点洗脱出来进行质谱鉴定。
1.2.3 差异蛋白质质谱检测 质谱鉴定工作由国家生物医学分析中心完成, 使用胰酶解肽段混合物的基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)检测。通过Mascot程序对MALDI-TOF-MS质谱检测得到的肽质量指纹图谱进行检索。选择数据库为NCBInr, 种属为Green Plants, 氨基酸固定修饰方式为Carbamidomethyl (C)修饰, 可能的修饰方式为Oxidation (M)修饰, 取单同位素峰检索, 可接受的肽段分子量误差设为0.3 Da。为使鉴定结果可靠, 要求每一个查询结果至少有5个匹配肽段, 且其在蛋白质整个序列的覆盖率至少为15%; 对小于20 kD的蛋白质, 则要求至少有3个匹配肽段和20%的覆盖率。
在3次重复试验的08-641、008、127种子蛋白2-DE图谱上分别检测到584±14、578±29、613±20个蛋白质点。对比休眠状态下的08-641玉米种子与008和127的玉米种子双向电泳图谱, 在008和127蛋白质表达一致的前提下, 08-641种子与对照存在10个差异蛋白点(图1和图2)。在这10个有差异的蛋白质点中, 仅在08-641种子出现特异表达蛋白质1个, 在对照中出现而在08-641中没有出现的缺失表达蛋白质2个, 在08-641中增加表达量的上调表达蛋白质3个, 减少表达量的下调表达蛋白质4个(表1)(以数字1、2、3、……、代表休眠状态下的差异蛋白, 英文字母a、b、c、……、代表休眠破除状态下的差异蛋白)。差异蛋白较集中于图谱的酸性端。
在08-641与对照有差异表达的蛋白质点中, 表达量下调的蛋白质点较多, 下调和上调表达的差异蛋白质点占70%。在相同的取样时期, 08-641、008和127种子表现出不同的生理状态, 说明具休眠特性的08-641种子除其遗传差异外, 与正常种子相比, 其内部相关基因及蛋白表达水平差异是影响种子休眠特性的重要因素。
 | 图2 休眠状态下部分差异蛋白点放大图Fig. 2 Enlarged view of partial differentially expressed protein spots of dormant maize seeds |
| 表1 休眠状态下玉米种子蛋白质表达情况及差异蛋白质点 Table 1 Protein expression and differentially expressed protein spots of dormant maize seeds |
在3次重复实验的08-641、008、127种子中分别检测到594±17、586±21、604±13个蛋白质斑点。我们将休眠破除后的08-641玉米种子与对照008和127的双向电泳图谱进行对比, 在008和127表达一致的前提下, R08与对照共存在12个差异蛋白点(图3和图4)。在这有差异的12个蛋白质点中, 仅在08-641中出现的特异表达蛋白质6个, 08-641种子中没有出现而在对照种子中出现的缺失表达蛋白质4个, 在08-641种子中表达量增加的上调表达蛋白质1个, 表达量减少的下调表达蛋白质1个(表2)。差异蛋白质较集中在图谱的碱性端。
从休眠破除后的08-641玉米种子与对照的差异蛋白质点变化情况来看, 与休眠状态下的种子不同的是, 08-641种子与对照的差异主要体现在蛋白质表达的有无上, 占到了总差异蛋白的83%的比例。而上、下调表达的只分别检测到1个。这说明08-641种子破除休眠后与对照008和127种子内部的代谢调控存在着较大的差异, 同时也反映出种子休眠的破除是一个复杂的生理调控过程。
| 表2 玉米种子休眠破除后蛋白质表达情况及差异蛋白质点 Table 2 Protein expression and differentially expressed protein spots of seeds without dormancy |
为了消除自交系本身的遗传差异, 进一步明确参与休眠调控的蛋白质, 比较与08-641鲜种子有差异的蛋白质和风干15 d后熟的差异蛋白质的前后表达量(图5, 上为鲜种子, 下为后熟种子), 发现有9个蛋白质点(2, 4, 6, 8, 9, b, c, d, l)在08-641种子休眠前后表达量有差异, 未检测到其余点有变化。08-641种子的9个差异蛋白点中, 包括种子风干后出现而新鲜种子中没有出现的诱导表达蛋白质1个、风干种子没有出现而在新鲜种子中出现的缺失表达蛋白质2个、种子风干后表达量增加的上调表达蛋白质5个、表达量减少的下调表达蛋白质1个(表3)。
进一步比较, 以排除由样品本身差异所引起的假休眠相关蛋白, 如在自交系008和127休眠破除后种子中表达, 但在08-641休眠破除前后没有差异的蛋白(点f); 在08-641休眠破除后种子中特异表达, 但在08-641种子休眠破除前后没有差异的蛋白(点i、点j和点k); 08-641休眠破除种子中表达量比对照高, 但是种子休眠破除前后没有差异的蛋白(点g); 08-641休眠破除后种子中表达量比对照低, 但是在休眠破除前后没有差异的蛋白(点h)。另外还发现, 蛋白质点2、点9、点8的表达量增加, 这刚好与新鲜种子时的表达量比对照减少互补; 点6的表达量减少, 刚好与新鲜种子时的表达量较对照多互补。这表明参与休眠调控的蛋白在种子后熟过程的生理代谢活动中可能有根本的变化。
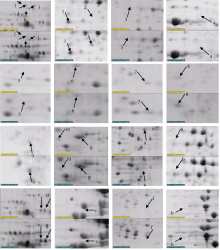 | 图5 08-641休眠破除前后差异蛋白点放大图Fig. 5 Enlarged view of differentially expressed protein spots between dormancy and non-dormancy seeds in R08 |
| 表3 休眠相关蛋白质的表达情况及差异蛋白质点 Table 3 Protein expression and differentially expressed protein spots for seed dormancy |
经质谱鉴定和蛋白质数据库比对, 得到9个种子休眠相关蛋白的匹配和肽段信息, 有5个蛋白质点得到鉴定(表4)。对鉴定到的蛋白质进行简单归类, 其中包括6个贮藏物蛋白质, 3个为参与物质代谢蛋白质, 2个蛋白质参与蛋白质结构及细胞功能调控, 6个蛋白质功能未知。
| 表4 9个差异表达蛋白质点的质谱鉴定结果 Table 4 Nine differentially expressed protein identified by mass spectrometry |
本试验共鉴定了5个种子休眠相关蛋白, 分别为globulin-1 S allele precursor (点c、点d和点l)、2-isopropyl-malate synthase B (点6)和translationally-controlled tumor protein (TCTP)(点8)。globulin-1 S allele precursor, 即球蛋白前体。玉米胚中含有大量的不溶于水的盐溶性蛋白称为球蛋白, 丰度最大的2种分别是 Globulin-1编码的分子量为6 300的GLB 1蛋白和 Globulin-2编码的分子量为45 000的GLLB 2蛋白, 这2种蛋白占成熟玉米胚蛋白的10%~20%, GLB 1与单、双子叶植物中的7S种子球蛋白具有序列相似性, 但其酶学功能尚不清楚[ 17]。有研究指出, GLB 1基因的5′区域的序列与小麦中脱落酸响应原件 Em基因的序列具有相似性。ABA能够调节 GLB 1基因的表达[ 18]。在大麦籽粒中, 随着授粉后天数的增加, Globulin-1 S allele precursor的表达量显著增加[ 19]。 GLB 1在抗黄曲酶毒素玉米自交系籽粒成熟前期富集, 在赤霉素缺乏突变体的干燥种子中大量富集12S globulin precursors, 而在正常种子中表达量较少[ 20]。前期研究还发现在R08经过10 d的干燥后熟后该蛋白质在种子内的表达量减少(另文发表), 而经过15 d的干燥后熟, 其表达量却增加。所以该蛋白表达量的变化很可能就是随着种子的后熟及ABA含量变化, 该变化与种子休眠密切相关。2-isopropylma-late synthase B, 即异丙基苹果酸聚合酶。由 leuA基因编码合成的α-异丙基苹果酸合酶存在于绝大多数微生物当中。目前该蛋白在植物中的有关研究还鲜有报道。本试验中发现该蛋白在种子休眠破除后表达量下调, 有可能异丙基苹果酸合酶参与种子休眠的调控。translationally- controlled tumor protein, 即翻译控制肿瘤蛋白(TCTP)。TCTP是一种高度保守的蛋白质, 它广泛存在于各种真核生物的细胞中, 具有Ca2+及微管蛋白结合能力, 其表达在转录和翻译2个层面上受到各种胞外信号的调控。目前的研究表明, TCTP参与很多重要的细胞生理过程, 包括细胞生长、细胞周期的进行、恶性迁移、抗逆、抗凋亡, 并且表现胞外细胞因子活性[ 21, 22, 23]。对于TCTP的研究主要集中在哺乳动物和寄生虫中, 近年来, 在植物中的报道也日益增多[ 24, 25, 26, 27, 28, 29], 邓治等[ 30]对巴西橡胶树TCTP基因结构进行了分析并开发了相应的分子标记, 但TCTP在植物中的作用及其机制尚不清楚。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|





