古蔺牛皮茶是四川省特有的茶树种质资源, 原产于四川省泸州市古蔺县古蔺镇枣林村椒子沟。为了更好地保护和利用珍稀的茶树种质资源, 在椒子沟山区选取7个居群共76株典型的古蔺牛皮茶树, 采用实地调查记录、生化成分及ISSR分子标记检测等方法, 分析该种质资源的形态学特征、品质生化成分及遗传多态性。结果表明: (1)古蔺牛皮茶树型为灌木或小乔木; 成熟叶片为绿色或深绿色, 主要为中叶, 叶形为椭圆或长椭圆; 新梢芽叶玉白、黄绿、绿色或紫绿色。表明古蔺牛皮茶居群间表型特征多样化。(2)在7个居群中鉴定出高茶多酚(春梢>27%, 夏梢>31%)和儿茶素(春梢>150 mg g-1, 夏梢>190 mg g-1)的居群2个, 游离氨基酸较高( >4.5%)的居群2个; 7个居群的酚氨比值在3.84~16.95之间。表明古蔺牛皮茶在茶树育种和茶叶加工等方面具有较高的利用价值。(3) 15条ISSR引物共扩增出135条谱带, 其中122条为多态性条带, 多态性位点百分比为90.4%。供试材料间的平均Nei’s基因多态性指数(
Gulin-niupicha (
种质资源是在漫长的历史过程中, 由自然演化和人工选择形成的一种重要的自然资源。它蕴藏着各种性状的遗传基因, 是选育新品种和发展农业生产的物质基础, 也是进行生物学研究的重要材料[ 1]。我国西南地区的云贵川一带是茶树的发源地之一, 拥有丰富的野生、半野生和栽培的茶树种质资源[ 2]。古蔺牛皮茶是四川省的一个重要地方茶树品种资源, 为有性系品种, 主要分布在古蔺县古蔺镇枣林村的椒子沟, 1985年该品种被认定为四川省省级地方品种。古蔺牛皮茶生长和栽培区域仅限于椒子沟及周围的山区和丘陵地区, 其性状、品质特殊, 有独特的农艺价值。目前有关古蔺牛皮茶的研究较少[ 3], 未见对古蔺牛皮茶系统研究的报道; 同时, 该品种资源也未得到良好的利用和推广, 加上该地区连年来干旱少雨的气候条件和人为破坏, 导致古蔺牛皮茶群体的生长区域不断缩小, 种质资源流失, 所以应对古蔺牛皮茶种质资源的性状进行系统的鉴定和评价, 以加强对该资源的保护和利用。
本文通过调查古蔺牛皮茶群体的分布情况, 初步分析了不同居群茶树的形态学特征、品质生化成分及遗传多态性, 旨在探究古蔺牛皮茶的资源现状、农艺价值和遗传特征, 为开展古蔺牛皮茶种质资源的收集、保存、评价和利用以及特异资源的发掘和新品种的选育奠定基础。
古蔺县地处四川盆地南缘向贵州高原过度地带。其四季分明、雨热同季、夏季炎热、冬无严寒, 气温差异大, 无霜期长, 年降雨量偏少, 湿度适中, 日照较充足, 常年多夏伏旱, 具有四川盆地南部高温和贵州高原乍寒乍暖的气候特点。古蔺牛皮茶集中分布于该县古蔺镇枣林村的椒子沟(27°58′33″~ 27°59′30″N, 105°46′39″~105°47′33″E, 海拔900~1100 m的山林中), 距离古蔺县城5 km, 分布区域约20 km2, 海拔800~1200 m。茶树多为野生、半野生状态, 也有少量人工栽培的茶树。
从椒子沟集中分布的野生、半野生古蔺牛皮茶群体中, 选定7个数量较多、外部形态特征具有代表性的居群共计76株( 表1), 观测并记录其地理位置。以当地栽培的四川中小叶群体品种为对照组(CK)。
| 表1 古蔺牛皮茶种质资源来源情况 Table 1 Origin and sample number of Gulin-niupicha germplasm resources |
于2012年春季驻点观测, 根据NY/T 1312-2007农作物种质资源鉴定技术规程(茶树)[ 4]的方法, 观测古蔺牛皮茶树体、芽叶及成熟叶片的性状及特征, 并按相应方法和要求[ 1]记录于茶树种质资源数据采集表。为方便后期的统计分析, 参照沈程文[ 5]的方法量化处理形态学特征的质量指标( 表2)。
| 表2 古蔺牛皮茶种质资源表型性状编码 Table 2 Phenotypic traits and their coding for Gulin-niupicha germplasm resources |
于2012年春、夏两季及2013年春季采摘茶树的标准一芽二叶制作生化样, 根据NY/T 1312-2007农作物种质资源鉴定技术规程(茶树)[ 4]制定的方法, 测定古蔺牛皮茶的品质生化成分, 测定指标包括茶多酚[ 7]、游离氨基酸[ 8]和咖啡碱[ 9]。采用高效液相色谱法(HPLC)测定儿茶素和茶氨酸[ 7]。
于2012年春季取样, 选取茶树新梢一芽一叶, 迅速用液氮处理, 并将其保存在-80℃冰箱中备用。参照刘本英等[ 10]的方法提取茶树基因组DNA。
参照刘本英等[ 10]的ISSR反应体系, 20 μL反应体系中含模板DNA 30 ng, 10×缓冲液, Mg2+ 2.0 mmol L-1, 引物0.2 μmol L-1, dNTPs 0.4 mmol L-1, Taq DNA聚合酶1.5 U。采用美国百乐公司生产的MyCycler Tm Thermal型PCR仪扩增DNA, 扩增程序为94℃预变性5 min; 94℃变性1 min, 48~62℃退火30 s, 72℃延伸2 min, 35次循环; 72℃再延伸10 min, 12℃保存。扩增产物在1×TBE缓冲液中, 用2%的琼脂糖凝胶电泳检测, 电压设定为90 V, 电泳3 h。经EB溶液染色后, 用SYNGENE (德国)凝胶成像系统拍照记录。
从加拿大哥伦比亚大学(University of British Columbia Biotechnology, UBS)报道的100条植物通用ISSR引物[ 11]中挑选72条, 委托北京华大基因有限公司合成。参考引物的 Tm值, 采用梯度PCR确定退火温度。以古蔺牛皮茶N1为模板, 在48~62℃间设置0.5℃为一个温度梯度进行扩增, 扩增产物经1.5%琼脂糖凝胶电泳检测, 以扩增带型清楚杂带比较少的温度作为该引物的退火温度。选择能扩增出目的条带、多态性高、重复性好的引物作为资源扩增的核心引物。
将核心引物的扩增结果中清晰的条带赋值为1, 同一位置无带或难以分辨的弱带赋值为0, 建立原始数据矩阵。在同一扩增位点, 只要有至少一个材料在该扩增位点计数为“0”, 则该扩增位点为多态性条带, 每条多态性带可视为一个等位基因。
用SPSS Version19.0软件统计分析形态学原始数据, 利用Duncan’s多重比较法进行差异显著性检验。参照罗晓莹等[ 12]的方法, 利用POPGEN Version 1.32软件分析ISSR标记试验数据。多态位点百分率(PPL)、Nei’s基因多态性指数( H)、Shannon’s多态性信息指数( I)、各居群内基因遗传分化指数( Gst) ( Gst=1- Hs/ Ht)及居群内的遗传距离和相似系数等参数均由POPGEN Version 1.32软件获得。居群每代迁移数 Nm=(1- Fst)/4 Fst[ 13]。将POPGEN Version 1.32软件得出的居群遗传相似系数输入NTsys 2.10e软件,得到居群的亲缘关系聚类图, 并测试形态学特征矩阵和ISSR分子标记数据矩阵的Mantel相关性。
7个供试的古蔺牛皮茶居群中, 树型大部分为灌木, 其中居群D和居群G全部为灌木型, 而其他5个居群均含有小乔木或乔木型。每个居群的平均树高在180.8~382.1 cm之间, 均比四川中小叶群体茶树(平均172.4 cm)高。其中, 居群B最高,为382.0 cm; 居群D最矮, 为180.0 cm。古蔺牛皮茶居群的成熟叶片特征呈多样化,叶片大小指数平均为1.54 (居群E)~2.50 (居群A), 大部分为2.0~2.5, 多为中叶种, 群体E的叶片大小指数平均为1.54, 含有部分小叶种茶树。叶形指数平均为1.18~1.40, 表明多数茶树的成熟叶片呈椭圆形,也有部分呈长椭圆形。其中,居群A、G的叶形指数分别为1.40、1.33, 含有较多的长椭圆叶形的茶树, 还含有少量披针叶形的茶树。叶色指标为1.60~2.09, 多数茶树叶片呈绿色, 少部分呈深绿色, 黄绿色的很少。各居群的芽叶性状差异也很大, 芽叶色泽从玉白色到紫绿色不等, 平均芽色指标在2.0~3.0之间, 其中, 居群A最低(2.1), 颜色相对偏浅, 而居群D (2.9)最高, 颜色相对较深。
2.2.1 2012年春夏梢 茶树采收的对象是新梢, 因此新梢中主要生化品质成分的含量和配比决定茶叶的先天品质。由 表4可见, 7个古蔺牛皮茶居群新梢的茶多酚含量, 春梢为22.57%~30.17%, 夏梢为26.82%~36.57%。其中居群B (春梢为30.17%, 夏梢为36.57%)、F (春梢为28.97%, 夏梢为33.45%)和A (春梢为27.93%, 夏梢为31.51%)春、夏梢的含量均显著高于CK (春梢为25.60%, 夏梢为29.42%), 居群D春、夏梢均最低(春梢为22.57%, 夏梢为26.82%), 且显著低于CK。儿茶素含量, 春梢为126.52~157.15 mg g-1, 夏梢为135.27~194.60 mg g-1。其中居群A (春梢为157.15 mg g-1, 夏梢为194.60 mg g-1)、B (春梢为155.19 mg g-1, 夏梢为191.69 mg g-1)春、夏梢的含量均显著高于CK (148.07 mg g-1、184.09 mg g-1), 而居群C、F、G和D的春、夏梢含量则显著低于CK。游离氨基酸含量春梢为2.08%~4.84%, 夏梢为1.86%~ 3.97%, 除居群B和E显著低于CK (春梢为2.64%, 夏梢为2.33%)外, 其余居群春、夏梢均高于CK。其中居群D春、夏梢均最高(春梢为4.84%, 夏梢为3.97%), 居群C (春梢为4.63%, 夏梢为3.79%)次之。咖啡碱含量春梢为3.55%~4.81%, 夏梢为3.32%~ 5.22%, 除居群D和E外, 其他5个居群春梢和夏梢的含量均高于CK。酚氨比春梢为4.66~12.66, 夏梢为6.76~16.95, 其中居群E春、夏梢均最高, 居群B次之, 均显著高于CK, 居群D最低。
| 表3 古蔺牛皮茶居群间8个生物学表型性状统计分析 Table 3 Statistical analysis of eight phenotypic traits among different Gulin-niupicha populations |
| 表4 2012年古蔺牛皮茶群体春、夏梢主要生化成分 Table 4 Biochemical composition of Gulin-niupicha in spring and summer of 2012 |
2.2.2 2013年春梢主要生化成分 不同居群春梢的主要生化品质成分的含量也有较明显的差异( 表5)。茶多酚含量为19.04%~29.79%, 咖啡碱含量3.36%~4.28%, 游离氨基酸总量2.27%~4.96%, 儿茶素总量为104.73~175.01 mg g-1, 酚氨比为3.84~ 12.38。茶氨酸是茶叶氨基酸组分中最重要且含量最高的氨基酸, 又是茶叶中的特征氨基酸, 其含量为10.98~24.13 mg g-1, 多数居群间与对照也有一定差异, 居群D比E和CK分别高119.76%、80.21%。与2012年的测试结果相比, 茶多酚含量略降低, 咖啡碱含量呈现一定差异, 游离氨基酸含量均出现不同程度上升, 但居群D和C仍最高, 分别为4.96%和4.78%。表现出古蔺牛皮茶资源生化成分的多样性。
2.2.3 2013年春梢儿茶素 茶叶中的儿茶素是茶叶中多酚类物质的主体成分, 也是具有保健功效的生理活性物质。儿茶素主要含8种组分物质, 从 表6可知。8种儿茶素组分的含量各居群间与对照均有较明显的差异, 其中最具保健功效的酯型儿茶素(EGCG)的含量为45.75~82.80 mg g-1, 居群B、F、A的含量均显著高于CK, 其余4个居群则显著低于CK。
| 表5 2013年古蔺牛皮茶群体春梢主要生化成分 Table 5 Biochemical composition of Gulin-niupicha in spring of 2013 |
| 表6 不同居群古蔺牛皮茶春梢儿茶素组分分析(2013年) Table 6 Analysis of catechin components about the tea plants in spring of 2013 |
2.3.2 古蔺牛皮茶居群遗传多态性和遗传结构
从 表8可知, 古蔺牛皮茶7个居群的平均多态性为64.66%, Nei’s基因多态性( H)指标为0.254, Shannon’s遗传信息指数( I)为0.392。各居群内, Nei’s基因多态性( H)系数平均为0.203, Shannon’s遗传信息指数( I)平均为0.307。在7个居群中, 居群C的遗传多态性最高, H值为0.218, I值为0.333; 而居群B的遗传多态性最低, H值为0.186, I值为0.163。从遗传结构来看, 古蔺牛皮茶居群的基因遗传分化指数( Gst)为0.198, 表明有19.8%的遗传变异存在于7个居群间, 80.2%的变异存在于居群内; 也说明古蔺牛皮茶居群内遗传变异较高, 居群间的遗传变异较低。基于居群间遗传分化系数计算的每代迁移数(即基因流 Nm)为2.022。
| 表7 15对ISSR引物对76株古蔺牛皮茶扩增的多态性 Table 7 Polymorphism detected with 15 ISSR primers in 76 Gulin-niupicha individuals |
| 表8 不同古蔺牛皮茶群体中的ISSR遗传多态性 Table 8 Genetic diversity of Gulin-niupicha distributed among different populations detected by ISSR |
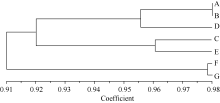
2.3.3 古蔺牛皮茶居群亲缘关系聚类分析 利用UPGMA (unweighted pair-group method with arith-metic means)法, 得出聚类树状图( 图1)。在遗传相似系数为0.956时, 可以将7个居群分成3个组, 居群A、居群B和居群D组成第I组, 居群C和居群E组成第II组, 居群F和居群G组成第III组。7个居群体之间, 居群A和居群B的遗传相似系数最大, 为0.981; 居群E和居群G的遗传相似系数最小, 为0.879; 表明居群A和居群B之间亲缘关系最近, 而居群E和居群G亲缘关系最远。
利用Mantel测试方法对形态学特征矩阵和ISSR分子标记数据矩阵作相关性分析。显示, 在形态学特征和遗传距离之间不存在相关性, 其Mantel相关系数 r=0.03。
| 表9 不同古蔺牛皮茶居群间的遗传相似系数 Table 9 Genetic similarity coefficient between populations of Gulin-niupicha |
古蔺牛皮茶在树型、树姿、成熟叶片和新梢形状上都表现出多样性, 很多地区茶树地方种质资源都表现出这一特征。王春梅等[ 14]在研究崇州枇杷茶野生大茶树种质资源时, 发现居群内变异类型较多, 不同类型茶树间差异显著, 树体、芽叶和成熟新梢等生物学特征均表现出多样性; 蒋会兵等[ 15]对云南10个地区的830份茶树种质资源分析发现, 云南茶树种质资源具有丰富的表型遗传多态性。茶树在漫长的历史过程中, 经历了古地质气候的变迁, 形成了自己独特的生长发育规律和遗传特性。了解这些特征、特性,可为种质资源的鉴定和评介提供依据, 同时在茶树栽培和育种中综合运用各项技术,以实现茶叶的优质、高产、高效[ 16]。本研究对古蔺牛皮茶的形态学性状的初步探索, 积累了一些数据, 对该资源的鉴定、评价与利用具有一定的指导意义。但是, 需对其进行长期深入的研究, 才能充分掌握其特征特性和开发利用价值。
茶叶生化成分组成及其含量是茶叶色、香、味形成的物质基础, 也是茶叶品质鉴定的重要指标之一[ 17, 18]。前人通过生化成分测定, 已鉴定出众多品质优异的茶树资源材料[ 19, 20, 21]。古蔺牛皮茶群体中新梢品质生化成分呈现出特异和多样的特点, 7个供试居群中, B和A居群的茶多酚含量较高(春梢>27%, 夏梢>31%), 且儿茶素含量也高(春梢>150 mg g-1, 夏梢>190 mg g-1); 居群D和C的春茶游离氨基酸总量高于4.5%。酚氨比值是鉴定茶叶适制性的重要依据, 一般认为, 酚氨比值小于8适宜制绿茶; 酚氨比值在8~15之间, 红绿茶兼制; 大于15则适制红茶[ 22]。7个居群的春茶比值值均在3.84~16.95之间, 表明古蔺牛皮茶可以用来选育优质绿茶、红茶品种或红绿兼制品种。然而,茶树的生长发育和代谢受诸多环境因素的影响, 内质生化成分也会随地理、气候、发育阶段不同而改变。因此, 对古蔺牛皮茶深入研究才能挖掘群体中有价值的种质资源, 而对现有古蔺牛皮茶资源进行有效的保护是深入研究和开发利用的前提。
本研究用15对ISSR引物对76份古蔺牛皮茶材料的遗传多态性进行分析,多态性位点百分比为90.4%, 高于季鹏章等[ 23]利用ISSR研究云南古树茶10个居群的多态性位点百分比(56.5%~90.9%), 略低于宁静等[ 24]研究的湘西“黄金茶”群体和李丹等[ 25]研究的江华苦茶的多态性位点百分比(分别为91.22%和95.40%), 远低于刘本英等[ 26]研究云南茶树资源的多态性(98.9%)。表明古蔺牛皮茶基因组DNA具有一般的多态性, 也反映出古蔺牛皮茶群体一定的遗传变异程度。76份古蔺牛皮茶材料的平均Nei’s基因多样性指数( H)为0.254, 平均Shannon’s信息指数( I)为0.392, 比姚明哲等[ 27]研究我国茶树无性系品种多样性指数( H为0.23; I为0.38)略高, 这是由于我国选育茶树品种时, 同一地区的大部分育成品种都源于遗传背景比较相似的地方群体或亲缘关系比较近的亲本, 导致遗传基础相对单一; 同时, 良种的繁育主要采用无性繁殖技术, 也会导致无性系茶树遗传多样性较低。宁静等[ 24]研究的湘西“黄金茶”地方群体的多态性指数( H为0.30, I为0.45)和李丹等[ 25]研究的江华苦茶的多态性指数( H为0.38; I为0.56)都比古蔺牛皮茶居群高, 尤其是后者, 表明古蔺牛皮茶的在基因上多态性并不是很高。作为一个地方特有的茶树居群, 古蔺牛皮茶处于野生、半野生和栽培状态, 茶树的来源和生长发育已受到一定的人为影响, 比如茶农对具有优良农艺性状茶树会进行保护和培育, 而对农艺性状较差的茶树则较少关注, 这种人工选择会导致古蔺牛皮茶居群遗传背景变窄, 从而降低居群的遗传多态性[ 28], 这可能是古蔺牛皮茶对比湘西“黄金茶”群体和江华苦茶群体表现出较低基因多态性的原因之一。
植物居群的遗传结构是由一系列的作用形成的, 包括物种的长期进化(如分布的变化, 栖息地的分裂和种群隔离)、突变、繁殖体系以及基因流动和选择等[ 29]。表型变异是基因型和环境共同作用的结果, 丰富的表型变异蕴藏着一定的遗传变异[ 30]。本研究中古蔺牛皮茶居群间的遗传分化系数( Gst)是0.198, 这与杨阳等[ 31]利用EST-SSR标记研究黄金茶群体遗传多样性及遗传分化分析结果相似。而对应的群体每代迁移数即基因流动估值( Nm)为2.022, 表现出中度的基因流动性。Wright[ 32]认为, 如果居群间基因流指数 Nm>1, 基因流便能发挥均质化作用, 可有效防止不同地区亚居群间遗传分化的产生; 反之如果 Nm<1, 则表示各亚居群间基因流受阻, 居群走向遗传分化。本研究中古蔺牛皮茶各居群间的基因流指数大于1, 说明整个群体内遗传分化较低。不同区域居群之间的分化程度比较低, 也表明地理位置对其选择压力不大。
本研究中, 古蔺牛皮茶基于ISSR标记的遗传距离与形态学特征之间未表现出相关性。类似的结果在一些野生植物居群中也出现过, Lopes等[ 33]在研究葡萄牙野生杨梅居群的遗传多态性时, 发现形态学性状和分子遗传特征之间不存在相关性( r=0.09), Tantasawat等[ 34]在研究一年生豇豆时也发现类似的结果。造成这种结果的原因是多方面的, Pirkhezri等[ 35]认为, 生物表现出来的外形特征可能是由多对等位基因共同决定的, 这些等位基因都会表现出相同或者相似的某一性状, 而这些等位基因和表型性状之间并不存在必然的相关性。此外, 本试验选择的ISSR引物本身存在一定局限性, 不可能将所有的决定表型性状的等位基因都扩增出来, 茶树生长的特殊环境也会对茶树生长发育产生影响, 从而影响茶树性状特征的表现。
古蔺牛皮茶在形态学特征和品质生化成分上呈现出多态性, 但居群的平均Nei’s基因多样性指数( H)为0.254, 平均Shannon’s信息指数( I)为0.392, 表明遗传多态性较低。7个居群的UPGMA遗传相似性聚类显示, 在相似系数为0.956处可将之分为3个组。居群间的遗传分化系数( Gst)是0.198, 证明古蔺牛皮茶居群的遗传多样性主要分布在自然居群内。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|