为阐明小麦支链淀粉合成的酶学机制, 以8个小麦品种的籽粒为材料, 采用非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定SBE同工酶类型、时空表达谱及亚基组成, 分析SBE同工酶空间分布特点和器官表达特异性。共检测到4种SBE同工酶, 其中B和SBEIIa分布在胚乳和叶片中, 而A和Di专一定位于胚乳中。在小麦籽粒灌浆过程中, Di和SBEIIa首先表达, 而后是B, A最后表达; 至灌浆末期, B和SBEIIa停止表达。SBE同工酶都是单亚基酶, 均由一条86~92 kD的多肽链组成。SBE同工酶的空间分布具有器官特异性, 并在籽粒发育进程中顺序表达。Di、B和SBEIIa是占主导地位的SBE同工酶, 可能是决定SBE总酶活性的主效应酶, 在籽粒和叶片支链淀粉合成中起关键作用。
This study aimed at disclosing the enzymatic mechanism in amylopectin synthesis in wheat (
淀粉是成熟小麦( Triticum aestivumL.)籽粒的主要组成成分, 约占籽粒干重的70%, 由直链淀粉和支链淀粉两种糖元多聚体组成[ 1]。研究证明, 直链淀粉与支链淀粉的比例以及支链淀粉的精细结构显著影响淀粉的理化性质, 进而决定面类制品, 尤其是面条、馒头等东方食品的外观品质和食用品质[ 2, 3]。
直链淀粉是由α-1,4糖苷键连接成的线性分子, 很少或没有α-1,6糖苷键分支, 由颗粒结合淀粉合酶(GBSS, EC2.4.1.21)催化合成; 支链淀粉则是由α-1,4糖苷键相连的葡萄糖链再通过α-1,6糖苷键连接分支而成的葡萄糖聚合体, 而淀粉分支酶(SBE, EC2.4.1.18)是唯一引入α-1,6糖苷键的淀粉合酶, 因此其性质和活性是影响支链淀粉精细结构和含量的重要因素[ 4, 5, 6, 7]。根据分子结构、免疫反应特性和底物特异性等, 将SBE分为SBEI和SBEII两种同工型。玉米( Zea mays L.)体外实验表明, 与SBEII相比, SBEI倾向于转移长的分支链, 当以直链淀粉为底物时活性较高; 而SBEII倾向于转移短的分支链, 以支链淀粉为底物时SBEII的活性高于SBEI[ 8, 9]。在小麦籽粒发育过程中, 二者的表达时期也有差别, SBEII从开花后第13天开始一直到第34天, 始终以恒定水平表达, 而SBEI则在灌浆中期开始表达, 随着灌浆进程的继续, 表达逐渐增强。小麦籽粒胚乳中, SBEI存在4种同工型, 即A、B、Di和Dii[ 10]。免疫杂交证明, SBEII也有两种同工型, 即SBEIIa和SBEIIb; SBEIIa存在于胚乳的可溶性基质, 而SBEIIb结合在淀粉粒上[ 11]。
Seo等[ 12]在葡聚糖分支酶缺失型酵母中表达玉米的SBE同工型组合, 结果SBEI自身不能单独在糖元合成中发挥作用, 只有在SBEIIa和SBEIIb存在的前提下才能行使功能; 而且SBEII在SBEI之前率先作用于淀粉合成的前体引物, 可能SBEII同工型作用的结果为SBEI提供底物。迄今为止在小麦中还没有鉴定出自然发生的SBEI突变体, 只有SBEII突变体才显示明显的淀粉表型效应。在水稻( Oryza sativaL.)中, ae (SBEIIb)突变体可产生高直链淀粉表型[ 13], 而在小麦中产生同样的表型效应需要同时抑制SBEIIa和SBEIIb的表达[ 14]。Schwall等[ 12]应用反义RNA技术同时抑制马铃薯的SBEII和SBEI的活性, 导致高直链淀粉含量表型, 而单独抑制SBEI却不能引起淀粉表型的显著改变。
目前, 究竟有多少种淀粉分支酶同工酶参与小麦支链淀粉生物合成过程尚不明确, 对SBEI和SBEII在支链淀粉合成中的作用机制不清楚, 而且关于小麦SBE不同同工酶的时空表达谱和器官分布特异性及酶亚基组成等也缺乏深入研究。本研究选用8个小麦品种, 利用非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和SDS聚丙烯酰胺凝胶电泳(SDS- PAGE), 检测了SBE同工酶类型, 鉴定了各同工酶时空表达谱及器官表达特异性, 分析了其亚基组成及结构, 以期阐明小麦不同器官支链淀粉合成的酶偏好特点, 明确SBE同工酶结构组成, 旨在为小麦品质改良提供理论依据。
不同种源地的8个小麦品种( 表1)均由山东省小麦研究中心种质资源室保存并提供。2013年10月上旬, 将所有品种播种于山东农业大学教学实习农场, 试验田块肥力均匀, 小区面积6 m2, 3次重复, 随机区组排列, 种植密度为120株m-2, 其他田间常规管理按小麦高产栽培技术规程进行。
于翌年小麦开花期选取生长均匀一致及穗大小相近的植株, 挂牌标记同一日开花的麦穗, 于开花后第5天开始取样, 之后每隔5 d取样一次, 直至开花后第35天完全成熟。取样时间为9:00—11:00, 每品种取3~5个标记穗及同株旗叶, 每穗取中部小穗籽粒, 籽粒和旗叶经液氮速冻30 min后放入-80℃超低温冰箱中保存, 用于聚丙烯酰胺凝胶电泳和酶活性测定。
| 表1 供试小麦品种成熟籽粒淀粉含量 Table 1 Starch contents of wheat cultivars tested at maturity stage |
1.2.1 粗酶液提取 参照Yamanouchi 和Nakamura[ 15]的方法, 稍作修改。称取0.4 g左右的小麦籽粒, 加1 mL提取液(含50 mmol L-1 HEPES- NaOH, pH 7.5, 5 mmol L-1 EDTA, 1 mmol L-1 DTT, 2 mmol L-1 KCl, 1%聚乙烯吡咯烷酮K-30)研磨成匀浆, 倒入5 mL离心管内, 再用3 mL提取液分2次冲洗研钵, 冲洗液一并倒入离心管, 4℃下15 000× g离心15 min, 上清液即为粗酶液。
1.2.2 SBE活性测定 参照李太贵等[ 16]的方法, 并作适当改进。将粗酶液稀释10倍, 取100 μL稀释液, 加1280 μL提取缓冲液及0.75%可溶性淀粉120 μL, 混匀, 37℃恒温水浴保温20min后置沸水浴1min终止反应, 加2 mL水(含0.2%浓HCl)稀释, 再加150 μL碘液显色10 min后在660nm波长下测OD值。另取一只试管, 加入粗酶液后立即置沸水浴1 min使酶灭活, 再按以上步骤加入各种溶液, 作为对照。分支酶活性以660 nm波长的吸光度下降百分率表示, 以每降低1%碘蓝值为一个酶活性单位。所有测定均重复3次。
1.2.3 Native-PAGE和酶活性检测 粗酶液参照Nagamine等[ 17]的方法, 参照Davis[ 18]的非变性聚丙烯酰胺凝胶电泳方法。分离胶浓度8.5%, 浓缩胶浓度5%, 恒流20 mA, 所有操作均在0~4℃下进行。参照Nagamine等[ 17]的方法进行酶活性染色。SBE非变性聚丙烯酰胺凝胶电泳及酶活性染色, 是基于淀粉遇碘显色原理。SBE催化分支的支链淀粉遇碘呈现棕褐色, 而磷酸化酶催化合成的线性直链淀粉则被染成蓝色。染色后按Morell等[ 10]的方法对SBE同工酶谱带进行位点判读和命名, 酶带浓度即代表酶活性大小。另外, 应用BandScan 5.0凝胶分析软件对电泳图谱进行定量扫描。
参照Hager等[ 19]和Dynan等[ 20]的方法回收目标蛋白。凝胶板活性染色后, 用刀片切下2 mm × 8 mm目的条带放入干净试管, 加1 mL双蒸水(含1 mmol L-1 DTT), 静置15 min, 其间更换一次缓冲液; 倒掉缓冲液, 加1 mL洗提buffer [50 mmol L-1 Tris-HCl, pH 7.5, 0.1% SDS, 1 mmol L-1 EDTA, 5 mmol L-1 DTT, 150 mmol L-1 NaCl, 0.1 mg mL-1牛血清白蛋白(BSA)], 捣碎凝胶并在25℃过夜洗提; 于4℃下15 000× g离心5 min以沉淀破碎凝胶, 将上清液转入另一个干净试管。
上清液加4倍体积冷丙酮(-20℃), 于-20℃放置30 min, 4℃下15 000× g离心10 min, 去丙酮上清液, 于室温下干燥沉淀, 并在100 μL样品buffer (62.5 mmol L-1 Tris-HCl, pH 6.8, 2% SDS, 5%巯基乙醇, 10%甘油)中重悬, 最后上样电泳。
参照Laemmli[ 21]的方法进行SDS-PAGE, 分离胶浓度10%, 浓缩胶浓度5%, 恒流25 mA, 上样量20 μL, 银染色。
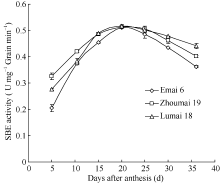
选择2个低支链淀粉和1个高支链淀粉品种测定灌浆过程中SBE活性动态变化, 发现SBE活性呈单峰曲线变化( 图1)。酶活性在灌浆初期较低, 随灌浆进程逐渐提高, 至开花后20 d达到峰值, 之后逐渐下降, 在灌浆后期还保持一定活性。3个品种之间变化趋势基本一致, 且酶活性大小差异不显著。
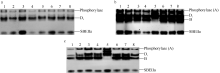
花后5 d, 从8个供试品种中共鉴定出2种同工酶, 分别命名为Di和SBEIIa[ 10]。电泳图谱显示, SBEIIa迁移率最快, 表明其携带的负电荷最多; Di迁移率较慢, 表明所携带负电荷较少, 根据谱带浓度, Di表达量较SBEIIa略高( 图2-a)。由于灌浆初期, 二者的活性较低, 淀粉的分支化程度亦低, 因此其谱带均被染成蓝色。另外, 8个品种均表达相同的同工酶类型, Di和SBEIIa的迁移率在品种间高度一致。因此, 在灌浆初期, 小麦籽粒中表达了至少2种SBE同工酶, 以启动灌浆早期的淀粉合成。
花后20 d, Di和SBEIIa继续稳定表达, 同时, 同工酶A和B亦表达( 图2-b)。从酶带浓度上可以判断, 同工酶Di表达量较大, 酶活性最高, B和SBEIIa位居其次, 且几乎所有品种均具有这3种同工酶, 暗示着其可能是小麦籽粒中对SBE活性贡献率最大的同工酶形式。值得注意的是, 鲁麦18缺失同工酶B, 但表达了一条新的、携带负电荷较少的谱带, 与其他7个品种的同工酶类型稍有不同。
花后30 d, 表达的SBE同工酶种类与花后20 d完全相同, 没有发现同工酶种类减少( 图2-c)。与花后20 d稍有不同的是, 酶带浓度变淡, 强度变细。说明在小麦灌浆后期, 随着淀粉合成速率减慢, 虽然各同工酶类型和数量不减少, 但其酶活性已显著降低。
2.3.1 籽粒SBE同工酶活性动态 以陕旱8675
为例, SBE同工酶谱带的浓度随灌浆进程而变化( 图3-a), 且与SBE酶活性动态变化( 图1)升降走势相契合。花后5 d和10 d时各同工酶谱带颜色较淡, 表达量较小; 花后15 d左右时染色明显变浓, 花后20 d时表达量接近峰值, 20~25 d的表达量差异不明显; 从30 d开始表达量明显降低; 至35 d灌浆结束, 酶带颜色又显著变淡。
SBE同工酶在灌浆过程中顺序表达。花后5 d只有Di和SBEIIa表达, 表达量较低; 花后10 d, 同工酶B开始表达, 此时三者的酶活性较低, 表达量都不高; 花后15 d, 同工酶A开始表达, 但表达量较低, 而其他各同工酶表达量明显增加, 这种表达谱一直持续到花后25 d; 花后30 d, 各同工酶表达量稍微下降, 但同工酶种类不减少; 至花后35 d灌浆结束, 各同工酶表达量明显降低, Di继续存在, B表达信号非常微弱, SBEIIa已经检测不到, 即已停止表达( 图3-a, b)。
2.3.2 叶片SBE同工酶活性动态 花后10 d, 旗叶中仅表达B和SBEIIa两种SBE同工酶, 且SBEIIa表达量较高, 活性较强。值得注意的是, 鲁麦18缺乏B同工酶, 但表达了一条活性很弱的Di同工酶, 这与籽粒灌浆高峰期的SBE表达谱相类似, 但又不完全相同( 图4-a)。
将花后10 d的小麦籽粒与其叶片的SBE放在一起电泳比对, 二者的SBE无论是表达量还是表达类型都具有显著差异。从表达量看, 籽粒中的SBE各同工酶条带浓而粗, 而叶片中的谱带淡而细, 说明籽粒酶活性远大于叶片; 从表达类型上看, 花后10 d的籽粒已表达Di、B和SBEIIa三种同工酶, 但叶片中仅同工酶B有弱表达( 图4-b)。
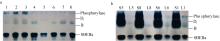
SBE活性染色后, 把电泳条带切下, 将蛋白质回收并进行SDS-PAGE。结果显示, Di、B和SBEIIa同工酶变性后均显示一条谱带, 分子量相近, 大约86~88 kD ( 图5), 这与前人的研究结果[ 10]基本一致。另外, 在内源磷酸化酶条带位置, 回收了一条比上述3种同工酶稍为细弱的蛋白带, 为内源磷酸化酶或同工酶A, 分子量大约为92 kD ( 图5)。
Hazard等[ 22]利用RNA干涉技术在四倍体小麦中产生 SBEIIa-A和 SBEIIa-B双突变, 结果发现, 突变体的直链淀粉含量增加22%。在大麦中, Carciofi等[ 23]通过协同沉默所有SBE基因也得到相同研究结果, 导致籽粒胚乳内只产生直链淀粉。本试验表明, 在小麦灌浆的高峰期, Di、B和SBEIIa大量表达, 酶活性最大。可以判断, 同工酶Di、B和SBEIIa, 尤其Di和SBEIIa是籽粒胚乳中占主导地位的SBE同工酶形式, 很可能是决定SBE总酶活性的主效应酶, 在灌浆高峰期和灌浆后期籽粒淀粉合成中起关键作用。
小麦籽粒胚乳中存在不同形式的SBE同工酶, 但在整个灌浆进程中, 其表达顺序不同, 暗示灌浆不同时期籽粒内淀粉的合成是由不同同工酶所催化完成的。因此小麦籽粒发育的不同时期, 可通过选择不同的同工酶系统启动淀粉合成过程。鲁麦18在灌浆高峰期和叶片中均缺失B同工酶, 这可能是不同品种之间的差异和遗传多态性表现。另外, 鲁麦18的支链淀粉含量较低, 而直链淀粉含量最高, 这是否是由于缺失B同工酶导致的结果, 目前这种相关性尚不能确定。
一般认为, 小麦叶片负责临时性淀粉的合成, 而籽粒胚乳贮藏淀粉合成的原料来自于叶片中的淀粉或其降解产物——蔗糖。本研究发现, SBE同工酶在叶片和籽粒中的空间分布具有器官特异性, 存在于籽粒中的Di和A同工酶在叶片中却检测不到其表达, 说明催化临时淀粉和贮藏淀粉的合成具有不同的酶偏好。暗示叶片和胚乳中参与支链淀粉合成的主效应酶类是不同的, 可能临时性淀粉和永久性淀粉的合成机制本身就存在差别, 叶和籽粒通过选择不同的SBE酶系统, 启动各自支链淀粉的合成。
按照Morell等[ 10]对SBE各同工酶的位点判读方法, SBEI应该有4种同工酶, 即A、Di、Dii和B。但是, 本实验在所有8个供试品种中, 没有检测到Dii同工酶的表达。这可能是不同品种之间遗传多态性所致。同时也说明, 并不是所有小麦品种都具有Dii同工酶。可能的情况是, Dii并不是SBE的主要形式, 在支链淀粉合成中只起辅助作用。
Morell等[ 10]和Rahman等[ 24]研究发现, 小麦开花后13~34 d, SBEII始终以恒定水平表达, 是淀粉分支酶中最基本的组成性同工型, 而SBEI直到花后18 d才检测到其表达, 可能在籽粒发育后期淀粉合成中发挥重要作用。本研究结果与此稍有不同, 无论是SBEI还是SBEII, 花后5 d已开始表达, 花后10 d已全部表达。另外, SBEII在灌浆末期表达量降低直至最终消失。其可能的原因是对SBE同工酶表达的检测时间不同, Morell等[ 10]和Rahman等[ 24]是从花后第13天开始取样, 而本试验则从花后第5天开始。此外, 试验材料、场所和当地栽培条件的差异及籽粒发育进程的不同也可能导致结果误差。
研究证明, 在谷物体内参与淀粉合成的酶可能以蛋白质复合体的形式行使功能, 其中一个酶的缺失将会导致复合体其他成员的活性钝化而降低或失去活性。另外许多淀粉合酶突变体的研究表明, 单个基因的突变往往导致其他淀粉合酶活性变化的多重效应。例如, 小麦磷酸化酶、SBEI和SBEIIb可形成多蛋白复合体[ 25, 26, 27]。但本研究并未检测到这种多酶复合体。首先这种多酶复合体可能只存在于植物体内, 一旦脱离体内环境, 复合体即解聚合; 其次, 复合体中蛋白质之间相互结合的化学键都是一些非共价键, 键合力弱, 即使提取液中有复合体存在, 在电场力作用下, 已经被分离成单个独立酶。同时也说明, 在体外淀粉合成中, SBE单个同工酶即可催化淀粉合成。本试验结果支持上述分析, 同工酶Di、B和SBEIIa在SDS-PAGE中均显示单一谱带, 且分子量大体一致, 说明上述3种同工酶都由一条多肽链组成, 是单亚基酶。至于同工酶A, 由于其和内源磷酸化酶的分子形状和大小及所带电荷极其接近, 以至于二者在Native-PAGE中的迁移率相同, 不易分开。因此, 在凝胶板中A条带位置, 回收的一条分子量大约为92 kD的蛋白带可能是同工酶A和内源磷酸化酶的重叠带。
小麦植株中共表达4种SBE同工酶, 其中B和SBEIIa分布在胚乳和叶片中, 而A和Di仅定位于胚乳中。在籽粒灌浆过程中SBE同工酶表达具有顺序性。SBE同工酶均为单亚基酶, 分子量约为86~92 kD。Di、B和SBEIIa是占主导地位的SBE同工酶, 在籽粒和叶片支链淀粉合成中起关键作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|