分析与小麦抗旱性密切相关的水分胁迫应答蛋白, 定位蛋白基因并挖掘与其连锁的分子标记对小麦抗旱分子辅助选择具有重要意义。在一年两点田间全生育期抗旱性鉴定基础上, 以-0.5 MPa PEG-6000模拟干旱胁迫处理小麦幼苗48 h, 并应用SDS-PAGE方法检测分子量约66.2 kD的水分胁迫应答蛋白, 分析其表达与小麦抗旱性的关系。在128个小麦品种(系)中, 检测出67份表达该蛋白, 另61份未表达该蛋白; 前者的平均抗旱指数为1.00, 而后者为0.80, 有极显著差异(
Proteins in response to water stress may closely relate to drought resistance in plants. Genes encoding such proteins are potentially used in wheat breeding aiming to improve drought resistance. The drought resistance of 128 wheat varieties (lines) was identified in two locations in the 2010-2011 growing season. These varieties were then subjected to SDS-PAGE analysis for a ~66.2 kD water stress responsive protein after seedling treatment with -0.5 MPa PEG-6000 for 48 h. Sixty-seven varieties showed expression of the target protein, whereas the remaining 61 varieties absented from the protein expression. Drought resistance index (DI) revealed significant difference between the two groups of varieties (1.00 for protein-positive varieties and 0.80 for protein-negative varieties,
小麦是我国的主要粮食作物, 在各种非生物胁迫因素中, 干旱已成为限制小麦生产的最主要因素, 选育和推广抗旱小麦品种是解决这一难题既经济又有效的途径之一[ 1, 2]。明确与小麦抗旱性密切相关的胁迫应答蛋白, 对其编码基因进行定位并获得紧密连锁的分子标记, 可为分子标记辅助选择育种奠定基础。
植物在受到水分胁迫后, 会诱导产生一系列生理、生化反应以应对水分匮缺[ 3]。胁迫压力作为信号可以诱导调节一些基因的表达, 进而促使蛋白质的组成改变, 或者合成新的蛋白质, 由于蛋白质直接参与植物的应激反应, 研究水分胁迫诱导蛋白有助于了解蛋白质与植物适应环境压力之间的关系[ 4, 5, 6]。Schuppler等[ 7]通过轻度水分胁迫处理小麦幼苗, 发现叶片内分子量34 kD的蛋白含量明显增加。石峰等[ 8]分析了18个小麦品种水分胁迫诱导蛋白与抗旱性的关系, 发现小麦在水分胁迫后能够引起分子量约66.2 kD应答蛋白的特异表达, 该蛋白在中等及以上抗旱性品种中均有表达, 而在弱抗旱性品种中不表达; 随后, 张洁等[ 9]利用30个冬小麦品种(系)研究发现, 该蛋白与苗期品种的抗旱性紧密相关, 并提出此蛋白在水分胁迫下的表达可作为鉴定品种抗旱性的一项指标。任万杰等[ 10]对150份不同水旱生态型的冬小麦品种(系)进行不同水分条件下的应答蛋白表达分析, 发现该蛋白表达的类型与品种水旱生态型间呈极显著相关。王婧等[ 11]利用SSR标记分析邯郸6050×西农2208组合的F2群体, 将该应答蛋白基因初步定位在5A染色体上, 命名为“ RpDD”, 但仅获得目标基因同侧的2个连锁SSR标记 Xgwm129和 Xgwm304。
本研究选取128份不同水旱生态型的小麦品种(系), 鉴定其一年两点田间抗旱性, 旨在进一步明确分子量约66.2 kD的水分胁迫应答蛋白与小麦抗旱性的关系。同时, 选取杂交组合晋麦47×西农2208的230个F3株系对目标蛋白基因进行定位, 开发可用于小麦抗旱选择的分子标记。
选用128份国内不同水旱生态型小麦品种(系)进行该约66.2 kD的目标蛋白与小麦抗旱性关系的分析。为定位该目标蛋白基因, 选取杂交组合晋麦47×西农2208的230个F3株系构建分离群体进行遗传分析。晋麦47属抗旱性强品种, 水分胁迫后表达目标蛋白; 西农2208属抗旱性极弱品种, 水分胁迫后不表达目标蛋白。
2010—2011年度在陕西杨凌和岐山两点鉴定128份小麦品种(系)全生育期的抗旱性。田间试验采用裂区设计, 水分差异为主处理, 设置为人工灌溉和雨养, 每处理3次重复; 品种为副处理, 每品种2行, 行长2.0 m, 行距0.25 m, 株距0.033 m。雨养区靠自然降水, 两地小麦生长期降雨量分别为186.8 mm[ 12]和191.1 mm (岐山县气象局), 水灌区除自然降水外冬季灌溉1次, 灌溉量为780 m3 hm-2。其他栽培措施与当地大田生产所用的一致。成熟后每品种(系)收获0.046 m2, 脱粒、晾晒后称重, 计算单位面积产量。参照兰巨生[ 13]的方法计算抗旱指数。
1.3.1 幼苗的培养与处理 随机取每个品种(系)和F3株系的种子各24粒, 自来水催芽至露白, 腹沟向下均匀摆放在铺有单层滤纸的苗床上。22℃避光条件下水培7 d, 然后移至室内光照充足处, 温度21℃±3℃下继续培养, 待小麦幼苗长至两叶时, 倒掉苗床中水分, 加入-0.5 MPa PEG-6000溶液15 mL, 第2天再加入10 mL, 进行48 h胁迫处理。参照Michel等[ 14]介绍的方法配制PEG-6000溶液。
1.3.2 叶片蛋白的提取与SDS-PAGE电泳 经水分胁迫处理后, 剪取每个幼苗等量叶片, 按照改进的TCA-丙酮法[ 10]提取叶片蛋白, 然后参照范锋贵等[ 2]描述的方法进行SDS-PAGE电泳和目标蛋白表达检测。
1.3.3 图像采集及分析 经染色、显影后采集凝胶图像。将128个品种(系)分为目标蛋白表达和不表达2类; 将230个F3株系分为所有单株均表达目标蛋白(I)、单株表达分离(II)和所有单株均不表达(III) 3类, 同时根据F3株系的目标蛋白表达类型推断其对应F2单株的基因型, 分析目标蛋白基因在后代的遗传分离特点。
为明确目标蛋白表达与小麦抗旱性的关系, 分析目标蛋白表达与不表达品种(系)的抗旱性, 应用SPSS17.0软件对其抗旱指数进行差异显著性检验。
用CTAB法[ 15]提取亲本和F3株系的基因组DNA。分别选择10个I类和10个III类株系的DNA等量混合, 构成目标蛋白表达(Br)和不表达(Bs)基因池。随机选取分布于小麦21条染色体上的126对SSR引物[ 16, 17, 18] (http://wheat.pw.usda.gov/), 以晋麦47、西农2208、Br、Bs和F3作图群体的DNA为模板进行PCR扩增。所有引物均由上海英骏技术公司合成。PCR反应体系为10 μL, 包括10 × buffer 1.0 μL、50 ng μL-1 DNA 1.0 μL、2.5 mmol L-1 dNTPs 0.6 μL、10 μmol L-1上下游引物各0.25 μL、5 U μL-1 Taq酶0.1 μL和6.8 μL ddH2O。用MJ Research PTC-200型PCR仪进行扩增反应, 扩增程序为94℃预变性 5 min; 95℃变性40 s, 50~65℃退火40 s, 72℃延伸 1 min, 共35个循环; 最后72℃延伸10 min。扩增产物经6%变性聚丙烯酰胺凝胶电泳, 硝酸银染色显影后观察并记录。
根据扩增产物的多态性, 筛选与目标蛋白表达亲本一致的SSR标记, 与晋麦47带型一致的记作“2”, 与西农2208带型一致的记作“0”, 杂合带型记作“1”, 结合F3代株系蛋白表达类型, 用QTL IciMapping软件进行多态性分析, 得到各标记的遗传连锁数据, 并绘制目标蛋白基因 RpDD的遗传连锁图谱。
用CTAB法[ 15]提取128份小麦品种(系)的基因组DNA, 用与 RpDD两侧紧密连锁的分子标记检测, 分析紧密连锁标记的有效性及其与小麦抗旱性的关系, 扩增程序与带型统计方法同前。
一年两点全生育期的抗旱性鉴定结果显示, 128份小麦品种(系)之间的抗旱指数变异明显, 可分为极强、强、中等、弱和极弱5个抗旱性等级, 每个等级所包含的品种数不同(表1)。
| 表1 128份小麦品种(系)全生育期抗旱性鉴定结果 Table 1 The drought resistance of 128 wheat cultivars (lines) in whole growth period |
经-0.5 MPa PEG-6000胁迫处理48 h后, 应用SDS-PAGE方法检测目标蛋白, 128个品种(系)中67个检测到目标蛋白, 61个未检测到目标蛋白。随着抗旱性等级的降低, 水分胁迫后表达目标蛋白的品种(系)数所占的比例减少(表1), 表明目标蛋白是否表达与品种(系)抗旱性等级有密切关系。
表达目标蛋白的67个品种(系)的平均抗旱指数为1.00, 不表达目标蛋白的61个品种(系)的平均抗旱指数平均值为0.80, 两者有极显著差异( P<0.01)。说明该约66.2 kD水分胁迫应答蛋白的表达与品种(系)的抗旱性密切相关, 可作为检验品种(系)抗旱性的一项指标。
-0.5 MPa PEG-6000处理后, 根据各株系中单株检测结果, 将230个F3株系分为I类(全表达) 56个、II类(分离) 113个、III类(全不表达) 61个(表2和图1)。根据F3株系目标蛋白的表达类型判断其对应的F2单株基因型, 即F2单株有56份由纯合表达基因型组成, 113份由杂合基因型组成, 61份由纯合不表达基因型组成, 其分离符合1∶2∶1遗传比例(χ2=0.29, χ20.05= 5.99), 表明在杂交组合晋麦47×西农2208后代群体中目标蛋白由1对显性基因控制。
| 表2 F2群体中 RpDD等位基因及其微卫星标记位点的分离 Table 2 Segregations of gene RpDDand its microsatellite markers in F2 population |
随机选取分布于小麦21条染色体上的126对SSR引物, 对晋麦47、西农2208、表达池(Br)和不表
达池(Bs)进行多态性筛选, 结果5A染色体上的引物 Xgwm129和 Xgwm304在双亲及两池间扩增出一致的多态性片段, 这也验证了王婧等[ 11]的研究结果。随后选取小麦5A染色体上的57对SSR引物在亲本和两池间进行多态性筛选, 结果除以上2对引物外, Xbarc56、 Xbarc117和 Xbarc197也在亲本和两池间表现出一致的多态性, 上述5对SSR引物都位于小麦染色体5A短臂上。随后利用这5对引物对杂交组合晋麦47×西农2208的230份F3株系基因组DNA进行扩增, 结果蛋白表达为I类型的株系多数扩增出与晋麦47相同的带型, 蛋白表达为III类型的株系多数扩增出与西农2208一致的带型, 蛋白表达为II类型的大部分扩增出双亲的组合带型, 由此表明这5个SSR标记位点与目标基因连锁(表2)。图2为引物 Xbarc56和 Xbarc117对部分F3株系的PCR扩增图谱。统计各位点的带型, 用QTL IciMapping软件进行连锁分析, 绘制了目标基因 RpDD的遗传连锁图(图3)。
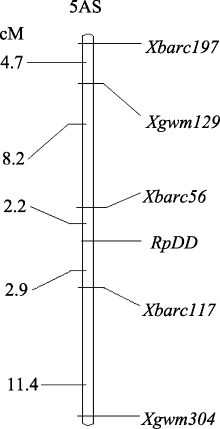 | 图3 编码蛋白基因 RpDD在5AS上的微卫星遗传连锁图谱Fig. 3 Linkage map of gene RpDD on chromosome 5AS in wheat based on microsatellite markers |
.
利用目标蛋白基因 RpDD两侧紧密连锁的SSR标记 Xbarc56和 Xbarc117, 对来自全国不同水旱生态型的128份小麦品种(系)进行检测。结果表明, 73份品种(系)在 Xbarc56位点扩增出与晋麦47相同的带型, 其中58份水分胁迫后表达目标蛋白; 70份品种(系)在 Xbarc117位点扩增出与晋麦47相同带型, 其中59份水分胁迫后表达目标蛋白。67份品种(系)在 Xbarc56和 Xbarc117两位点均能扩增出与晋麦47一致的带型, 其中有58份品种(系)在水分胁迫条件下表达目标蛋白, 占86.6%; 这67份品种(系)包括5份抗旱性极强、11份强、48份中等、2份弱和1份极弱的品种(系), 在对应抗旱性等级品种(系)中所占的比例分别为100.0%、84.6%、81.4%、6.5%和5.0%, 即随着抗旱性的降低, 在两标记位点扩均增出与晋麦47相同带型品种(系)的数量减少, 而且这67份品种(系)的抗旱指数平均值(1.02)极显著高于其余61份的抗旱指数平均值(0.78)( P<0.01)。以上分析说明两标记与品种(系)的抗旱性有极密切的关系, 可作为小麦品种(系)抗旱性鉴定和筛选的分子指标。
小麦的抗旱性是由多个因素共同决定的复杂生物学性状, 研究小麦的抗旱性鉴定指标, 提高抗旱性鉴定与选择的准确性, 对于选育小麦抗旱新品种具有重要意义。抗旱指数既反映作物品种本身的抗旱性又反映其潜在的旱地产量, 是目前普遍采用的抗旱育种和区域试验的综合性抗旱鉴定指标[ 13]。在小麦的抗旱性评价中, 许多学者直接利用小麦品种在不同水分生产条件下的产量表现来获得抗旱指数, 为评价小麦抗旱性和稳产性提供了有价值的参考[ 19]。陕西的杨凌和岐山两地自然降雨量只能基本满足小麦完成生长周期, 人工灌溉为小麦提供了更好的水分条件, 这样能够较好地反映小麦各品种(系)的抗旱特点, 为计算抗旱指数和合理评价小麦的抗旱性奠定基础。本研究采用人工灌溉和自然降雨为栽培条件, 以128份小麦品种(系)在两种水分条件下的产量表现计算抗旱指数, 评价了小麦的抗旱性, 其中陕150等20份品种(系)抗旱性极弱, 武农148等31份品种(系)抗旱性弱, 鲁麦21等59份品种(系)抗旱性中等, 晋麦47等13份品种(系)抗旱性强, 临旱917等5份品种(系)抗旱性极强, 筛选出的抗旱品种(系)可作为小麦育种的种质资源。
小麦在受到干旱胁迫时, 胁迫压力作为一种信号被植物体识别并应答, 从而使一些与适应干旱胁迫有关的基因启动转录, 进而产生胁迫应答蛋白[ 4, 5]。研究表明, 此类蛋白与小麦的抗旱性相关[ 8, 9, 10]。本研究选用来自全国不同水旱生态型的128份小麦品种(系)为材料, 明确了分子量约66.2 kD的水分胁迫应答蛋白在不同品种(系)中的表达, 进一步证实在水分胁迫下表达的目标蛋白可作为鉴定小麦抗旱性的指标。本试验中抗旱性极强的5份品种(系)全部表达目标蛋白, 抗旱性极弱的20份品种(系)中有18份不表达目标蛋白, 说明抗旱性不同的品种在受到水分胁迫时, 其应答蛋白的形成存在差异。这可能由于抗旱品种表现出对干旱的耐力有其内在的分子基础, 在同样的干旱条件下, 抗旱品种可能产生更多的蛋白质, 或者细胞内一些结构蛋白在缺水的情况下被蛋白水解酶分解, 增加细胞内的应答蛋白质, 以抵抗缺水的危害[ 20]。至于该蛋白的作用是渗透调节、活性氧清除、维持细胞膜结构稳定性或者是防止蛋白质及膜的变性, 还需要进一步研究。前人采用少量材料研究发现目标蛋白在抗旱性强的品种中表达, 而在抗旱性极弱的品种中不表达[ 8, 9]。本研究发现在抗旱性强的13份品种(系)中秦麦1号和天94-3不表达目标蛋白; 在抗旱性极弱的20份品种(系)中潍麦8号和济麦19表达目标蛋白, 这可能与本研究所选材料变异类型较为丰富有关, 也可能还有其他基因参与调控小麦在水分胁迫下的应答反应, 需要进一步研究证实。
王婧等[ 11]将目标蛋白基因定位于小麦5A上, 与本研究结果相一致。任万杰[ 21]对F2群体进行遗传连锁分析后, 将目标蛋白基因定位于小麦5D上, 由于F2群体无法由蛋白表达确定基因型的纯合或杂合, 所以本研究采用F3株系蛋白表达表型推断其对应F2单株的基因型, 能够准确鉴定出纯合与杂合基因型, 使基因定位的结果更准确, 这也可能是本文与其研究结果不一致的主要原因之一。也许在小麦5A和5D上存在编码该蛋白的同源基因, 这些应答蛋白表达可能受到其他因素的调控, 此推断还需进一步试验证实。本文筛选出了5个位于小麦5AS上与目标蛋白基因 RpDD连锁的SSR标记, 用紧密连锁的标记 Xbarc56和 Xbarc117对128份品种(系)的检测结果显示, 两标记与品种(系)的抗旱性有着极为密切的关系, 在67份具有与晋麦47相同的标记位点的品种(系)中, 有86.6%的品种(系)在水分胁迫条件下表达目标蛋白, 这与SSR标记与目标蛋白基因 RpDD位点还存在一定距离, 不是基因序列内部标记有关, 还需要进行该基因的精细定位和更紧密或共分离标记的筛选和开发。
研究表明, 小麦5A染色体在抵抗非生物胁迫方面起着重要的作用。单雷等[ 22]以耐盐新品种山融3号与盐敏感品种济南17配置杂交组合, SSR标记分析其杂交后代, 发现位于5A上的标记 Xbarc180、 Xbarc117、 Xgwm304、 Xgwm666与耐盐基因连锁。Simon-Sarkadi等[ 23]以5A缺失系为材料, 也发现5A染色体上存在着耐盐相关的基因位点。杨凯等[ 24]以代换系为材料, 将干旱胁迫下控制小麦叶片脯氨酸积累的基因定位于5A和5D上。高宁等[ 25]利用小麦DH群体, 在5A等染色体上发现种子在水分胁迫下相对发芽势的数量性状位点。Ma等[ 26]发现小麦5A染色体上存在着耐铝胁迫的位点。Båga等[ 27]利用DH群体将小麦耐低温胁迫的基因定位在5A上。Peleg等[ 28]以重组自交系为材料, 研究硬粒小麦在干旱胁迫条件下的QTL位点, 表明5A等染色体存在小麦适应干旱胁迫的主效基因。本研究将与小麦抗旱性密切相关的水分胁迫应蛋白基因定位在5AS上, 进一步表明在小麦5A染色体上存在着与抵抗非生物胁迫相关的基因, 这也为小麦抗逆分子辅助选择提供依据。
分子量约66.2 kD水分胁迫应答蛋白与小麦抗旱性密切相关, 该蛋白在水分胁迫条件下表达可作为品种(系)抗旱性鉴定的一项指标; 在杂交组合晋麦47×西农2208的群体后代中该目标蛋白表达由1对显性基因控制, 位于5A染色体短臂上, 居于分子标记 Xbarc56与 Xbarc117之间, 遗传距离分别为 2.2 cM和2.9 cM。这2个标记与小麦的抗旱性密切相关, 可为小麦抗旱性分子辅助选择育种提供依据。
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|




 -end of primers. A total of 540 microsatellite-flanking primer pairs were developed, tested, and annotated from random genomic libraries. Primer pairs and associated loci were assigned identifiers prefixed with BARC (the acronym for the USDA-ARS Beltsville Agricultural Research Center) or Xbarc, respectively. A subset of 315 primer sets was used to map 347 loci. One hundred and twenty-five loci were localized by physical mapping alone. Of the 222 loci mapped with the ITMI population, 126 were also physically mapped. Considering all mapped loci, 126, 125, and 96 mapped to the A, B, and D genomes, respectively. Twenty-three of the new loci were positioned in gaps larger than 10 cM in the map based on pre-existing markers, and 14 mapped to the ends of chromosomes. The length of the linkage map was extended by 80.7 cM. Map positions were consistent for 111 of the 126 loci positioned by both genetic and physical mapping. The majority of the 15 discrepancies between genetic and physical mapping involved chromosome group 5.
-end of primers. A total of 540 microsatellite-flanking primer pairs were developed, tested, and annotated from random genomic libraries. Primer pairs and associated loci were assigned identifiers prefixed with BARC (the acronym for the USDA-ARS Beltsville Agricultural Research Center) or Xbarc, respectively. A subset of 315 primer sets was used to map 347 loci. One hundred and twenty-five loci were localized by physical mapping alone. Of the 222 loci mapped with the ITMI population, 126 were also physically mapped. Considering all mapped loci, 126, 125, and 96 mapped to the A, B, and D genomes, respectively. Twenty-three of the new loci were positioned in gaps larger than 10 cM in the map based on pre-existing markers, and 14 mapped to the ends of chromosomes. The length of the linkage map was extended by 80.7 cM. Map positions were consistent for 111 of the 126 loci positioned by both genetic and physical mapping. The majority of the 15 discrepancies between genetic and physical mapping involved chromosome group 5.