为建立以玉米幼苗为外植体的高效再生体系, 克服幼胚取材的限制, 本研究选取萌发3 d的玉米幼苗作为供体材料, 研究其不同部位的再生能力。分别研究了种子萌发时的光照条件, N6培养基中Ca2+浓度, 及6个不同基因型对芽尖和根尖愈伤组织诱导率和分化率的影响。结果显示, 黑暗条件下萌发的幼苗, 其芽尖和根尖更适合作为外植体, 诱导培养基中添加终浓度为5 mmol L-1的CaCl2时的愈伤组织诱导率最高, 不同基因型的玉米愈伤组织的诱导率和分化率存在差异, 但影响趋势相同, 且同一基因型的不同外植体形成的愈伤组织形态相似, 分化率也相似。最后结论是黑暗条件下萌发3 d的齐319和鲁原92的幼苗, 可以代替玉米幼胚作为外植体用于组织培养研究。
Currently, immature embryo is the most widely used explant for maize regeneration and transformation. However, this material source is restricted by geographical condition, developmental stages and the growing season. Here, we isolated different parts the of three-day-old seedlings to study their regeneration capacity, aiming to establish an alternative efficient regeneration system for maize. Using the shoot tips and primary root of three-day-old seedlings of maize germinated in dark and light as explants, the effects of illumination, genotype, and different concentration of Ca2+ in the induction medium on the primary callus induction rate and seedling differentiation rate were analysed. The result showed that shoot tips and the root tips derived from seedlings germinated in the dark were better source materials. Root materials isolated from the mature zone of the primary root could not be weed to induce primary callus. The primary callus induction rate was the highest when 5 mmol L-1 of Ca2+ was added in the induction medium. The callus induction and differentiation rates of both explants from the six different genotypes were very different. However, the effect of the genotype on primary callus induction and differentiation rates from the two explants was consistent. The differentiation rate and the morphology of the callus from the two explants of the same genotype were also similar. From above, we propose that the 3-day-old seedlings of Qi 319 and Luyuan 92 germinated in the dark have the potential to replace the immature embryos for maize tissue culture in the future.
玉米( Zea maysL .)是重要的粮食和饲用作物, 也是重要的工业原料[ 1]。近年来, 基因工程技术已在玉米遗传育种及品种改良中成功应用, 并取得巨大成就[ 2]。而高效的玉米组培和再生体系是玉米遗传转化工作的基础。幼胚凭借其高效成熟的再生体系和转化体系成为目前应用最广泛的外植体, 然而, 幼胚的取材受到地理条件、生长季节和发育阶段的限制。因此, 寻求取材方便、不受地理条件和生长季节限制、再生率较高的外植体代替玉米幼胚对玉米遗传转化改良工作具有重要意义[ 3]。自Green和Phillips[ 4]首次利用玉米幼胚培养获得再生植株后, 至今已经从许多玉米外植体中诱导出胚性愈伤组织, 例如幼嫩花序[ 5]、花药[ 6]、雌雄幼穗[ 7, 8]、丛生芽[ 9, 10]、腋芽[ 11]、胚芽鞘节[ 12]等。但这些外植体存在再生率不高, 受季节限制, 取材量极少, 实用性较差等缺点。相比之下, 成熟种子易于大量保存, 可以随时取用, 不受季节和用量等限制, 因此成熟种子或其萌发后的幼苗是替代玉米幼胚的理想外植体来源。以玉米幼苗的幼叶作为外植体进行组织培养, 早在1987年就有报道[ 13], 但效率极低。直到2007年, Ahmadabadi等[ 14]以萌发到5~10 cm (大约7 d)的玉米幼苗的幼嫩叶段作为外植体, 建立起了再生体系。但是该体系仅适用于特定的基因型, 并未在玉米遗传转化方面得到广泛应用。因此, 改善幼苗的再生体系及转化体系, 提高其再生率, 具有重要意义。我们选用萌发3 d的玉米幼苗(刚刚发芽)为供体材料, 将其分为芽、根尖、根的非根尖区三部分, 分别进行再生能力的研究, 从而建立以幼苗为外植体供体的高效再生体系, 为替代幼胚作为遗传转化受体奠定基础。
选用本实验室保存的齐319、昌7-2、鲁原92、Mo17、478和178等6个育种上常用的玉米自交系为试验材料。
选取饱满的玉米种子, 用70%酒精和0.1%的HgCl2分别消毒10 min和15 min, 再用无菌水冲洗3~4遍, 接种于发芽培养基, 置光照培养箱(16 h光照, 光强80 μmol m-2 s-1; 8 h黑暗)和黑暗培养箱(24 h黑暗) 28℃培养。
待芽长至1~2 cm (约3 d)时, 取幼苗的芽尖、根尖和根的其他区段, 分别切成大约1 mm × 2 mm的碎片, 接种于诱导培养基, 置于28℃黑暗条件下培养, 4周后观察愈伤组织生长状况, 统计愈伤组织诱导率。将诱导出的初级愈伤组织转入继代培养基中培养, 每2周继代1次。继代2次后观察愈伤组织形态。然后转入分化培养基于光照培养箱(28℃, 16 h光照; 26℃, 8 h黑暗)中培养, 3周后分别统计分化率。分化苗长至5~10 cm时, 转入生根培养基促进生根, 待再生苗长出根后, 移栽至小盆中。
采用Microsoft Excel 2003进行数据计算及作图, 用DPS 5.12统计软件进行方差分析。
初级愈伤诱导率(%) = (初级愈伤组织总数/接种外植体总数)×100
分化率(%) = (分化出芽的愈伤组织总数/接种外植体总数)×100
再生率(%) = (再生出的植株总数/接种外植体总数)×100
每个试验均重复3次, 结果取平均值。
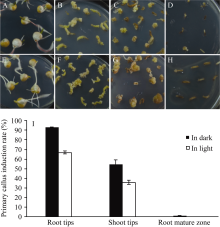
黑暗和光照条件下萌发的幼苗, 其根尖和芽尖均能诱导出愈伤组织, 而根的其他部位不能诱导出愈伤组织(图1-D, H, I)。其中, 光照条件下根尖和芽尖的初级愈伤组织诱导率分别为66.88%和35.74%, 而黑暗条件下分别为92.98%和54.59%。说明黑暗条件下初级愈伤组织诱导率远远高于光照条件下, 因此, 我们选取黑暗条件下萌发3 d的玉米幼苗芽尖和根尖作为外植体进行进一步研究。
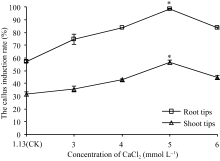
付凤玲等[ 17]实验表明诱导培养基中添加适当浓度的CaCl2有利于玉米幼胚的愈伤组织诱导, 当N6培养基中CaCl2浓度达到5 mmol L-1时, 幼胚的愈伤组织诱导率最高。因此, 为了分析研究Ca2+浓度对芽尖、根尖愈伤组织诱导率是否具有相似的影响, 本研究在N6诱导培养基中添加不同浓度的CaCl2, 其终浓度分别为3、4、5和6 mmol L-1, 并以原N6培养基(Ca2+浓度为1.13 mmol L-1)为对照, 分别选取玉米自交系齐319的芽尖和根尖接种到以上5种诱导培养基上, 4周后统计愈伤组织诱导率。结果表明, Ca2+对芽尖和根尖2种外植体愈伤组织诱导率的影响趋势相同, 两种外植体在Ca2+浓度为5 mmol L-1的诱导培养基上初级愈伤组织诱导率都达到最高, 分别为56.67% (芽尖)和98.65% (根尖), 比对照显著提高; 当Ca2+浓度提高到6 mmol L-1时, 愈伤组织诱导率开始下降(图2)。因此, 认为诱导培养基的最佳Ca2+浓度为5 mmol L-1, 在此浓度下产生的愈伤组织颗粒疏散, 色泽鲜黄(图3-A, E), 比对照培养基上产生的愈伤组织更符合Armstrong等[ 18]介绍的胚性愈伤组织鉴别标准。
以玉米自交系齐319为材料, 分别选取其芽尖和根尖来源的胚性愈伤组织(图3-A, E)接种于分化培养基上培养并观察其愈伤组织分化情况。结果显示, 26.17%的芽尖和25.78%的根尖均能分化出芽(表2, 图3-C, G), 并可以成功实现再生(图3-D, H), 芽尖和根尖的植株再生率分别达到35.00%和38.48% (表2)(部分分化的愈伤组织一个可以再生出多棵植株)。
| 表2 不同玉米外植体来源的愈伤组织诱导率及分化率比较 Table 2 Induction rate and differentiation rates of the callus from the different maize explants |
为了研究不同基因型对芽尖和根尖这2种外植体的愈伤组织诱导率、愈伤组织形态及愈伤组织分化率的影响, 除齐319外, 我们又选择了5个基因型的玉米幼苗, 对其芽尖和根尖的再生性进行比较。结果显示, 6个自交系的芽尖和根尖均能产生愈伤组织, 不同基因型的两种外植体产生的初级愈伤组织频率趋势基本相同, 根尖诱导愈伤组织比芽尖的高, 其中齐319、鲁原92的2种外植体初级愈伤组织诱导率, 分别为97.62% (齐319根尖)和54.59% (齐319芽尖), 91.32% (鲁原92根尖)和51.04% (鲁原92芽尖)(图4-A), 相对较高。
尽管6个玉米自交系的根尖的初级愈伤组织诱导率比芽尖的高, 但是其胚性愈伤组织诱导率和芽尖相比差异并不像初级愈伤组织诱导率那么显著(图4-B), 不同基因型的两种外植体产生的胚性愈伤组织的趋势也基本相同, 同种基因型的根尖的胚性愈伤组织诱导率和芽尖相似或比芽尖的稍高一些。其中齐319的两种外植体的胚性愈伤组织相对于其他6个自交系都比较高, 分别达到38.79% (根尖)和30.21% (芽尖)(图4-B)。
为评价愈伤组织的继代能力和形成愈伤组织的质量, 将6个基因型的芽尖和根尖形成的初级愈伤组织分别接种到继代培养基上, 2周继代一次, 继代2次后观察芽尖和根尖形成的愈伤组织形态。6个自交系形成的愈伤组织主要分为3种类型, 其中齐319和鲁原92形成的愈伤组织多数为淡黄色, 生长旺盛, 颗粒疏散, 更符合Bajaj[ 19]对II型愈伤组织的鉴别标准。Mo17多数形成I型愈伤组织, 大部分不能长期继代; 昌7-2、178和478形成的愈伤组织结构松软, 且水渍化严重, 继代中容易褐化死亡(表3)。最后分别选取6个基因型来源的芽尖、根尖形成的胚性愈伤组织, 接种到分化培养基上, 2周后统计分化率, 结果显示, 同基因型的芽尖、根尖形成的胚性愈伤组织分化率差异不显著, 不同基因型的这两种外植体来源的胚性愈伤组织分化率趋势也基本相同(图4-C)。
本研究表明, 黑暗条件下萌发的玉米幼苗的芽尖和根尖的愈伤组织诱导率明显比光照条件下高。这可能是因为黑暗条件下萌发玉米幼苗的光调控基因表达受阻, 光形态建成受到抑制[ 20], 分化程度比光照条件下低。因此黑暗条件下萌发的玉米幼苗的芽尖、根尖更适合作为外植体供体。
张东向等[ 21]发现玉米叶片的愈伤组织诱导率与内源ABA活性正相关, 而Ca2+结合钙调蛋白在ABA的基因诱导表达过程中起重要的作用[ 22]。本实验发现N6培养基中的Ca2+浓度由1.13 mmol L-1提高到5.00 mmol L-1, 不仅芽尖和根尖的愈伤组织诱导率达到最高, 而且愈伤组织形态也得到了改善。这些结果表明, Ca2+对这3种不同外植体形成愈伤组织的影响模式可能相同。
Huang等[ 23]以在含有4 mg L-1的2,4-D的无菌水中浸泡3 d的玉米自交系的成熟胚为材料, 进行组织培养, 其中玉米自交系齐319获得了21.10%的芽分化率, 而本实验选择黑暗条件下在发芽培养基上萌发3 d的玉米幼苗作为芽尖供体, 玉米自交系获得了25.78%的芽分化率, 而且有时, 一个愈伤组织上分化的芽可以再生多棵植株, 因此植株再生率高达35%。本实验所用的芽尖作为外植体较Huang等[ 23]实验中选用的成熟胚芽分化率虽然提高并不明显, 但是, 本实验所用的方法简单方便, 直接将萌发的玉米幼嫩芽尖切碎即可作为外植体诱导愈伤组织, 取材方便, 且取材量多, 而Huang等[ 23]实验所用的浸泡3 d的玉米成熟胚芽剥取较复杂, 且取材量少; 此外Huang等[ 23]将种子萌发所得的幼根直接弃掉, 而我们却对萌发3 d的幼苗的不同部位进行了再生研究, 把我们经常忽略的幼根分为根尖和非根尖部位分别进行了再生, 发现根尖基本都可以诱导出初级愈伤组织, 而且芽尖和根尖来源的胚性愈伤组织形态相似, 分化率差异也不显著。玉米是否能够成功得到再生苗取决于其良好的愈伤组织形态[ 24], 同一个基因型的玉米幼苗的芽尖和根尖来源的胚性愈伤组织形态相似, 因此其分化率也差异不显著, 故本实验所用的萌发3 d的幼苗来源的芽尖和根尖这两种外植体形成的愈伤组织可以一起进行分化。这样与Huang等[ 23]实验中所用的成熟胚相比, 愈伤组织的取材总量加多, 故幼苗再生效率提高了。
| 表3 6个不同基因型来源的芽尖和根尖形成诱导的愈伤组织形态 Table 3 Comparison of growth rate of shoot tips and root tips-derived callus of six maize genotypes |
在相同的条件下, 供试的6个基因型的玉米芽尖和根尖均能诱导产生初级愈伤组织, 同一基因型的芽尖与根尖形成的愈伤组织形态基本一致, 且与陈靖等[ 25, 26]所描述的相同基因型的幼胚形成的愈伤组织形态也基本一致, 这表明基因型仍然是限制愈伤组织诱导的重要因素, 通过选择不同的外植体并不能从根本上突破基因型的限制, 这与前人报道的玉米组织培养中对基因型的依赖是一致的[ 27]。研究表明玉米成功得到再生苗取决于其良好的愈伤组织形态, 本实验选用的6个基因型中, 齐319和鲁原92的芽尖和根尖形成的愈伤组织最优质, 具有较高的分化率, 可以代替玉米幼胚用于玉米遗传转化研究。
黑暗条件下萌发3 d的玉米自交系齐319和鲁原92的幼苗, 可以代替玉米幼胚作为外植体用于组织培养研究, 为后期遗传转化研究奠定了基础。
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|