采用染色体步移技术分别克隆3个花生质体型酰基载体蛋白(ACP)基因的5°侧翼调控区序列,
We cloned the 5′ flanking fragments of three peanut plastidial acyl carrier protein (ACP) genes
植物质体型酰基载体蛋白(acyl carrier protein, ACP)是一类小分子的酸性蛋白, 它作为辅因子在植物脂肪酸合成途径的脂肪酸链延伸、还原及脱水过程中起重要作用。通常植物体内含有多拷贝的质体型 ACP基因, 编码不同的ACP蛋白异构体。研究发现, 部分基因为组成型表达, 执行看家基因的功能; 而其他基因具有组织器官或细胞类型特异性表达的特性[ 1]。在拟南芥中, 至少含有5个质体型的ACP, ACP1在叶、根、种子中表达, 但在种子中的表达最强; ACP2、 ACP3为组成型表达; ACP4主要在叶中表达; ACP5推测为种子特异性表达, 但至今尚未被鉴定[ 2]。其他植物如菠菜、大豆、油菜及萼距花中也观察到多个异构体参与质体内脂肪酸合成[ 3, 4, 5, 6, 7]。尽管ACP在脂肪酸生物合成中的作用已较为明确, 但尚不清楚植物体中为何需要多种异构体, 不同异构体在功能上有哪些分工, 又是如何协同作用的。
启动子是基因的一个重要组成部分, 控制基因表达(转录)的起始时间、空间和表达的程度。对其表达模式的分析可以从一个侧面了解基因可能发挥的功能。Baerson和Lamppa[ 1]分析了拟南芥 ACP A1 ( AtACP2)基因的编码区上游914 bp (包括74 bp 5′ UTR区)调控区驱动的 GUS基因表达情况, 检测发现转基因植株GUS活性为种子 > 根 > 幼叶 > 成熟叶; 且基因表达具一定的组织和细胞特异性, 如幼苗或成熟植株茎和根的顶端分生组织中表达较强; 开花期胚珠、柱头表皮、花柱的引导组织和维管束中均有表达; 不同发育期小孢子囊的绒毡层中GUS表达量较高[ 1]。进一步分析发现, 转录起始位点上游-235 ~ -55区对基因在种子和根中的表达具有较大影响, 这一区段缺失使根中表达降低7倍, 同时这一区段也是花托、柱头、花粉绒毡层表达所必需的[ 8]。拟南芥不同ACP异构体基因 AtACP3 ( Acl1.3)与 AtACP2 ( Acl1.2)启动子分析发现, 这2个基因靠近转录起始位点上游180 bp区段同源性较高, 而更上游的序列差异明显。它们在不同发育时期各组织中的表达模式既有共同之处又有明显差异[ 9]。
花生中目前已克隆了 AhACP1、 AhACP4和 AhACP53个质体型ACP基因, RT-PCR分析表明 AhACP1优先在种子中表达, 其他组织中表达量较低; AhACP4和 AhACP5为组成型表达, 在种子中表达量略高于其他组织[ 10]。但尚未见对这些基因调控区研究的报道。本研究克隆了这3个基因的5′侧翼调控区序列, 用生物信息学的方法分析了调控区可能存在的调控元件, 并与拟南芥同源基因的启动子序列比较, 旨在为进一步分析启动子功能提供依据。
1.1.1 植物材料 花生( Arachis hypogaea L .)品种鲁花14 (LH14)由本实验室提供。以当年收获的花生种子进行室内培苗, 12 d后, 取幼叶, 经液氮冷冻后储存于-80℃冰箱以备提取DNA。大田种植LH14, 果针入土后10 d开始取样, 每10 d取一次直至种子成熟。不同发育时期种子经液氮冷冻后, 储存于-80℃冰箱以备提取RNA。
1.1.2 菌株及质粒 大肠杆菌( Escherichia coil) DH5α由本实验室提供。pEASY-T3克隆载体为北京全式金生物技术有限公司产品。
1.1.3 试剂 植物DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒为北京天根生化科技有限公司产品; DNase I、各种限制性内切酶由大连TaKaRa生物技术公司生产; BD GenomeWalker Universal Kit、BD Advabpage 2 PCR Kit和GeneRacer Kit分别为Clontech公司和Invitrogen公司产品; PCR扩增引物由上海生工生物工程技术服务有限公司合成; DNA序列测定由本单位测序中心完成。
用植物DNA提取试剂盒提供的方法提取花生幼叶的DNA, 溶解于适量TE (pH 8.0)缓冲液中。经分光光度计定量和酶切、凝胶电泳检测, 分别取2.5 μg DNA经 Dra I、 EcoR V、 Pvu II、 Stu I内切酶酶切、苯酚抽提纯化后, 溶解于20 μL TE (pH 7.5)缓冲液中。分别取4 μL酶切完全的DNA, 按照BD GenomeWalker Universal Kit的要求连接上Adaptor (5'-GTAATACGACTCACTATAGGGCACGCGTGGTCGACGGCCCGGGCTGGT-3'), 构建4个花生基因组DNA文库(LD、LE、LP、LS)。根据已获得的花生 ACPs基因的基因组序列, 分别设计3个基因的6个3°端特异性引物, 即ACP1GSP1-2: 5'-GCTTAACC AGCTCAACATGACAACACT-3', ACP1GSP2-1: 5'-G ATTGAGATGGAGGTAGCTGTAAAGGA-3'; ACP4G SP1-1: 5'-CACAGAGACTGCCCCAAATCTTGAACT -3', ACP4GSP2-1: 5'-TAAACAAGATGTATGTAGAA CCTGGAG-3'; ACP5GSP1-1: 5'-AGAAAACGGCAG CGAAATCAGTAACAG-3', ACP5GSP2-2: 5'-GAGAT GGAGTTTCCGGTAAGTGCATTT-3' (每个基因的2个特异引物为巢式PCR引物)。分别以4个基因组文库为模板, AP1 (5'端接头引物: 5'-GTAATACGA CTCACTATAGGGC-3')和GSP1为引物进行第1轮扩增, 扩增体系为25 μL, 模板量为1 μL, 扩增条件为94℃ 25 s, 72℃ 3 min, 7个循环; 94℃ 25 s, 65~67℃ 3 min, 32个循环; 最后67℃继续延伸7 min。第2轮巢式PCR模板为第1轮PCR适当稀释的产物1 μL, 引物为AP2 (5'端巢式接头引物: 5'-ACTATAGG GCACGCGTGGT-3')和GSP2, 扩增体系和扩增条件基本与第1轮PCR相同。1%琼脂糖电泳检测PCR结果。
挖取并回收第2轮PCR特异性扩增产物, 克隆到pEASY-T3载体中, 白色重组克隆经 EcoR I酶切检测, 将片段大小符合要求的克隆用ABI3730测序仪进行双向测序。
用本实验室改进的CTAB法提取不同发育时期种子的总RNA[ 11], 经琼脂糖电泳检测RNA质量和分光光度计定量后, 等量混合储存于-80℃冰箱备用。为防止RNA酶污染, 研钵、研锤、药匙均以180℃烘烤6 h, 所用塑料制品用0.1%的DEPC水浸泡, 于室温下过夜后, 高温灭菌处理。
用Invitrogen公司GeneRacer Kit提供的方法和试剂, 取5 μg混合好的LH14种子总RNA, 按照说明书要求用碱性磷酸酶(CIP)将截断的mRNA或其他非mRNA5°端去磷酸化, 然后将抽提纯化并沉淀的全长mRNA脱去帽子结构, 并连接上RNA接头(GeneRacer RNA Oligo: 5'-CGACUGGAGCACGAG GACACUGACAUGGACUGAAGGAGUAGAAA-3'); 以此RNA为模板, 用试剂盒提供的随机引物和SurperScript III RT酶反转录合成cDNA; 最终将合成的cDNA连接至载体pCR4-TOPO中, 获得LH14不同发育时期种子全长cDNA文库。根据已获得的花生 ACPs基因的cDNA序列, 分别设计3个基因的3'端特异性引物, 引物序列为ACP1TSS GSP1-1: 5'-GAGGGCTTGGCGAGAGAGATGATT-3', ACP1TSS GSP2-1同ACP1GSP2-1; ACP4TSS GSP1-1: 5'-GA GACTGCCCCAAATCTTGAACTAGC-3', ACP4TSS GSP2-1: 5'-CTGGAGGGTAGTCTTGCTACACAA-3'; ACP5TSSGSP1-1: 5'-TTGATTCAGCTGAGAGAGG AGAGG-3', ACP5TSSGSP2-1同ACP5GSP2-2。以构建的cDNA文库为模板, 分别以各基因的GSP1引物与GeneRacer 5' Primer (5'-CGACTGGAGCACGAG GACACTGA-3')进行第1轮PCR扩增, PCR体系参照BD Advabpage 2 PCR Kit要求, 扩增条件为94℃ 预变性2 min; 94℃ 30 s, 72℃ 30 s, 5个循环; 94℃ 30 s, 70℃ 30 s, 5个循环; 94℃ 30 s, 60~65℃ 30 s, 72℃ 30 s, 20~25个循环; 最后72℃继续延伸7 min。第1轮PCR产物经电泳检测后, 用适量缓冲液稀释, 用于第2轮巢式PCR。取1 μL第1轮PCR产物, 以各基因GSP2引物和GeneRacer 5' Nested Primer (5'-GGACACTGACATGGACTGAAGGAGTA-3')进行第2轮PCR, 扩增条件为94℃预变性2 min; 94℃ 30 s, 65℃ 30 s, 68℃ 30 s, 20~25个循环; 68℃继续延伸7 min。以1.5%琼脂糖电泳检测PCR结果。
挖取并回收第2轮PCR特异性扩增产物, 克隆到pEASY-T3载体中, 白色重组克隆经 EcoR I酶切检测, 将片段大小符合要求的克隆用ABI3730测序仪进行双向测序。
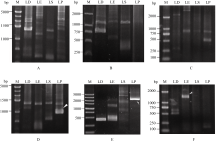
利用构建的4个花生基因组文库LD、LE、LP和LS, 以 ACPs基因特异引物为起点经2轮PCR, 分别获得特异性较好的扩增条带(图1)。回收特异性好、片段较长的PCR产物, 连接到T载体pEASY-T3中, 经测序证明获得的序列为 AhACP1、 AhACP4和 AhACP5基因5°上游序列, 其长度分别为535、1400和1180 bp。
由于花生这3个质体型 ACP基因都克隆自花生未成熟种子cDNA文库, 因此, 利用GeneRacer Kit重新构建的花生未成熟种子全长cDNA文库进行5°RACE, 分别克隆获得3个基因的特异性扩增片段(图2), 经测序证明获得的序列为 AhACP1、 AhACP4和 AhACP5基因5°上游非编码区(5°UTR)序列, 去除5°引物序列长度从GSP2引物到可能的转录起始位点的长度分别为103、170和116 bp, 转录起始位点分别位于这3个基因起始密码ATG上游-71、-92和-71 bp处。
应用PLACE软件对 AhACP1、 AhACP4和 AhACP5基因5′上游调控区进行了分析。以往的研究发现, AhACP1优先在种子中表达, 其他组织中表达量较低; AhACP4和 AhACP5为组成型表达, 在种子中表达量略高于其他组织[ 10]。也就是说, 这3个基因在根、茎、叶、花和不同发育时期种子中的基本
 | 图2 5° RACE确定3个花生 ACP基因转录起始位点Fig. 2 Localization of transcription start sites of three peanut ACP genes by 5′ RACE |
表达模式类似, 但它们的启动子序列差异显著。 AhACP1和 AhACP4分别在转录起始位点上游-28 bp和-24 bp处存在可能的TATA框TATATAAA、TTTTA, 而 AhACP5基因可能的TATA框(TTATTT)位于-145 nt处。3个启动子序列中包含大量共有调控序列, 如涉及光调控应答GATA BOX、GT1 CONSENSUS、IBOX CORE, 涉及干旱应答CBF HV、MYC CONSENSUS, 大多数储藏蛋白基因包含的E BOX, 花粉特异性激活的调控元件POLLEN1 LELAT52, 转录的抑制子WRKY71OS、W BOX NTERF3等21种调控元件, 这些调控元件大多以多拷贝存在, 并
且散布在整个启动子中。3个启动子也各自包含一些特异调控元件, 这些元件多以单拷贝或低拷贝形式分布于远离核心启动子区(表1), 如 AhACP4启动子包含激素应答元件ABRE AT CONSENSUS、S BOX (脱落酸ABA应答), 光调控元件LRE, 刺激素响应元件ELRE CORE, 以及特有的WUS和XYLAT元件; AhACP5启动子包含涉及调控胚胎晚期发育ABA诱导表达的DRE2 CORE元件、涉及正调控细胞周期 G1至S转换的元件E2FB、以及根原基中激活表达必需的TELO BOX元件和去除主茎上调表达的大量基因中包含的UP1元件; AhACP1因为克隆获得的启动子序列较短, 仅预测到5个特有调控元件(表1)。尽管 AhACP4和 AhACP5的表达模式更加接近, 但两者启动子共有的调控序列也很有限, 主要包括种子中赤霉素应答所需的CARE元件、蔗糖和激素应答元件TATCCA、激素调控元件REALPHA、蔗糖抑制调控元件SRE涉及氧化磷酸化的SITEII元件。
查询拟南芥已知的5个质体型ACPs的氨基酸序列, 并分析它们与3个花生质体型ACPs的亲缘关系, 结果表明, 拟南芥 AtACP4与其他4个拟南芥 ACPs基因在早期进化过程中就产生分歧, 致使该基因与其他基因的同源性较低; 而它与花生 AhACP4同源性较高, 它们在进化中可能为直系同源关系。花生3个ACPs异构体中, AhACP1与AhACP5亲缘关系较近, 它们序列相似性可达75%, 而它们与AhACP4的序列一致性均为55% (AhACP1 E值为2E-44, AhACP5 E值为1E-42)。拟南芥AtACP2和AtACP3同源性较高, 序列相似性为94%; 它们与AtACP1和AtACP5处于不同的进化分支(图3)。这与Li等[ 10]对不同物种ACP同源异构体进化树分析的结果基本一致。
根据已知的拟南芥 AtACP1 (At3g05020.1)、 AtACP2 (At1g54580)、 AtACP4(At4g25050.1)和 AtACP5(At5g27200)的基因组序列在NCBI网站查询起始密码子ATG 5′上游的序列, 获得上述4个基因的5′侧翼序列大小分别为1249、1225、1173和1000 bp。
应用PLACE软件对拟南芥这4个基因5′上游调控区分析发现, 这4个启动子序列中包含大量共有调控序列, 其中16种调控序列(表2)也是花生3个启动子序列中共有的, 并且这些调控元件大多散布于启动子区; 另预测到10余种在4个拟南芥 ACP基因启动子中都存在但仅在部分花生 ACP基因启动子中存在的调控序列, 如G-box的耦合元件CGACG, 种子发育相关基因AGL15的结合位点CARGCW8GAT, 根结感染细胞中激活表达的启动子含有的Organ-Specific Elements (OSE)的一个保守基序OSE1 ROOT NODULE, 涉及早期干旱应答ABRE- like序列ABREL, 硫应答元件核心区SURE CORE, 根毛特异性调控的顺式元件RHERP等, 这些调控序列的拷贝数明显少于拟南芥和花生 ACP启动子共有调控序列的拷贝数, 有些甚至为单拷贝。拟南芥这4个 ACP启动子序列也包含各自特有的调控序列, AtACP1启动子包含种子或胚乳特异性表达的元件PROXB、GCN4 motif和LEAFY, 涉及旺盛分裂的细胞或组织转录激活的调控元件TE2F2等; AtACP2启动子包含涉及激素调节的MYB转录因子结合位点CCA1、胚特异性表达调控的DNA结合基序、果实中特异表达所需的增强子元件和参与光信号调节的SORLIP5元件; AtACP4启动子含有光信号调控相关的RBCS CONSENSUS、SORLIP4和SORLREP3, 涉及开花时间调控的CARGAT CONSENSUS元件等; AtACP5启动子包含调控基因在萌发种子的子叶中高水平表达的TGACGT motif、涉及JA诱导基因表达调控T/G BOX、蔗糖应答元件SURE1和种子中具负调控作用的S1F元件等(表1)。这些基因特异性调控元件基本也是以单拷贝或低拷贝形式存在。
植物基因的表达受多个层次的调节, 根据机体生长、发育、繁殖及适应环境的需要, 有选择地按一定程序适度表达。许多高等植物在长期进化过程中通过多倍体化、基因复制等保障生存, 因此, 一些维持植物生长、发育基本生物学过程的关键基因也往往以多拷贝形式存在, 不同拷贝间或功能发生分歧、或在不同的时间空间发挥作用。
ACP是植物脂肪酸合成途径的重要辅因子, 参与脂肪酸从头合成的整个过程。同时, 它也参与硬脂酰基-ACP去饱和反应和质体类酰基转移反应。许多植物中存在多个ACP异构体, 推测可能与ACP的组织甚至器官特异性或发育阶段特异性活性有关。棉花一个纤维特异性的 ACP, 它参与了纤维伸长过程中膜脂的生物合成[ 14]。拟南芥 ACP A1基因表达的细胞或发育阶段特异性特征表明, 在植物发育的某个阶段 ACP A1基因需要保持较高的表达量以满足所需脂肪酸合成, 如花粉粒的绒毡层需合成脂丰富的“pollenkit”和“tryphines (含油层)”包裹在成熟花粉粒的外层[ 1]。而在有些组织中多种 ACP同时表达, 不同ACP异构体可能具有不同的组织和发育表达模式, 通过这种表达模式调控植物体内维持基本膜脂生物合成和作为三酰基甘油贮藏脂肪酸生物合成之
| 表1 花生和拟南芥不同 ACP基因启动子各自特有的调控元件 Table 1 Specific cis-elements in the promoter regions of different ACP genes from peanut and Arabidopsis |
| 表2 AhACPs和 AtACPs启动子区共有调控元件 Table 2 Common cis-elements in the promoters of AhACPsand AtACPs |
间的平衡[ 2]。拟南芥中 AtACP2和 AtACP3编码的蛋白仅有1个氨基酸的差异, 并且均为组成型表达, 但它们呈现不同的组织和发育表达模式。营养组织中 AtACP2主要在茎尖、根尖和次生分生组织中表达, AtACP3则在叶片(包括叶柄)和根(包括根毛)表达量都较高; 开花期 AtACP2仅在柱头的乳头状突起和成熟花粉表达, AtACP3则在整个花器官均有较强表达; 在种子发育过程中 AtACP2在幼嫩种子中表达量最高, 而 AtACP3从发育中期表达开始增加, 成熟种子中表达量最高[ 9]。它们表达模式的差异主要是由距离转录起始位点-180 bp上游具有较大差异区域中一些调控元件决定的。RT-PCR分析表明,花生 AhACP4和 AhACP5在根、茎、叶、花和种子中的表达模式非常接近, 但它们调控区序列存在很大差异。 AhACP4启动子区包含根或芽顶端分生组织表达调控元件WUS (TTAATGG)[ 15]; 而 AhACP5启动子区则含有侧芽萌动和伸展所需的多个关键调控元件E2FB (GCGGCAAA)、TELO BOX (AAACCCTAA)和UP1 (GGCCCAWWW)[ 16], 因此, 推测它们在不同组织或发育阶段的表达模式可能存在差异。
亲缘关系分析表明, 花生 AhACP4与拟南芥 AtACP4可能是进化中的直系同源基因, 它们的启动子区含有一些共同的调控元件, 如蔗糖和激素应答的元件SRE(TTATCC)、TATCCA和光调控元件IBOX (GATAAG)等。但不同物种间直系同源的基因在进化过程中也往往产生功能上的变化。 AhACP4与 AtACP4在进化过程中, 它们的表达模式发生了分歧。 AtACP4主要在叶中表达[ 17], 其启动子中含有大量特有的光信号响应和光应答调控元件; 而 AhACP4为组成型表达, 种子中表达量最高[ 10], 它的启动子区域也包含了一些特有的元件如WUS元件、刺激素应答元件ELRE CORE、磷酸盐饥饿应答元件PIBS、参与次生木质部发育调控的顺式元件XYLAT等。
本研究分析的3个花生质体型 ACP基因均克隆自发育中的花生种子cDNA[ 10, 18], 它们的启动子序列中都含有一些调控它们在种子或胚乳中特异表达的元件, 如DOF CORE (AAAG)、E BOX (CANNTG)、MYB CORE (CNGTTR)等。已有大量研究证明, E BOX在许多参与脂肪酸合成的基因如 AhFAD2(花生Δ12Fatty Acid Desaturase)[ 19]、 CsACP1 (萼苣花)和 Cs4PAD (Δ4 palmitoyl-ACP desaturase)[ 20]以及三酰甘油在种子中积累的基因如 AtDGAT (acyl-CoA- diacylglycerol Acyltransferase; At2g19450)、 AtPDGAT (phosphatidyl choline: diacylglycerol acyltransferase; At3g44830)、(At4g26740, At5g55240)的启动子区都存在[ 21, 22], 它是基因在种子中表达所必需的顺式元件[ 20, 23]。花生为异源四倍体(AABB, 2 n=4 x=40), 其基因组中含有多少拷贝的质体型 ACP基因目前尚未揭示, 推测应该还存在其他组织或发育阶段表达特异性的异构体参与植物体内不同组织或器官基本膜脂生物合成或贮藏脂的生物合成。随着花生基因组学和分子生物学研究的深入, 这一答案很快将被揭晓。
克隆 AhACP1、 AhACP4和 AhACP53个花生质体型 ACP基因的5°侧翼调控区序列, 并确定了其转录起始位点。不同物种、不同拷贝的 ACP基因启动子既包含大量相同的调控序列也含有一些基因表达特异的调控元件。即使是表达模式基本相似的基因, 它们的启动子区也各自包含了一些特异的调控元件, 推测它们精细地调控基因以组织或发育阶段特异性模式表达。花生 AhACP4与拟南芥 AtACP4可能为直系同源基因, 进化过程中它们启动子主要调控元件产生较大差异, 它们的表达模式也随之产生了分歧。这些关键调控元件的具体功能还有待进一步的实验验证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|