棉纤维正常发育需要大量的蔗糖供应。转化酶是生物体内蔗糖代谢途径中的关键酶之一, 对转化酶基因的结构和功能研究将有助于揭示复杂的棉纤维发育分子机制, 并为纤维品质改良提供优良的基因资源。本研究以棉纤维突变体
Cotton fiber development depends on a large supply of sugar. Invertase plays a central role in sucrose metabolism. Structural and functional analysis of gene encoding invertase will conductively reveal the complex molecular mechanism of fiber development, and also provide elite gene resources for improvement of cotton fiber quality. In the study, a novel gene encoding vacuolar invertase was obtained by sillico cloning, based on a differentially expressed EST (GenBank accession number EY196825) between
在大多数植物中, 光合作用固定的碳源常以蔗糖形式转运, 利用蔗糖从源叶中输送能量和碳到植物发育的各个组织中。转化酶在植物碳源利用上起着关键调节作用, 它将蔗糖分解为葡萄糖和果糖, 随后这2种己糖参与多个生物代谢途径[ 1]。根据最适pH值, 转化酶可被分为3种类型。中性和碱性转化酶的最适pH为7.0~7.8, 在多种组织中表达。酸性转化酶的最适pH值在4.5~5.0之间, 可进一步细分为细胞壁型(CIN)和液泡型(VIN)[ 1, 2]。葡萄[ 3]、马铃薯[ 4]、番茄[ 5]等物种中研究显示, 液泡转化酶(VIN)在决定细胞碳源分配中起着重要的调节作用。目前普遍认为转化酶通过调节细胞内的渗透势来参与细胞发育。因为VIN水解1分子蔗糖变成2分子的己糖, 增加了渗透势调节物质, 胞内膨压加大, 有利于驱动细胞扩张[ 6]。但也有报道认为, 在糖类物质并非是主要渗透调节物的组织细胞中, VIN可能是通过作用于细胞壁的延伸来促进细胞扩张[ 7]。其他研究也表明VIN还参与诸如植物生长素、逆境刺激等一系列应答反应[ 6, 8, 9]。
棉纤维是从胚珠外表皮发育而来的单细胞无分支结构。纤维的发育可分为起始、伸长、次生壁加厚及脱水成熟4个相互重叠的阶段[ 10]。因在发育过程中表现出的优良特性, 棉纤维被视为研究细胞发育的理想模式系统[ 11]。目前, 棉花上一共报道了 GhVIN1[ 12]、 GhVacInv1和 GhVacInv2[ 13] 3个VIN基因。其中, GhVIN1是与棉纤维伸长相关的VIN基因, 它的表达水平与纤维伸长速率相吻合。抑制和过表达 GhVIN1分别会减缓和促进纤维伸长。将 GhVIN1转入拟南芥中, 该基因能补偿拟南芥 VIN插入突变体的表型, 并能促进野生型拟南芥根伸长。而 GhVacInv1和 GhVacInv2的不同组织器官表达特征表明, 这2个基因均在纤维伸长的细胞中优势表达, 可能参与纤维细胞的扩展、伸长。
本研究基于一个在棉纤维突变体 im和遗传标准系TM-1纤维发育中显著差异表达的EST序列(GenBank登录号为EY196825)为探针, 利用电子克隆, 结合cDNA及基因组全长基因PCR扩增、测序验证, 获得一个与棉花纤维发育相关的液泡转化酶基因 GhVacInv2a。进一步对其结构、功能及分子进化特征系统研究, 以期为深入阐明棉纤维发育的分子机制, 并用于纤维品质改良提供基因资源。
2010—2012年于南京农业大学江浦试验站种植陆地棉遗传标准系TM-1 ( G. hirsutum acc. TM-1)和 im纤维不成熟突变体 ( G. hirsutum acc. im, 次生壁发育缺陷的纤维突变体) 材料。在植株生长盛花期, 分别采集2个材料开花后10、13、16、19、22、25 DPA (days post anthesis)的纤维, 于液氮中速冻, -70℃冰箱保存。根、茎和叶样品取自有五、六片真叶的棉花幼苗。其他二倍体A染色体组的阿非利加棉 ( G. herbaceumvar. africanum)、D染色体组的雷蒙德氏棉( G. raimondii)和异源四倍体栽培棉种海岛棉海7124 ( G. barbadense cv. Hai7124)均种植于南京农业大学牌楼实验基地。
基于遗传标准系TM-1和棉纤维突变体 im竞争杂交芯片结果, 获得一个在TM-1中优势表达的EST序列(GenBank登录号为EY196825)。以该EST序列为探针, 通过BlastN比对程序, 搜索陆地棉EST数据库(http://www.ncbi.nlm.nih.gov/)。将获得的EST序列用CAP3程序(http://pbil.univ-lyon1.fr/ cap3.php)拼接后形成Contig, 然后以Contig为探针, 再次使用BlastN比对程序检索陆地棉EST数据库, 直至检出的Contig不能再延伸。对电子拼接获得的序列进行ORF预测, 参考BlastX结果完成其命名。利用电子拼接的序列信息设计引物, 通过RT-PCR和PCR方法分别扩增转录组cDNA和基因组DNA, 进行目标基因序列验证及不同棉种同源基因克隆分析。表1为本研究中涉及的所有引物信息。由南京金斯瑞生物科技有限公司完成所有引物合成和DNA序列测定。
将获得的cDNA全长序列运用NCBI的CD搜索工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi)进行编码产物保守结构域分析。利用ExPASy的Compute p I/Mw tool (http://us.expasy.org/ tools/pi_tool.html)预测编码氨基酸的等电点和分子量大小, 运用SignalP程序对由 GhVacInv2a基因编码的氨基酸序列进行N端信号肽结构的预测。
使用HMMER3.0程序[ 14]根据 GhVIN2基因的保守结构域搜索DOE Joint Genome Institute释放的棉花雷蒙德氏棉( Gossypium raimondii)蛋白数据库(http://www.phytozome.net/cotton.php), 获得雷蒙德氏棉D基因组中与 GhVacInv2a基因功能类似的家族
| 表1 本研究所用引物 Table 1 Primer pairs used in this study |
基因。用ClustalX 1.8软件对本研究克隆的 GhVacInv2a基因与棉花、拟南芥、杨树、葡萄等物种的转化酶基因编码产物进行多重序列比对, 用MEGA5 (http://www.megasoftware.net/)绘制序列的进化树。
利用改进的热硼酸法提取13、16、19、22和25 DPA的纤维组织RNA[ 15], 采用CTAB酸酚法[ 16]提取5~6片真叶棉花的根、茎和叶总RNA; 采用CTAB法[ 17]从新鲜幼嫩的叶片提取DNA。
利用实时荧光定量PCR分析 GhVacInv2a同源基因在TM-1和 im突变体不同组织器官及13~25 DPA纤维中的基因表达水平。共设3次生物学重复。以棉花 histon 3基因(GenBank登录号为AF024716)为内参照对表达数据进行标准化。使用罗氏公司Light Cycler Fast Start DNA Master SYBR Green I Kit (Roche), 应用生物公司AB7500 Real-time PCR检测系统(Applied Biosystems)进行PCR扩增并记录荧光信号值。定量PCR程序为95℃ 10 min; 95℃ 15 s, 60℃ 1 min, 40个循环; 以0.2℃ s-1的速度从65℃逐渐升至95℃来制作溶解曲线。为了确保定量PCR结果的可信度, 对 GhVacInv2a基因与内参照 histon 3基因均制作标准曲线来确定基因的扩增效率, 确保标准曲线 R2>0.98, 扩增效率在90%~105%之间。使用Pfaffl方法分析基因在不同材料和发育时期的相对表达水平[ 18]。
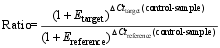
其中, E: 扩增效率; target: 目标基因; reference: 内参基因; control: 对照; sample: 分析样品。
在陆地棉遗传标准系TM-1 ( G. hirsutum acc. TM-1)和不成熟纤维突变体( im)纤维发育竞争杂交芯片上, 选取一个TM-1材料优势表达的EST序列(GenBank登录号为EY196825), 以该EST序列为种子序列在NCBI棉花数据库中进行比对。通过电子克隆方法拼接获得一个最长为2113 bp的序列。根据电子延伸的序列设计PCR引物(表1), 以TM-1开花后10 d的纤维组织cDNA为模板, 扩增出长为2003 bp的cDNA序列, 测序验证和原电子拼接序列一致。生物信息学分析显示, 该序列与已报道的陆地棉液泡转化酶 GhVacInv2基因(GenBank登录号为FJ864677)在核苷酸和蛋白水平上均有99%的一致性。进一步序列比对发现该基因与蓖麻( Ricinus communis)的转化酶(β-果糖呋喃苷酶)、木薯( Manihot esculenta)的液泡转化酶分别具有74%和73%的较高同源性。因此, 参照其在棉花中同源基因的命名将该基因命名为 GhVacInv2a( Gossypium hirsutum VacInv2a; GenBank登录号为KF305322)。 GhVacInv2a基因ORF长为1857 bp, 编码618个氨基酸。用Expasy p I/Mw程序对该基因编码氨基酸一级结构分析发现, 该基因等电点为5.25, 分子量为69.2 kD。根据NCBI CDS (http://www.ncbi.nlm.nih.gov/Structure/cdd/)分析, 其编码的氨基酸残基含有GH32_B_ Fructosidase-motif, 在100~420氨基酸之间有属于GH43_ 62_32_68superfamily保守域。运用SignalP程序对该基因的氨基酸序列分析, 发现N端有信号肽序列, 预测在49~50位氨基酸之间裂解。推测该基因是一个蛋白前体, 它在被合成之后将运输到液泡中。
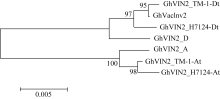
利用表1中设计2套巢式PCR引物, 分别扩增TM-1、海7124以及与其祖先种亲缘关系最近的二倍体棉种阿非利加棉和雷蒙德氏棉基因组DNA, 将获得的PCR产物回收、连接、转化, 随机挑选多个阳性克隆测序并序列比对分析, 获得该基因在二倍体和四倍体棉种中的基因序列。运用在线软件 GSDS (Gene Structure Display Server, http://gsds.cbi. pku.edu.cn/chinese.php)对基因结构进行分析, 该基因包含7个外显子, 6个内含子。系统进化分析表明(图1), 该基因在四倍体棉种中形成A亚组和D亚组两大分支, 可明确追溯到其祖先来源, 说明在四倍体棉种中来源于A亚组与D亚组重复基因是独立进化的。序列比对发现, 本文克隆的 GhVacInv2a基因属于A亚组, 前人报道的陆地棉转化酶的 GhVacInv2属于D亚组。
为进一步明确 GhVacInv2a与已报道的棉花和其他植物中亲缘关系相近的基因间进化关系, 使用HMMER3.0软件在雷蒙德氏棉( Gossypium raimondii) 基因组(http://www.phytozome.net/cotton.php)中发现
14个与 GhVacInv2a功能类似的转化酶基因。同时从NCBI网站中搜索了陆地棉( Gossypium hirsutum)、葡萄( Vitis vinifera)、蓖麻( Ricinus communis)、杨树( Populus trichocarpa)等植物中与 GhVacInv2a相似性较高的基因, 与本研究克隆的 GhVacInv2a进行氨基酸的多重序列比较和进化树分析。结果表明该进化树可分为两大类, 第1类为细胞壁转化酶和水解酶家族基因; 第2类为液泡转化酶; 本实验克隆的 GhVacInv2a属于第2类, 与已报道的陆地棉液泡转化酶2 ( GhVacInv2)同源性最高, 其次与蓖麻的转化酶(β-果糖呋喃苷酶)、葡萄液泡转化酶1也有较高同源性。
分别提取TM-1中根、茎、叶、花瓣、花药、不同发育时期纤维样品的RNA, 将其反转为cDNA, 利用实时荧光PCR (Q-PCR)扩增, 完成该基因在不同组织器官的表达分析。结果表明, GhVacInv2a在花药中的表达量最高, 其次为花瓣, 在根和茎中表达水平非常低。在纤维快速伸长期10DPA优势表达, 在纤维伸长与次生壁加厚重叠期表达水平也较高, 到纤维发育19DPA后表达水平显著降低(图3)。说明该基因主要在纤维发育的伸长及次生壁加厚早期发挥作用。
进一步分析(图4)显示, GhVacInv2a在TM-1和 im突变体中的基因表达模式类似, 但表达丰度有显著差异。尤其在13、16、19 DPA, GhVacInv2a在TM-1中的表达水平分别比 im突变体中高出28.8、13.4和8.5倍。暗示在纤维发育过程中, GhVacInv2a在 im
 | 图3 GhVacInv2a基因在TM-1不同组织器官中表达水平R、S、L、P、A分别代表TM-1中根、茎、叶、花瓣、花药组织, 0代表0 DPA的胚珠, 10、13、16、19、22、25分别代表10、13、16、19、22、25 DPA的纤维组织。Fig. 3 Relative expression level of GhVacInv2a in different tissues and organs in TM-1R, S, L, P, A indicate root, stem, leaf, petal and anther tissues in TM-1, respectively. 0 indicates ovules at 0 DPA, and 10, 13, 16, 19, 22, 25 indicate fibers at 10, 13, 16, 19, 22, 25 DPA, respectively. |
 | 图4 GhVacInv2a在TM-1和 im不同纤维发育期的表达水平13、16、19、22、25分别代表13、16、19、22、25 DPA的 纤维组织。a和A分别表示0.05和0.01 显著水平上的差异。Fig. 4 Relative expression level of GhVacInv2a in different fiber developmental stages of TM-1 and im13, 16, 19, 22, 25 indicate fibers at 13, 16, 19, 22, 25 DPA, respectively. “a” and “A” indicate singnificant difference at 0.05 and 0.01 levels, respectively. |
突变体中的极显著低水平表达, 可能与 im突变体的次生壁发育缺陷密切相关。
根据 GhVacInv2a基因在TM-1和海7124棉种间的SNP位点差异, 开发SNP引物扩增作图群体[(TM-1×H7124)×TM-1]BC1, 根据群体多态性[ 19], 初步将 GhVacInv2a定位到棉花异源四倍体第3染色体上。进一步利用以TM-1为背景渐渗海岛棉海7124第3染色体片段的单片段置换系CSIL028与 im突变体构建的F2群体, 根据群体多态性精细定位, 将 GhVacInv2a定位于标记 GhPEL与NAU8256之间, 分别相距1.3 cM和0.3 cM。
为了进一步明确 GhVacInv2a对纤维品质性状的影响, 结合CSIL028 × imF2:3家系纤维长度(FL)、纤维强度(FS)、马克隆值(Mic)、伸长率(FE)、整齐度(FU)、短纤维指数(SFI)、成熟度(Mat)和衣分(LP) 7个纤维品质性状和1个产量性状进行标记与性状关联分析[ 20]。由于CSIL028 × im F2群体纤维品质性状和衣分表型显著受 im突变基因影响, 先将分离群体按纤维表型分为正常与突变两类, 然后再分别进行单标记关联分析。在群体表型为正常类型的243个单株中, 海岛棉纯合/杂合纤维强度基因型均值为32.54 cN tex-1, 而陆地棉纯合基因型均值为 31.30 cN tex-1, 该基因与纤维强度存在极显著相关( P=0.0087), 说明 GhVacInv2a在棉花纤维强度的形成中可能发挥重要功能。
液泡转化酶(VIN)将液泡中的蔗糖水解为葡萄糖和果糖来调节细胞内蔗糖的浓度。许多研究报道 VIN基因在快速扩张的组织细胞, 如马铃薯块茎[ 21]、胡萝卜根[ 22]及发育中的玉米籽粒[ 23]中有较高的表达丰度或酶活性。 VIN参与调控果实及贮藏器官细胞内糖组分比例[ 4, 24, 25, 26]。通过调节渗透势 VIN参与调控细胞伸长与组织扩增[ 12, 22, 27]。研究显示 VIN还响应逆境和激素信号[ 21, 28, 29, 30, 31, 32]。
本研究从棉纤维中克隆了一个编码液泡转化酶的cDNA全长基因 GhVacInv2a, 它与Taliercio等[ 13]报道的陆地棉液泡转化酶基因 GhVacInv2有很高的相似性。基因表达分析显示 GhVacInv2a除了在花药、花瓣中有很高的表达量外, 在快速伸长的纤维中具有较高的表达丰度, 在纤维伸长与次生壁加厚重叠期表达水平也较高, 而在起始和次生壁加厚期的纤维中则维持极低的表达水平。和对照TM-1相比, im突变体13~25 DPA的纤维中 GhVacInv2a始终维持一个低的表达水平。特别是在13~19 DPA的纤维中, im突变体中 GhVacInv2a的表达量比TM-1中的低8.5~28.8倍, 暗示2个材料在纤维伸长阶段可能存在不同的蔗糖利用水平。有研究报道 VIN也会受到胞内糖浓度的反馈调控[ 31, 33]。我们推测在 im突变体纤维中存在糖组分比例失衡, 细胞中没有多余的蔗糖可被转运至液泡中临时存储, 受液泡内糖浓度的反馈调控, im突变体纤维细胞中仅需维持一个低的VIN活性水平就可满足液泡中蔗糖代谢。
异源四倍体中 GhVacInv2a定位于第3染色体上, 与果胶裂解酶基因 GhPEL相距1.3 cM, 与 im基因相距约10 cM。利用基于群体的QTL分析, Wang等[ 20]在该区间内检测到几个纤维品质显著相关QTL。因此, GhVacInv2a, GhPEL与 im基因之间是否存在某种调控作用有必要进一步的研究。
GhVacInv2a与棉纤维强度存在极显著相关, 暗示 GhVacInv2a可能参与棉纤维强度的形成。纤维强度是棉花重要的纤维品质性状, 属于数量性状, 其形成机理较复杂。目前, 在棉花上尚未有鉴定分离控制纤维强度基因的报道。 GhVacInv2a可能参与纤维次生壁发育过程中的蔗糖转化, 与纤维强度及纤维品质密切相关。然而, GhVacInv2a在纤维发育中的确切作用, 特别是在次生壁发育缺陷的 im突变体中 GhVacInv2a在纤维发育过程中扮演的角色, 以及该基因与 im基因在纤维发育通路中的关系值得进一步深入研究。
从遗传标准系TM-1中克隆了一个编码液泡转化酶的 GhVacInv2a。该基因包含7个外显子和6个内含子, ORF全长1857 bp, 编码618个氨基酸。在二倍体棉种阿非利加棉和雷蒙德氏棉基因组中各含1个拷贝, 在四倍体陆地棉、海岛棉基因组中存在2个拷贝, 本文克隆的 GhVacInv2a和前人报道的 GhVacInv2分属于A、D亚组同源基因。利用SNP标记将 GhVacInv2a定位于第3染色体上。 GhVacInv2a在花药中表达量最高, 在快速伸长阶段的纤维细胞和纤维伸长与次生壁加厚重叠期优势表达。13~19 DPA的纤维中, GhVacInv2a在TM-1中表达水平极显著高于 im不成熟纤维突变体。 GhVacInv2a与纤维强度存在极显著相关。推测该基因功能与纤维次生壁发育过程中的蔗糖转化有关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|


 end of the acid soluble invertase isozyme II gene of rs/rs carrots. This insert was not totally spliced out during mRNA processing. While the wild-type acid-soluble invertase isozyme II transcript (ca. 2 kb) was detected in Rs/Rs roots and leaves, none was observed in rs/rs roots throughout development. RT-PCR of rs/rs leaves revealed two novel transcripts (2.7 kb and 3.2 kb). A comparison of enzyme activity between the near-isogenic Rs/Rs and rs/rs carrot lines revealed very low acid-soluble invertase activity in rs/rs roots whereas neutral invertase, sucrose synthase and sucrose phosphate synthase levels were comparable. Those results and linkage analysis indicate that Rs is a candidate locus for carrot vacuolar acid-soluble invertase isozyme II. Although the 2.5 kb insert does not occur in the Rs wild-type acid-soluble invertase isozyme II allele, it does occur elsewhere in the genome of Rs/Rs plants.
end of the acid soluble invertase isozyme II gene of rs/rs carrots. This insert was not totally spliced out during mRNA processing. While the wild-type acid-soluble invertase isozyme II transcript (ca. 2 kb) was detected in Rs/Rs roots and leaves, none was observed in rs/rs roots throughout development. RT-PCR of rs/rs leaves revealed two novel transcripts (2.7 kb and 3.2 kb). A comparison of enzyme activity between the near-isogenic Rs/Rs and rs/rs carrot lines revealed very low acid-soluble invertase activity in rs/rs roots whereas neutral invertase, sucrose synthase and sucrose phosphate synthase levels were comparable. Those results and linkage analysis indicate that Rs is a candidate locus for carrot vacuolar acid-soluble invertase isozyme II. Although the 2.5 kb insert does not occur in the Rs wild-type acid-soluble invertase isozyme II allele, it does occur elsewhere in the genome of Rs/Rs plants.