从野生大豆盐碱胁迫基因表达谱中筛选并克隆到
Drought and saline-alkaline stresses, significantly affect growth and productivity of plants. The reaction of plant to environmental stresses is controlled by numerous genes via transcriptional regulation and protein phosphorylation. A stress-responsive kinase gene,
紫花苜蓿( Medicago sativa)是一种优良的豆科牧草, 其营养价值相当于豆类作物, 在我国的种植面积约有133万公顷[ 1]。近年来, 随着我国畜牧业的发展, 对优质苜蓿的需求进一步加大。虽然苜蓿是中等耐盐作物, 但其耐力有限, 由于土壤严重盐碱化, 极大地制约了苜蓿产业的发展。因此亟需培育耐盐碱性强的苜蓿品种, 满足畜牧产业日益发展的需求。
转基因技术已在改善苜蓿品质, 提高抗病[ 2, 3, 4]、抗虫[ 5, 6, 7]、抗除草剂[ 8, 9, 10]及抗逆性[ 11, 12, 13, 14, 15]等方面应用。然而, 功能明确的、可用于苜蓿耐碱基因工程的基因资源还很有限。Yang等[ 16]首次从野生大豆中分离 GsCBRLK(钙/钙调素调控的受体类蛋白激酶, calcium-dependent calmodulin-binding receptor-like kinase)基因, 经验证, GsCBRLK基因的超量表达提高了拟南芥耐盐性, 降低了对ABA的敏感性。深入研究发现, GsCBRLK的N端CaM结合结构域(147~169位氨基酸)可与钙调素结合并且依赖Ca2+; Ca2+的存在可以强烈激活其自磷酸化活性, 同时钙调素与 GsCBRLK蛋白结合正调控蛋白自磷酸化和底物磷酸化[ 16]。由此可见, 该基因在高盐、ABA信号传导途径中, 通过钙离子和钙调素传递信号, 起着重要的调控作用。然而, 该基因在碱胁迫反应中是否有作用,能否提高植物耐碱性,目前尚不明确。
紫花苜蓿营养丰富, 干草约含16%蛋白质和8%矿物质, 以及丰富的胡萝卜素和多种维生素, 在畜牧业生产中占有重要的地位, 以“牧草之王”著称。在同等种植面积上, 紫花苜蓿提供的可消化总养料、可消化蛋白质和矿物质分别是禾本科牧草的2.0、2.5和6.0倍。但是, 豆科植物蛋白质缺乏含硫氨基酸[ 17], 而含硫氨基酸是反刍动物必需氨基酸。饲料中含硫氨基酸增加, 可使羊毛产量增加20%左右; 与其他氨基酸配合使用, 可使牛奶、牛肉产量显著提高, 其作用是其他氨基酸不可替代的[ 18]。因此, 提高饲料作物中含硫氨基酸的含量, 调节氨基酸的均衡, 成为饲料作物育种的关键问题之一。1991年, Schroeder等[ 19]首次将含硫氨基酸的鸡卵清蛋白基因转入苜蓿, 并在转基因植株中检测到鸡卵清蛋白显著增加。2000年, 吕德扬等[ 20]通过农杆菌介导法将高含硫氨基酸蛋白(HNP)基因转入苜蓿, 明显提高了转基因植株含硫氨基酸的含量。2005年, Avraham等[ 21]将拟南芥胱硫酸γ-合成酶(AtCGS)基因转入紫花苜蓿, 结果发现多种代谢相关氨基酸含量增加。
SCMRP是根据大豆密码子偏爱性, 利用生物信息学方法对来源于玉米的 MRZP基因修饰和改造, 获得的具有高表达活性、并能在植物中稳定表达的新基因[ 22, 23]。大豆遗传转化实验结果表明, 转 SCMRP大豆的甲硫氨酸含量明显提高[ 24]。
在已有研究基础上, 本研究利用经改造的 SCMRP基因和耐盐基因 GsCBRLK, 构建组成型双价基因植物表达载体, 将 GsCBRLK/SCMRP基因借助农杆菌介导法转化农菁1号苜蓿, 以期获得耐碱性及甲硫氨酸含量同时提高的转基因苜蓿新材料, 并为 GsCBRLK基因的耐碱功能验证和应用潜力探索提供参考依据。
大肠杆菌( Escherichia coli) DH5α、根癌农杆菌( Agrobacterium tumefaciens) EHA105、质粒pBEOM、pCGEM均由东北农业大学农业生物功能基因重点实验室保存。
利用 EcoR I单酶切载体pCGEM, 得到 SCMRP基因, 连接到含有 CBRLK基因的表达载体pBEOMCBRLK上。鉴定连接正反向, 构建双价基因( GsCBRLK-SCMRP)组成型植物表达载体pBEOCBRLK-SCMRP。采用冻融法将重组质粒导入农杆菌EHA105, 用于苜蓿的遗传转化。
以8日龄无菌苗的子叶节为外植体, 在盛慧等[ 25]苜蓿转化方法的基础上略改进, 用0.5 mg L-1草铵膦(glufosinate-ammonium, 购自Sigma公司)为筛选剂。将再生植株移栽到草炭土∶沙土=2∶1的花盆中, 于温室培养(24℃, 600 μmol s-1m-2, 16 h d-1光照, 80%相对湿度)。
以转基因苜蓿叶片DNA为模板, 根据 SCMRP基因的全长序列设计特异引物MVP-S和MVP-AS (5°-CAGCAGGGTCTCGCTTCACT-3°和5°-GCAGAT TCCAATGCCACAAT-3°)进行PCR检测。PCR产物长度为358 bp。
选取PCR阳性的转基因株系, 进行 GsCBRLK- SCMRP双价基因转录水平分析。参照RNAprep Pure Plnat Kit (TIANGEN, 北京)提取苜蓿叶片总RNA。取2 μg总RNA, 应用SuperScript III Reverse Transcriptase (Invitrogen, USA)合成cDNA第一链。以 GsCBRLK-SCMRP基因的特异引物GsCBRLK-SQ-S, GsCBRLK-SQ-AS (5'-GCACCAGGGAGACAACCA CG-3'; 5'-CATATGTCTTATGCCTATTCTTCCTACC-3')和MVP-S, MVP-AS进行半定量RT-PCR。以苜蓿GPDH (glyceraldehyde-3-phosphate dehydrogenase, GenBank登录号为MTR_4g131180)为内参基因, 引物为S: 5'-GTGGTGCCAAGAAGGTTGTTAT-3'和AS: 5'-CTGGGAATGATGTTGAAGGAAG-3'。
取RT-PCR阳性植株进行Western blot检测。在蛋白的N-末端设计GsCBRLK编码蛋白特异性多肽(N-Term: KKTPAPSLHQSNQRQKNC), 委托哈尔滨赛拓生物公司合成及制备多克隆抗体。参见陈富成等[ 26]的方法, 提取植物叶片总蛋白, 并进行Western blot检测[ 27]。以野生大豆总蛋白为阳性对照, 非转基因苜蓿总蛋白为阴性对照。目标蛋白约为50 kD。
剪取带有2~3个节点的茎段扦插扩繁。待茎段生根后, 选取生长状态良好且一致的扩繁苗, 移栽到含有蛭石∶珍珠岩=1∶1的小钵中, 分别用含有100 mmol L-1和150 mmol L-1 NaHCO3的1/8 Hoagland营养液(pH值分别为8.0和8.5)处理, 每2 d更换一次营养液, 14 d后观察记录表型。
采用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量[ 28]。采用NBT比色法[ 29]检测SOD酶活性, 以抑制NBT氧化还原50%消耗的酶为1个活性单位。参照Gibon等[ 30]的方法, 用DDSJ-308A电导率仪(中国上海)检测相对质膜透性。
取苜蓿地上部分材料, 于烘箱105℃下杀青15 min, 80℃烘至恒重; 将烘干的样品粉碎过60~80
目筛, 称样100 mg; 加6 mol L-1HCl 6~8 mL, 充氮气, 封口; 110℃烘箱水解22 h; 冷却, 摇匀过滤, 以双蒸水定容至50 mL, 润洗3次以上; 取1 mL将其冻干并加0.02 mol L-1HCl溶液1 mL振荡摇匀; 以18 407× g离心15 min, 吸上清0.8 mL, 过0.45 μm滤膜后上机检测[ 31]。用全自动氨基酸分析仪(日本日立, 型号L-8800)测量氨基酸含量。
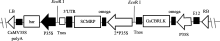
双价基因组成型植物表达载体pBEOCBRLK- SCMRP (图1)使用烟草花叶病毒CaMV35S启动子分别调控双价基因, 以 bar基因作为筛选标记基因。使用能增强翻译的omega调控元件及E12增强子[ 32], 有利于外源基因在受体植物中的高效表达。
采用农杆菌介导法转化苜蓿, 对草铵膦筛选得到的抗性植株进行PCR鉴定, 获得PCR阳性植株55株。阳性对照和转基因植株中均扩增出大小为358 bp的目的片段, 而阴性对照中无扩增带(图2)。
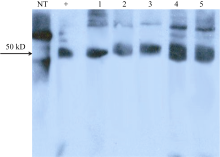
为了筛选 GsCBRLK基因超量表达的转基因苜蓿, 随机选取5个PCR阳性植株进行半定量RT-PCR检测(图3)。结果显示, GsCBRLK和 SCMRP2个基因在转基因苜蓿中均能超量表达, 而非转基因对照株系中未检测到阳性信号。
图4显示, 1~5号转基因株系均有50 kD大小的免疫印迹条带, 表明 GsCBRLK基因已经转入苜蓿中并能正常表达。
由于紫花苜蓿是典型异花授粉四倍体植物, 通过种子繁殖难以获得遗传稳定的纯合体, 本研究采用茎节扦插扩繁的方式, 获得大量可用于耐碱性分析的材料。从RT-PCR阳性株系中选取表达量较高的2个株系CS-16和CS-21进行表型分析。在未处
理条件下, 转 GsCBRLK基因苜蓿与非转基因苜蓿的生长状态并无明显差异(图5-A), 100 mmol L-1和150 mmol L-1NaHCO3处理14 d后, 转基因株系CS-16和CS-21的生长状态明显好于非转基因对照(图5-B, C)。经150 mmol L-1NaHCO3处理后, 差异更明显, 转基因株系CS-16和CS-21虽受轻度影响, 但均能保持良好的生长状态, 而非转基因对照株系则明显萎蔫、失绿甚至死亡(图5-C)。
胁迫处理前后植株的株高和生物量(图6)表明, 所有株系的株高随碱处理浓度的增大而逐渐下降, 但转基因株系CS-16和CS-21的下降幅度均小于非转基因株系, 而在150 mmol L-1NaHCO3处理条件下, 转基因株系CS-16和CS-21的株高分别是40.58 cm和40.81 cm, 较非转基因株系34.35 cm有显著差异( P<0.05)。同样, 各株系地上部分及根系的鲜重, 经过碱胁迫处理后均有所下降, 但2个转基因株系的生物量均显著地高于非转基因对照( P<0.05)。由此进一步说明转 GsCBRLK基因苜蓿具有较强的耐碱能力。
2.3.1 NaHCO3胁迫对苜蓿叶片细胞膜透性的影响
图7-A表明, 随着NaHCO3胁迫浓度的增加, 转基因和非转基因株系的MDA含量均随之增加, 在高pH值(pH 8.5)处理下, 2个转基因苜蓿株系的MDA含量增加幅度显著低于非转基因对照( P<0.05), 从而说明超量表达 GsCBRLK基因可降低NaHCO3胁迫对细胞膜造成的氧化损伤。
相对质膜透性是反映细胞膜伤害程度的另一重要指标。图7-B表明, 转基因和非转基因苜蓿相对质膜透性均随NaHCO3胁迫浓度的增加而升高, 但在150 mmol L-1NaHCO3处理下, 2个转基因株系相对质膜透性的增加幅度与未转基因对照差异显著( P<0.05)。结合MDA的结果, 说明NaHCO3胁迫会加速膜脂氧化, 并对细胞膜造成损害, 而 GsCBRLK基因的超量表达, 减弱细胞膜的损伤及膜脂氧化程度, 从而提高苜蓿的耐碱能力。
2.3.2 NaHCO3胁迫对苜蓿SOD活性的影响 图8表明, 正常条件下, 转基因和非转基因株系的SOD活性没有显著差异, 但在NaHCO3胁迫条件下, 转基因和对照株系的SOD活性均有提高, 当NaHCO3浓度达100 mmol L-1时差异极显著( P<0.01)。说明
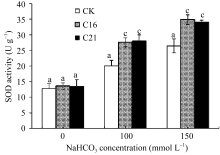 | 图8 碱胁迫下转基因苜蓿的SOD活性标以不同字母表示在 P<0.01水平上差异显著。Fig. 8 SOD activity in transgenic plant under NaHCO3 stressBars superscripted by different letters are significantly different at the 0.01 probability level. |
较低浓度NaHCO3胁迫即可调控SOD的活性以增强活性氧清除的能力, 而 GsCBRLK基因超量表达极大提高了转基因株系的SOD活性, 降低了碱胁迫对植株造成的氧化伤害。
分析了转基因及非转基因苜蓿叶片中16种氨基酸含量(表1)。2个转基因株系甲硫氨酸含量均比较未转基因对照高, 但天冬氨酸含量分别降低1.03%和1.02%, 说明转基因株系中 SCMRP基因的超量表达增加了苜蓿叶片中甲硫氨酸的含量。至于天冬氨酸含量下降的原因还有待进一步研究。
蛋白激酶是一类磷酸转移酶, 在信号传导中通过磷酸化调控底物蛋白的活性, 使信号逐渐放大, 从而引起细胞反应[ 33]。蛋白激酶的重要功能之一是参与环境胁迫信号的传递, 通过植物细胞的信号传导因子及调节机制使植物避免盐环境的迫害[ 34]。然而, 蛋白激酶在碱胁迫信号中的传导和调节机制的研究报道很少[ 35]。来源于野生大豆的 GsCBRLK基因可以提高拟南芥对盐胁迫的抗性[ 16], 但其是否能
| 表1 转基因苜蓿叶片氨基酸含量 Table 1 Content of amino acids in transgenic alfalfa (%) |
够提高苜蓿的耐碱性并未报道。本研究表明, GsCBRLK在碱胁迫反应中也起重要的正调控作用, 经过信号传导, 最终提高SOD酶的活性, 减弱了膜脂氧化的程度, 稳定了离子平衡, 降低了碱胁迫对植物细胞膜的伤害, 提高转基因植物的耐碱性。因此, 该基因可通过超量表达用于豆科植物耐碱基因工程。
细胞质膜是细胞与外界环境之间物质和能量交换的第一道屏障。所以, 当细胞受到环境胁迫时, 质膜必然首先接触到环境因子。逆境伤害时, 质膜的选择透性因而增大, 细胞内的电解质外渗, 导致离子交换系统混乱, 破坏了细胞内的离子平衡。相对电导率变化可反映出质膜的伤害程度和植物抗逆性的强弱。在胁迫下, 植物细胞会产生大量的活性氧, 在活性氧的作用下, 膜脂发生过氧化反应而产生丙二醛(MDA)[ 36], 其含量也可反映植物遭受逆境伤害的程度[ 37]。对应于细胞遭受活性氧的毒害, 植物体内形成了一系列的酶促和非酶促反应机制。超氧歧化酶(SOD)在植物抗氧化胁迫中具有清除氧自由基、维持活性氧代谢平衡的功能, 是防止膜脂过氧化, 保护膜系统的关键酶[ 38]。因而, 可以利用以上3个生理生化指标来衡量逆境胁迫条件下细胞膜的损伤、膜脂氧化的程度和活性氧清除能力, 评价植物的耐逆性[ 39]。本研究发现, 在碱胁迫反应中, 以上3
个指标同盐胁迫一样也发生了相应的变化, 并且在耐碱的转基因株系和不耐碱的对照中存在显著性差异, 由此表明, 以上3个生理生化指标也可作为植物耐碱性评价的基本指标。
在豆科植物苜蓿中含硫氨基酸的含量非常低, 而含硫氨基酸又是动物所必需的氨基酸。为了改善这种不均衡的状况, 本研究利用经过人工改造的甲硫氨酸 SCMRP基因[ 23]转入苜蓿植株, 有效地提高了苜蓿中甲硫氨酸的含量。但是, SCMRP基因的导入也导致天冬氨酸含量的下降, 却不影响另一种含硫氨基酸——半胱氨酸的含量, 最终保证转基因苜蓿含硫氨基酸总含量的增加。至于天冬氨酸含量下降的具体原因还有待进一步研究。
本研究通过双价基因的同时导入, 最终获得了耐碱性和甲硫氨酸含量均提高的转基因苜蓿新材料。由此表明, 在苜蓿基因工程领域, 可以通过双价乃至多价基因的联合导入而达到多效的转基因育种的目的。然而, 在选用多基因时, 不可忽视基因之间可能存在的拮抗和多个基因在同一个转基因植株中的转录和表达水平不一致等问题[ 40], 相信这些问题将在未来的实践中解决。
构建双价基因组成型植物表达载体pBEOCBRLK- SCMRP; 获得超量表达的转 GsCBRLK-SCMRP基因苜蓿; GsCBRLK的超量表达提高了转基因苜蓿的耐碱性, SCMRP基因的表达提高了转基因苜蓿甲硫氨酸含量。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|