以3个耐冻性和冷驯化能力不同的马铃薯野生种
Using reverse transcription polymerase chain reaction (RT-PCR), three full-length cDNAs of ω-6 desturases (
低温冷害和冻害经常造成马铃薯( Solanum tuberosumL.)严重减产[ 1, 2], 如2008年2月发生在中国南方冬作马铃薯区的凝冻灾害直接导致10亿元的经济损失[ 3]。低温会造成质膜不可逆的损伤, 最后导致电解质渗漏和组织崩塌。在草本植物中质膜被认为是低温胁迫的关键位点[ 4]。通过冷驯化能使很多植物的耐冻性得到提高, 因此在冷冻温度胁迫适应期间质膜必然发生变化, 研究者们详细分析了质膜的油脂成分并提出了质膜油脂成分和冷驯化能力之间的显著关联的证据[ 5, 6]。
对于低温响应, 脂肪酸脱氢酶通过调节脂肪酸不饱和度从而调节膜的流动性[ 7]。在植物脂肪酸脱氢途径中, 可溶性质粒硬脂酰基载体蛋白脱氢酶催化硬脂酸(18:0)的第9和第10个碳原子间第一个双键的形成产生单不饱和油酸(18:1), 随后, 油酸成为甘油糖脂的一部分进入质粒体或内质网膜[ 8]。膜结合的ω-6脱氢酶(FAD2)在油酸的碳12和13之间插入一个双键从而形成双不饱和亚油酸(18:2)[ 9]。ω-3脱氢酶进一步催化在碳15和16之间引进第3个双键形成三元不饱和α-亚麻酸(18:3)[ 10]。
目前, 已报道了草本植物多不饱和脂肪酸水平和寒冷敏感性之间的密切关系[ 11]。拟南芥 fad2突变体的内质网中缺乏18:1脂酸酸脱氢酶活性, 使叶绿体膜中的多不饱和脂肪酸的量显著减少[ 12], 在6℃条件下, 42 d后生长受到抑制, 最后导致植株枯萎并死亡。最近的研究发现冷胁迫期间冷驯化能力使多不饱和脂肪酸积累, 野生马铃薯 S. commersonii叶片的膜甘油糖脂中的亚油酸累积, 然而马铃薯普通栽培种 S. tuberosum在寒冷胁迫期间并没有这种特性[ 13]。植物中的油酸脱氢酶(FAD2)是负责催化油酸(OA)变成亚油酸(LA), 通过调节油酸脱氢酶基因即可调节OA和LA的比例[ 14]。研究者们从棉花[ 15]、橄榄[ 9]、向日葵[ 16]、大豆[ 17]、马齿苋[ 8]和旱金莲[ 18]等不同物种中分离出大量的 FAD2基因。目前从马铃薯中分离的抗寒相关基因有 SM2358、 MasCIC和 A13[ 19]。Joachim等[ 20]从马铃薯块茎中分离的寒冷诱导基因有 CI7、 CI13、 CI19和 CI21。Tadcusz等[ 21]从抗寒的野生马铃薯 S. sogarandinum中分离了 Ssci1、 Ssci12、 Ssci17和 Ssci20等基因, 在寒冷处理期间, 这些基因在 S. sogarandinum中都比在寒冷敏感的栽培种 S. tuberosum中转录水平高 。
经鉴定, 有35个不同的马铃薯野生种对霜冻有不同程度的耐受性[ 22], 其中 S. commersonii和 S. acaule耐冻且具较强冷驯化能力, 而 S. cardiophyllum对冷冻敏感且不具冷驯化能力[ 23]。关于马铃薯 FAD2基因的研究还未见报道。本研究利用这3个耐冻性差异较大的马铃薯野生种, 了解其 FAD2基因序列或表达的基因型差异, 旨在为马铃薯的耐冻性分子改良提供理论基础。
从Inter Regional Potato Introduction Station (NRSP-6), Sturgeon Bay, WI, USA引进马铃薯野生种, S. commersonii(PI 473412)、 S. acaule(PI 472678)和 S. cardiophyllum(PI 341233)。2012年3月将其种植于气候箱中, 每份材料种植9株。箱内温度为22±1℃, 光照强度400 μmol m-2 s-1, 14 h/10 h光暗培养, 相对湿度为70%±5%。
在植株生长5周后, 为了实现冷驯化, 将气候箱温度设为白天4℃, 晚上2℃, 14 h /10 h光暗培养, 光照强度为100 μmol m-2 s-1, 冷驯化时间为12 d。
采用电解质渗漏法鉴定耐冻性[ 3]。取成熟叶片用蒸馏水冲洗干净, 放入带盖试管(25 mm × 150 mm)底部, 每管放一片, 叶柄朝上, 叶面朝外。将试管放入水浴锅中(水浴锅中的媒介为1∶1的乙二醇和蒸馏水混合物)。水浴锅的初始温度设为0℃, 保持30 min降到-0.5℃再保持30 min, 降温速度为0.5℃ 30 min-1。温度从-0.5℃降到-1.0℃并保持30 min后在每管中加入一小块冰, 再保持30 min后将温度降为-1.5℃, 保持1 h, 降温到-2℃并保持30 min后再降到-2.5℃, 30 min后将温度从-2.5℃降到-3.0℃, 保持30 min后取样。依次类推, 降温直到目标温度, 并分别取样。并在到达每个温度点后即刻将试管取出并插入冰中, 于4℃的冰柜中解冻过夜。次日将解冻后的叶片用锋利的刀片切成5 mm的小条装入玻璃试管并加25 mL蒸馏水。用真空泵以0.1 MP的真空度抽气6 min, 在振荡器上以220转 min-1的速度振动1 h, 静置后测电导率R1。将试管盖上盖子放入高压灭菌锅中121℃灭菌15 min, 冷却至室温测电导率R2。电解质渗出率(%)= R1/R2× 100%。将每个温度对应的3次电解质渗出率的平均值带入Logistic方程进行非线性拟合, 方程拐点即为材料的半致死温度(LT50), 用以表示材料的耐冻性。在冷驯化0 d和12 d进行耐冻性鉴定, 冷驯化能力是驯化后的LT50减去驯化前的LT50。所有样品的鉴定进行3次重复。
在冷驯化0 d和12 d时提取RNA, 采用Invitrogen公司TRIzol试剂, 参照说明书。采用Invitrogen公司的SuperScript III第一条链试剂盒合成cDNA。
根据茄科基因组网络(http://solgenomics.net/organism/Solanum_tuberosum/genome)中的 FAD2基因序列(PGSC0003DMG400011135)设计引物, 软件为Primer Premier 5。正向引物F1序列为5°-AT GGCTTGCAGTGTTGCAGACTCTG-3°, 反向引物R1326序列为5°-TCAAGCGTAGTCTGGCATTAC TTTTTTAAG-3°, 委托上海生工北京分公司合成引物。
用设计的引物(F1和R1326)以cDNA模板进行扩增。20 μL的PCR反应混合物包括11.2 μL的双蒸水, 5×PCR buffer 4 μL, 5 mmol L-1 dNTPs 0.8 μL, 5 μmol L-1正反向引物各0.8 μL, GO Taq DNA酶0.4 μL, 30 ng μL-1 cDNA模板2 μL。PCR反应条件为94℃ 3 min; 94℃ 30 s, 60℃ 1 min, 72℃ 2 min, 共35个循环; 最后72℃延伸7 min。PCR反应产物经1.2%琼脂糖凝胶电泳检测后回收, 通过热激法(42℃, 45 s)将纯化产物与pGEM-T克隆载体连接并转化到大肠杆菌(DH5α)感受态细胞中。对重组子进行蓝白斑筛选, 挑白斑在37℃摇菌, PCR检测后获得阳性克隆并送到中国农业科学院重大工程楼测序。
采用Bioxm 2.6进行 FAD2基因的开放读码框和编码的氨基酸序列推断。利用NCBI上Blast程序进行序列比对。用Clustal 1.8.1和Mega5.05软件构建系统进化树。用DNAMAN(5.0)进行多序列比对。蛋白的理化特性用Protparam软件(
用冷驯化0 d和12 d的植株叶片提取总RNA, 并反转录为第一链cDNA (Invitrogen试剂盒)。采用ABI StepOne Real-time PCR System。反应体系为20.0 μL, 含有10.0 μL 2×TransStar Green qPCR Super Mix, Passive Reference Dye 0.4 μL, 2.0 μL cDNA, 10 μmol L-1正反向引物(F1171和R1299)各0.4 μL, 6.8 μL ddH2O。运行程序为95℃预变性30 s, 95℃变性15 s, 60℃退火15 s, 72℃延伸10 s, 40次循环。所有试验样品均重复3次。qPCR引物序列和内参基因的引物序列见表1。选用内参基因 β-tubulin2[ 24]。根据 FAD2基因测序的编码区序列设计引物F1171和R1299用于qPCR。采用ΔΔCT法计算 FAD2基因的表达量。
| 表1 FAD2基因的qPCR引物和内参基因引物序列 Table 1 qPCR primers sequence of FAD2 and primers sequence of reference gene |
3个马铃薯野生种在冷驯化0 d的耐冻性差异极显著, S. acaule的LT50最低, 为-5.3℃, S. cardiophyllum的LT50最高为-1.8℃ (表2)。冷驯化12 d后, S.commersonii和 S.acaule的LT50分别为-10.1℃和-8.9℃, 均与 S. cardiophyllum的LT50具极显著差异, 同时 S. commersonii和 S. acaule的冷驯化能力与 S. cardiophyllum的也具极显著差异。
| 表2 3个野生马铃薯的LT50和冷驯化能力 Table 2 LT50 temperature and cold acclimation capability of three wild potato species |
通过引物F1和R1326扩增, 从3个野生马铃薯材料中分别都得到1326 bp的片段(图1)。序列测定表明, 野生马铃薯 S. commersonii (图3)、 S. acaule和 S. cardiophyllum的 FAD2基因编码区的核苷酸序列长度均为1326 bp, 编码441个氨基酸, 分别命名为 Cmm-FAD2(GenBank登录号为KF214782)、 Aca-FAD2(KF214781)和 Cph-FAD2(KF214783)。
通过比对3个野生种 FAD2基因的核苷酸序列和蛋白序列(图2), 发现共有18处核苷酸存在差异, 其中在第33、第54、第134、第171、第210、第241、第252和第267位核苷酸的不同导致该基因对应的氨基酸残基改变, 其余10个核苷酸由于简并密码子的原因并未引起相应氨基酸残基的变化。3个野生种的 FAD2基因编码的蛋白序列高度相似, 同源性为99.55%。在该基因蛋白序列的第11和第44氨基酸
残基处(图3), 耐冻且有驯化能力的 S. commersonii和 S. acaule有相同的氨基酸, 而冷冻敏感 S. cardiophyllum的氨基酸却不同。 S. commersonii和 S. cardiophyllu在第18、第57、第70、第80、第84和第89处的氨基酸残基与 S. acaule不相同。
 | 图2 3个野生马铃薯的 FAD2核苷酸序列比对Fig. 2 Alignment of nucleotide sequences of FAD2 gene in three potato wild species |
3个野生种的 FAD2基因都有一个保守结构域, 属于脂肪酸脱氢酶结构域(图3), 该结构域从第191个氨基酸残基开始至第397个氨基酸残基结束。在这3个野生种 FAD2基因的蛋白序列中, 都有4个跨膜结构域TM-1、TM-2、TM-3和TM-4, 同时三者都具有高度保守的H-boxI、H-boxII和H-boxIII组氨酸结构域(图3), 这些组氨酸结构域可能参与氧化还原反应中金属离子的络合反应。在跨膜结构域和组氨酸结构域中, 3个野生种的FAD2蛋白的氨基酸残基并无差异, 但其分子式和分子量各不相同(表3), 等电点在8.79~9.02。半衰期时间都为30 h, 稳定指数为45.03~46.42, 都是不稳定蛋白。三者FAD2蛋白的正电荷数都小于负电荷数。总平均疏水性为-0.116~ -0.104, 表明该蛋白都是亲水性的。通过二级结构预测, 3个种的FAD2蛋白序列中, 冷冻敏感的 S. cardiophyllum的α-螺旋、延伸链和随机卷曲的比例都大于耐冻且具有冷驯化能力的 S. commer- sonii和 S. acaule, 而β折叠的比例却小于后两者。
| 表3 3个不同耐冻性野生马铃薯的FAD2蛋白理化特性预测 Table 3 Physical and chemical properties prediction of FAD2 proteins from three wild potato species with different levels of freezing tolerance |
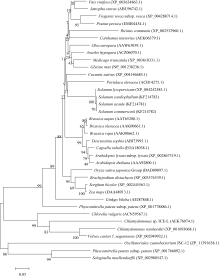
利用Clustal 1.8.1软件对36个物种间 FAD2基因的氨基酸序列比较显示, 番茄FAD2蛋白序列(XP_004242585.1)与克隆得到的 S. commersonii、 S. cardiophyllum和 S. acaule的FAD2蛋白序列同源性最高, 分别为96.6%、96.8%和97.5%。利用MEGA 5.05软件, 选择邻位相连法(NJ), 设定重复抽样次数为1000, 对36个物种的FAD2蛋白序列构建NJ系统进化树(图4)表明, 克隆的3个马铃薯野生种的 FAD2基因和番茄(XP_004242585.1)的亲缘关系最近, 马铃薯野生种的 FAD2基因进化较为独立, 除番茄外与之相近的物种有马齿苋(ACB14275.1)。
通过qPCR对3个野生种的 FAD2基因定量分析表明, 12 d的冷驯化处理使得 FAD2基因在3个野生种中都上调表达, 但 S. commersonii和 S. acaule的 FAD2基因表达水平分别是冷驯化前的1.87倍和1.74倍, 均高于 S. cardiophyllum的 FAD2基因的0.94倍(图5)。方差分析结果表明, S. cardiophyllum分别与 S. commersonii和 S. acaule之间 FAD2基因的上调表达水平差异显著, 而 S. commersonii和 S. acaule之间 FAD2基因表达水平差异不显著。说明 FAD2基因在耐冻和冷冻敏感的马铃薯野生种间表达水平差异显著。
本研究表明, 3个耐冻性不同的马铃薯野生种的 FAD2基因与番茄的 FAD2基因亲缘关系最近, 其次是马齿苋, 且未比对到马铃薯 FAD2基因信息, 表明上述基因是首次在马铃薯中被克隆。对于很多作物而言通过寒冷进行 FAD基因表达的转录调控已经是众所周知, 但关于番茄的 FAD2基因未见报道。Teixeira等[ 8]研究认为马齿苋在寒冷(5℃)和叶片受伤条件下 FAD2-2基因的相对表达量都增加, 在寒冷胁迫条件下观察到该基因没有发生累计效应, 但在寒冷胁迫和受伤2种处理条件下, 该基因的相对表达量也呈增加趋势; 马齿苋的 FAD2-2基因可能一方面负责种子中储藏脂肪的脱氢作用, 另一方面涉及在根、叶和茎中膜脂肪的脱氢作用。Anastasia等[ 25]认为棉花的 FAD2-3和 FAD2-4基因的表达都受低温调控, FAD2-4的表达显著高于 FAD2-3。橄榄果实的 FAD2-1和 FAD2-2[ 26, 27]、白芸豆叶片的 FAD2[ 28]在转录水平均受低温调控。这些研究结果都说明 FAD2基因在膜对寒冷胁迫的适应过程中有直接作用。
Yang等[ 29]从佛手柑中克隆了 FAD2基因, 与28℃的对照相比, 在6℃条件下2个基因型中 FAD2基因表达差异显著, 耐寒的Aihu比寒冷敏感的Qingpi的 FAD2基因表达增加更早且更多, Aihu植株叶片中的亚麻酸含量显著增加, 表明 FAD2基因的表达和基因型间的耐寒性呈正相关。与之相似的是, 本研究中的2个耐冻且能冷驯化的野生马铃薯与冷冻敏感的野生马铃薯之间 FAD2基因的上调表达差异显著。可能是 FAD2基因上调表达增加不饱和脂肪酸的含量从而提高膜脂质的流动性, 最终使得耐冻性得到提高。在耐冻性鉴定结果中已证实, 通过12 d的冷驯化, S. commersonii和 S. acaule的LT50分别提高了6.8℃和3.5℃, 而冷冻敏感的 S. cardiophyllum仅仅提高了0.5℃。
关于 FAD2基因的功能, Shi等[ 30]研究认为, 转 OsFAD2基因的水稻植株抗寒性比野生型植株的抗寒性有所提高, 在10℃条件下, 野生型植株不久就萎蔫且生长停滞, 但转基因株系仅叶尖有轻微的卷曲症状。周洲[ 31]将毛白杨 PtFAD2转入银腺杨中, 转基因株系F2-100、F2-35与野生型植株相比, 亚油酸(C18:2)含量提高5.7%和7.1%; 亚麻酸(C18:3)含量提高3.2%和2.1%。在-4℃处理3 h后, F2-100和F2-35的扦插苗的存率分别为60.0%±5.7%和56.6%±3.3%, 而野生型存活率仅为37.6%±3.3%。酵母中表达绿藻 fad2基因, 低温条件下转录物浓度上调, 提高了酵母的抗冷能力, 它可能参与低温适应并与其耐冻性有关[ 32]。外源表达向日葵的 FAD2基因增加了酵母脂质的不饱和指数和膜脂流动性, 其耐盐性和耐冻性得到提高[ 33]。综上所述, 这些研究结果都充分证明 FAD2基因在不饱和脂肪酸合成途径中
的关键作用, 对于提高植物的耐冻性有重要意义。关于马铃薯 FAD2基因的功能, 我们还需要做进一步的研究。本研究对马铃薯的耐冻育种以及阐述野生马铃薯耐冻的分子机制都有重要的意义。
从3个耐冻性差异较大的马铃薯野生种 S. commersonii、 S. cardiophyllum和 S. acaule中克隆出 FAD2基因, 该基因在耐冻和冷冻敏感的马铃薯野生种中存在氨基酸残基差异。耐冻且有冷驯化能力的 S. commersonii和 S. acaule的FAD2蛋白与冷冻敏感的 S. cardiophyllum FAD2蛋白的α-螺旋、延伸链和随机卷曲存在明显差异。 FAD2基因在耐冻的野生种 S. commersonii和 S. acaule中的上调表达显著高于冷冻敏感的 S. cardiophyllum, 可能是 FAD2基因上调表达增加了不饱和脂肪酸的含量从而提高膜脂质的流动性, 最终使 S. commersonii和 S. acaule耐冻性得到进一步的提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|