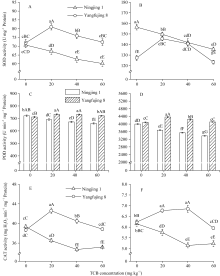
-1) TCB胁迫下, 最长根长、地上部和地下部干物重极显著增加, 当中高浓度(40 mg kg-1、60 mg kg-1) TCB胁迫时, 最长根长、株高、单穴分蘖数、地上部和地下部干物重显著下降。不同浓度TCB胁迫下, 敏感基因型宁粳1号根系活力、叶绿素含量、叶片和根系可溶性蛋白质含量相对较低, 叶片和根系超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性明显降低, ]]>-1) TCB胁迫下, 根系活力、叶片和根系的可溶性蛋白含量、SOD、POD、CAT活性极显著增加, ]]>
-1) TCB胁迫时, SOD、POD、CAT活性虽然增强, 但]]>
-1) TCB胁迫时, 其根系活力、叶绿素含量极显著降低, 根系中SOD、CAT活性显著降低, ]]>
A soil culture experiment was conducted to study the effects of 1,2,4-trichlorobenzene (TCB) on morphological and physiological indexes of rice at maximum tillering stage, using rice cultivars of Ningjing 1 (TCB sensitive genotype) and Yangfujing 8 (TCB tolerant genotype), with four treatments of TCB concentrations including 0 (CK), 20, 40, and 60 mg kg-1. The results indicated that the maximum root length, plant height, tillers per hill, shoot and root dry weight of Ningjing 1 were all decreased significantly (
氯苯类化合物(CBs)有广泛的工业和家庭用途, 常被用作化学合成(农药、染料)的中间体、溶剂、卫生用品及电解液的组成成分[ 1]。这类化合物易挥发、化学性质稳定, 是环境中分布广、难降解的一类环境污染物, 已被我国列入“水中优先控制污染物黑名单”[ 2]。CBs的辛醇-水分配系数较高、苯环上氯原子数目较多, 故能通过食物链转移、积累并放大, 进而危害人类健康[ 3, 4]。
1,2,4-三氯苯(TCB)是CBs中常见的一种, 除了上述工业用途之外, 在农业中常作为除草剂的生产原料, 也是农药六六六、林丹等的降解产物[ 5]。我国是三氯苯的生产大国[ 6], 由于它的广泛应用, TCB已在我国土壤[ 7, 8]、城市污泥[ 9]、地表水[ 10, 11]与地下水[ 12]、表层沉积物[ 4, 13]、水生生物[ 4]及陆生植物[ 7, 14]中检出。因其具有致畸、致癌、致突变作用, 已被美国环保局(EPA)列入优先控制污染物名单[ 15]。我国国家标准生活饮用水卫生标准规定TCB总量不得超过0.02 mg L-1 [ 16], 北京市将TCB列入水污染物排放标准, 并明确限定它的排放量最高不得超过0.6 mg L-1 [ 17]。
经农田灌溉、污泥农用、农药使用和挥发扩散沉降[ 18, 19]等多种渠道, TCB直接或间接进入农田生态系统。水稻是我国主要的粮食作物之一, 在全国粮食生产与消费中占主导地位。分蘖期是水稻生长发育的重要时期之一, 此期内营养生长迅速, 直接影响单株分蘖数和总穗数, 对水稻产量起着决定性作用。以往TCB胁迫对作物生理机制影响的研究主要集中在苗期[ 5, 20, 21, 22, 23, 24, 25], 抽穗期也有少量报道[ 26], 至今未见水稻分蘖期生长及对TCB胁迫生理响应的报道。本文在前期筛选出的耐TCB胁迫代表品种[ 27]的基础上, 研究水稻分蘖盛期对TCB胁迫的生态毒性与生理响应, 以期为分蘖盛期水稻抗逆栽培管理提供依据。
选用长×宽×高为60 cm×50 cm×25 cm的塑料周转箱, 每箱装土35 kg, 加水浸泡, 施尿素2 g作为基肥, 调节pH值在5.0~5.5之间。
设置0、20、40、60 mg TCB kg-1干土4个处理, 每个处理3次重复。将TCB溶液(无水乙醇作为溶剂)加入土中, 搅拌均匀, 放置3 d后, 将秧苗(三叶一心)移栽进周转箱。行株距为10 cm × 8 cm, 双本栽。栽培管理与常规高产栽培一致。
1.3.1 形态指标的测定 在水稻分蘖盛期取代表性植株3穴, 用直尺测量最长不定根根长; 每穴取10根长势基本一致的不定根, 排列整齐后用游标卡尺测其根粗, 取平均值; 用米尺测量株高; 将单穴植株地上部分和地下部分在105℃烘箱内杀青15 min, 然后80℃烘至恒重后分别称取干重。
1.3.2 生理指标的测定 采用α-萘胺法测定根系活力[ 28], 单位为μg h-1 g-1 FW; 采用SPAD-502型叶绿素计测定叶绿素含量; 采用考马斯亮蓝法测定叶片和根系的蛋白质含量[ 28], 以mg g-1 FW为单位; 采用氮蓝四唑(NBT)光还原法[ 29]测定超氧化物歧化酶(SOD)活性, 以抑制反应50%的酶量为一个酶活性单位(U), 酶活性单位以U mg-1 Protein表示; 采用愈创木酚法测定过氧化物酶(POD)的活性[ 28], 以每分钟 A470值变化0.01作为一个酶活性单位(U), 酶活性以U min-1 mg-1 Protein表示; 采用碘量法测定过氧化氢酶(CAT)活性[ 30], 以每分钟分解H2O2的毫克数表示酶活性大小, 单位为mg H2O2 min-1 mg-1 Protein。采用硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量[ 31], 单位为nmol g-1 FW; 用羟氨氧化法[ 32]测定超氧阴离子自由基( 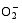
用SPSS16.0进行方差分析, Duncan’s测验法多重比较, Origin7.5软件作图。
TCB胁迫下, 除了20 mg kg-1 TCB处理下扬辐粳8号的株高、分蘖数与对照(CK)差异不显著以外, 其他处理下两个基因型水稻分蘖盛期最长根长、根粗、株高、单穴分蘖数与对照差异显著(图1和表1)。敏感基因型宁粳1号的最长根长、株高、单穴分蘖数、地上部和地下部干物重均随TCB胁迫浓度的增加而显著减少, 耐性基因型扬辐粳8号这5个指标在低浓度(20 mg kg-1) TCB胁迫下显著增加, 中高浓度(40 mg kg-1和60 mg kg-1) TCB胁迫下显著递减, 且递减幅度均小于宁粳1号。低浓度TCB胁迫下, 宁粳1号地上部和地下部干物重比未进行TCB胁迫时分别降低2.9%和9.3%; 而扬辐粳8号分别增加0.6%和1.7%。中高浓度TCB胁迫对宁粳1号地上部和地下部干物重(与未进行TCB胁迫相比)的降幅均大于扬辐粳8号。2个基因型水稻的根粗随着TCB胁迫浓度的增加而显著递增, 且中高浓度(40 mg kg-1和60 mg kg-1) TCB胁迫下, 敏感基因型宁粳1号根粗的增幅大于耐性基因型扬辐粳8号。说明低浓度TCB对耐性基因型扬辐粳8号的生长有一定的刺激作用, 能促进其生长; 而当TCB浓度过高时, 扬辐粳8号的生长也受到显著抑制。宁粳1号对TCB胁迫的耐性较差, 表现为生长延缓, 植株矮小, 根系变黑。
由图2-A可知, 未进行TCB胁迫时, 两种基因型水稻的根系活力差异不显著; 相同浓度TCB胁迫下, 扬辐粳8号的根系活力极显著高于宁粳1号。宁粳1号的根系活力在中高浓度TCB胁迫下极显著下降, 并呈递减趋势。扬辐粳8号的根系活力在低浓度(20 mg kg-1) TCB胁迫下极显著增加, 40 mg kg-1 TCB胁迫时, 与对照差异不显著, 而当TCB浓度达到60 mg kg-1时, 其活力极显著降低。
未进行TCB胁迫时, 2种基因型水稻的叶片叶绿素含量差异不显著; 相同浓度TCB胁迫下, 扬辐粳8号叶绿素含量极显著高于宁粳1号(图2-B)。当TCB胁迫浓度大于20 mg kg-1后, 两种基因型水稻的叶绿素含量均随TCB胁迫浓度增加极显著递减, 且宁粳1号的下降幅度明显大于扬辐粳 8号。
未进行TCB胁迫时, 两种基因型水稻叶片和根系可溶性蛋白质含量差异不显著; 相同浓度TCB胁迫下, 扬辐粳8号叶片和根系可溶性蛋白含量均极显著高于宁粳1号(图3)。宁粳1号叶片和根系可溶性蛋白含量随TCB胁迫浓度的增加而极显著递减。扬辐粳8号叶片可溶性蛋白含量均极显著高于对照, 其叶片可溶性蛋白含量在中低浓度TCB胁迫下呈递增趋势, 60 mg kg-1下有所下降; 而根系可溶性蛋白含量在中高浓度TCB胁迫下均极显著高于对照。
| 表1 TCB胁迫对2种基因型水稻分蘖盛期各形态指标的影响 Table 1 Effect of TCB on morphological index in the two rice genotypes at maximum tillering stage |
2.5.2 对POD活性的影响 TCB胁迫下, 宁粳1号叶片(图4-C)和根系(图4-D) POD活性均极显著低于对照, 且随TCB浓度增加而递减。扬辐粳8号叶片POD活性在中低浓度胁迫下, 均显著高于对照, 且20 mg kg-1与40 mg kg-1间差异不显著; 而根系POD活性在中低浓度TCB胁迫下均极显著高于对照, 从20 mg kg-1开始呈下降趋势, 60 mg kg-1胁迫时与对照差异不显著。
2.5.3 对CAT活性的影响 TCB胁迫下, 宁粳1号叶片(图4-E)和根系(图4-F) CAT活性均极显著低于对照, 且随TCB浓度增加而先递减后略有所上升(40~60 mg kg-1)。扬辐粳8号叶片CAT活性随TCB浓度增加先升高后降低, 在中低浓度TCB胁迫下均极显著高于对照, 而60 mg kg-1时与对照差异不显著; 根系CAT活性在中低浓度TCB胁迫下显著增加, 并呈上升趋势, 高浓度TCB胁迫下CAT活性下降, 与对照相比均达到极显著水平。
2.6 TCB胁迫对2种基因型水稻分蘖盛期 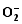
TCB胁迫下, 宁粳1号叶片(图5-A)和根系(图5-B) 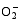
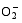
TCB胁迫下, 宁粳1号叶片(图5-C)和根系(图5-D) MDA含量均随TCB浓度增加而极显著升高。扬辐粳8号叶片和根系MDA含量在20 mg kg-1时均极显著低于对照, 而后呈上升趋势, 并显著或极显著高于对照。
随着食品安全问题被屡屡曝光, 人们对农产品质量与安全的关注度日益增加。而CBs可通过多种途径进入农田, 被作物吸收后, 在体内积累、迁移、转化或释放[ 33, 34, 35]。人类长期接触或食用后在体内富集, 进而危害身体健康。水稻、小麦、玉米等单子叶植物的生长发育均易受CBs的影响, 其中水稻的报道较多。
根系是作物吸收水分和养分的主要器官, 也是作物接触土壤中污染物的关键部位之一。以往研究认为TCB胁迫使水稻幼苗的根系伸长受到抑制, 细胞异常如细胞间隙加大、细胞壁显著加厚等, 根系活力也有所降低[ 5, 24, 36]。本研究结果显示, 分蘖盛期水稻的根系对TCB浓度的响应存在基因型差异。低浓度TCB胁迫下, 敏感基因型宁粳1号的最长根长、地下部干物重、根系活力分别比对照降低9.1%、9.3%、2.0%; 而扬辐粳8号分别增加3.2%、1.7%、10.0%。在中高浓度TCB胁迫下, 2种水稻的最长 根长、地下部干物重均极显著降低, 根粗均极显著增加, 但宁粳1号的降(增)幅均大于扬辐粳, 说明中高浓度TCB对根系的毒害效应严重, 即使是耐性基因型扬辐粳8号的地下部生长也受到阻碍, 可能的原因是TCB浓度过高时, 其较高的疏水性导致其在植株根系表面大量吸附, 破坏了细胞器结构及根系稳态; 但由于耐性基因型根系抗氧化酶、谷胱甘肽- S-转移酶和顺式还原酮加双氧酶等解毒酶[ 36]受到
Enzymes activities in the curve with different letters are significantly different at P<0.01 (capital) and P<0.05 (lowercase), respectively.
诱导表达, 导致其受到的毒害作用小于宁粳1号。
TCB对水稻苗期株高[ 24]、地上部生物量[ 24]和成熟期有效分蘖数[ 37]抑制作用显著, 本研究显示TCB对分蘖盛期水稻的地上部也有明显的影响。敏感基因型宁粳1号的株高、地上部干物重、单穴分蘖数在TCB胁迫下均显著低于对照, 而耐性基因型扬辐粳8号在低浓度TCB胁迫下, 株高、单穴分蘖数、地上部干物重与对照相比, 增幅分别为0.6%、8.6%和0.6%, 说明扬辐粳8号对低浓度的TCB胁迫有较强的耐受性, 但当TCB浓度过高时, 对水稻植株的生物毒性加大, 影响了细胞的分裂与生长, 对营养物质的吸收和利用产生干扰, 从而使植株的长势长相异常。
光合作用是绿色植物生长发育的物质基础和能量来源。低温、干旱、盐胁迫、重金属等逆境条件均能影响作物的光合作用, 最终导致减产歉收。王泽港等[ 24, 26]研究发现TCB的添加会导致水稻
当大、小写字母不同时分别表示0.01和0.05差异显著水平。
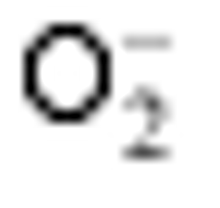
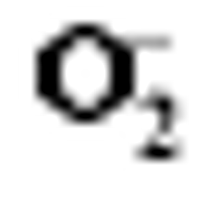
Values of A, B, C, and D with different letters are significantly different at P<0.01 (capital) and P<0.05 (lowercase), respectively.
幼苗期叶绿素含量、Rubisco酶活性的下降及抽穗期水稻叶片叶绿素含量、净光合速率( Pn)、最大光能转换效率( Fv/ Fm)、光合电子传递的量子化效率( ΦPSII)、光系统PSII的潜在活性( Fv/ Fo)、光化学猝灭系数( qP)及非光化学猝灭系数( qN)呈递减趋势; 杜青平、张波等[ 5, 38]发现水稻和小麦幼苗叶片中叶绿素a、b和叶绿素总含量均随TCB浓度的增加而呈降低趋势。本研究表明, 低浓度TCB使分蘖盛期宁粳1号叶 绿素含量比对照降低3.4%, 而对扬辐粳8号却增加0.2%。中高浓度的TCB胁迫使水稻光合器官受到伤害[ 26], 对两品种分蘖盛期的叶绿素含量均有极显著的抑制作用, 从而引起光合作用减弱, 干物重降低。
蛋白质是植物生长发育、新陈代谢过程中的重要物质。已有研究表明TCB能诱导水稻和小麦幼苗蛋白质的表达[ 23, 39], 主要包括解毒酶、细胞壁物质、激素、原初或次生代谢与调节等的相关酶, 进而导致植株体内蛋白质含量的增加[ 25]。本研究显示, 不同浓度TCB胁迫下, 分蘖盛期宁粳1号叶片和根系可溶性蛋白质分别与各自对照相比, 叶片的降幅(13.0%、22.1%、28.8%)远小于根系(18.7%、35.4%、43.4%); 扬辐粳8号叶片可溶性蛋白质的表达受到了诱导, 增幅分别为3.1%、7.1%、3.9%。中低浓度TCB胁迫下, 扬辐粳8号根系可溶性蛋白质含量的增幅分别为14.1%、26.4%; 而高浓度胁迫时, 根系可溶性蛋白质含量与对照相比差异不显著。说明扬辐粳8号对TCB胁迫的耐性强, 中低浓度能够充分诱导适应逆境相关蛋白及酶的表达, 而宁粳1号耐性较差, 蛋白合成受阻或者分解加快, 导致蛋白质含量较低, 对有机污染胁迫适应性差。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等是植物体内清除活性氧的重要抗氧化酶, 也是酶保护系统的重要组分。酶保护系统启动后, 能及时清除一定数量过剩的活性氧和过氧化物, 从而减轻过氧化作用的伤害, 提高细胞的抗逆性。丙二醛(MDA)含量反映了细胞膜脂过氧化程度及器官的衰老情况。高浓度TCB胁迫下, 水稻敏感品种幼苗的MDA含量显著增加, SOD、POD、CAT活性有所降低, 根系受到的伤害明显大于叶片[ 5, 25]。张国良等[ 22]认为小麦敏感品种根系的SOD、POD活性在低浓度TCB胁迫下有所升高, 而CAT活性却显著降低。刘宛等[ 20, 21]发现TCB能够使萌发的大豆种子活性氧代谢紊乱, 超氧阴离子自由基( 
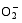
低浓度TCB胁迫对扬辐粳8号的生长发育有明显的促进作用, 可能主要有以下三方面原因。(1)植株的解毒系统适应性强, 抗氧化酶活性有所提高、谷胱甘肽-S-转移酶和顺式还原酮加双氧酶(ARD)受到诱导表达[ 36], 有利于清除活性氧和有毒物质、维持细胞结构的稳定, 进而增强植株的抗逆能力; (2) MicroRNA是一类与植物适应逆境胁迫有关的调控基因表达的小分子RNA[ 40], CB等有机污染胁迫可能诱导或下调水稻相关MicroRNA的表达, 从而调节植株的代谢过程; (3) 低浓度TCB能增加以其为碳源的微生物数量, 提高土壤肥力[ 41, 42], 而扬辐粳8号对TCB胁迫有一定耐受限度, 在低浓度TCB下仍能正常吸收与利用养分。
不同浓度TCB胁迫下敏感基因型和耐性基因型水稻的生长和生理特性差异显著, 敏感基因型随胁迫浓度的增加生长和生理活性受抑程度显著递增; 而耐性基因型在低浓度TCB胁迫下, 植株解毒能力
较强, 最长根长、地上部和地下部干物重均极显著高于对照, 根系活力、叶片和根系可溶性蛋白含量较高, 酶保护系统清除活性氧的能力较强, 膜脂过氧化程度较低。中高浓度TCB胁迫才对耐性基因型水稻的生长表现出明显的抑制作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|