第一作者联系方式: E-mail:xiupengsong@163.com
利用RT-PCR和RACE技术从甘蔗品种新台糖22 (ROC 22)中克隆获得
The full-length sequence cDNA of
甘蔗( Saccharum officenarum L.)是我国最主要的糖料和能源作物[ 1]。甘蔗安全生产受到干旱、盐渍、极端温度和病虫害的威胁, 利用基因工程的方法可以有效提高甘蔗的抗逆性[ 2], 而挖掘抗逆基因是首要基础。 S-腺苷甲硫氨酸合成酶( S-adenosyl-methionine synthetase, SAM)是植物代谢过程中的一个关键酶, 它是生物合成多胺和乙烯等的前体, 参与了植物的转氨丙基、转甲基和转硫等多种重要的生化反应过程, 还能催化ATP与甲硫氨酸反应生成 S-腺苷甲硫氨酸[ 3, 4, 5]。此外, SAM还可与RNA结合参与体内基因表达的调控[ 6, 7]。因此, 对 S -腺苷甲硫氨酸合成酶基因的研究在植物逆境生理、衰老生理、植物生物代谢及其调控研究上均具有重要的意义。现已证实多胺和乙烯均积极地参与了植物的抗逆反应, 因而推测SAM在植物抵御逆境的过程中也发挥重要的作用[ 8, 9]。目前已从番茄[ 10]、盐地碱蓬[ 11]、玉米[ 12]、石蒜[ 13]和大豆[ 14]等植物中克隆获得 S-腺苷甲硫氨酸合成酶基因的cDNA序列, 但迄今尚未见有甘蔗 SAM基因克隆及其在不同组织和不同胁迫条件下表达特性研究的报道。
本研究在前期甘蔗幼苗响应黑穗病菌侵染的蛋白质组学研究的基础上(尚未发表), 通过RT-PCR和RACE技术克隆了甘蔗 S-腺苷甲硫氨酸合成酶基因的全长, 用生物信息学分析该基因的序列特征, 最后利用Real-time PCR技术研究其在不同组织和不同胁迫下的表达特性, 以期为该基因在甘蔗抗逆特别是抗病育种中的应用提供理论依据。
以甘蔗品种ROC 22为材料, 经过炼苗, 选取生长健壮一致的组培苗种植在沙土比例为1∶1的黑色塑料桶(上径40 cm, 下径30 cm, 高40 cm)中, 置广西大学甘蔗智能温室大棚, 水分含量控制在田间持水量的70%左右, 待其长到6~7片真叶时分组处理。一组针刺接种黑穗病菌[ 15], 将采集的萌发率在95%以上的黑穗病病原菌孢子用灭菌的ddH2O稀释成5×106个mL-1的悬浮液, 用灭菌的一次性注射器在甘蔗的生长点针刺4次, 然后沿着叶鞘滴4滴孢子悬浮液, 对照组以ddH2O代替孢子悬浮液, 0、1、2、3和4 d后从针刺位点下2 cm取样; 二组在4℃处理室(白昼16 h/8 h, 湿度65%)低温处理; 三组用10 mmol L-1 H2O2喷洒叶面; 另两组分别用100 mmol L-1 NaCl和15% PEG浇灌; 上述处理均于0、6、12、24、48和72 h后取样。另取不处理的健康甘蔗ROC 22根、茎、叶样品作对照。各样品经液氮速冻, 于-80℃保存备用。
胶回收试剂盒购自Bioflux公司, Dream Taq酶购自Fermentas公司, pMD18-T载体、Reverse Transcriptase M-MLV试剂盒、Primescript RT Reagent Kit和SYBR Premix Ex Taq均购自TaKaRa公司, TRIzol试剂购自北京康为试剂公司, 其他试剂均为国产分析纯。
差异蛋白质点经胰蛋白酶酶解后, 取0.5 μL点入串联飞行时间质谱仪(4700 Proteomics Analyzer)的MALDI-TOF靶中, 在校准点内加入外标(已知质量数的肽混合物)。利用反射模式采集蛋白质的一级质谱信息(MS), 质量范围在800~4000 Da, 激光强度为4000。一级质谱扫描完成后, 取信号强度最高的母离子进行二级质谱分析(MS/MS), 用2 kV的高电压加速, 用CID碰撞裂解母离子后获取每个母离子的离子碎片指纹谱。随后将一级和二级质谱数据导入GPS软件, 利用MASCOT搜索算法对质谱数据综合分析, 搜索Uniprot蛋白质数据库(全部生物种类)和NCBI (植物)中与试验材料相匹配的相关蛋白质。
选用TRIzol试剂提取甘蔗幼苗总RNA, 利用琼脂糖凝胶电泳和Thermo Scientific NanoDrop 2000/ 2000C检测RNA的完整性和浓度。参照Reverse Transcriptase M-MLV试剂盒的说明书稍作修改合成基因克隆所用cDNA模板, 逆转录引物为RT-P: 5'-GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTTT-3'。按照Primescript RT Reagent Kit说明书合成荧光定量PCR所用cDNA模板, 将样品稀释至50 ng μL-1保存于-20℃备用。
以质谱鉴定的SAM蛋白氨基酸序列为参照, 通过Blast分析, 选取同源性较高的核酸序列, 利用Vector NTI 11.0设计兼并引物SAM-F: 5′-ATGGC(A,C) G(G,C)(G,A,T)(G,C)T(C,T)GA(C,T)ACCTTCCTCTT-3′, 下游用逆转录加尾引物3'端: 5'-GGCCACGCG TCGACTAGTAC-3'。反应体系为cDNA 1.0 μL、2.5 mmol L-1dNTPs 2.0 μL、10 μmol L-1上下游引物各1.0 μL、10×buffer 2.5 μL、Dream Taq酶0.15 μL和ddH2O 17.35 μL。反应程序为95℃ 5 min; 94℃ 35 s, 58℃ 35 s, 72℃ 1.5 min, 35个循环; 72℃ 10 min。RT-PCR扩增产物经1%琼脂糖凝胶电泳, 切胶回收目标条带, 与pMD18-T载体连接后转化大肠杆菌感受态细胞DH5α, 37℃过夜培养, 挑取阳性克隆, 经菌体PCR验证后送深圳华大基因科技服务有限公司测序。结果经Blast确认为 SAM基因, 设计引物SAM-ORF-F: 5′-ATGGCCGGTCTCGACACCTTCCT CTT-3′和SAM-ORF-R: 5′-TTAGGCAGAAGGTTTC TCCCACTTGAG-3′扩增基因的完整开放阅读框(open reading frame, ORF)。反应体系及反应程序同3'RACE。
用BioXM 2.6软件预测 ScSAM编码的氨基酸序列; 用NCBI-Protein Blast (http://blast.ncbi.nlm.nih. gov/)在线分析 ScSAM与其他物种的同源性; 用ExPASy Proteomics Server的ProtScale程序预测分析 ScSAM的亲水性和跨膜结构; 在线http://isoelectric. ovh.org/预测 ScSAM编码氨基酸的等电点和蛋白质分子量; 用SOSUIsignal软件预测 S cSAM的信号肽; 用SOPMA软件预测其二级结构; 用SMART和Motif Scan软件分析其蛋白质功能结构域; 用Mega 5.0软件构建SAM氨基酸序列进化树。
根据获得的 ScSAM序列设计荧光定量PCR引物Y-SAM-F: 5′-GAGACAGTCACCAATGATGA-3′, Y-SAM-R: 5′-ATGGGTTAAGGTGGAAGATG-3′; 以甘蔗GAPDH (NCBI登录号为EF189713)为内参基因, 内参引物为Y-GAPDH-F: 5'-AAGGGTGGTGCC AAGAAGG-3'和Y-GAPDH-R: 5'-CAAGGGGAGCA AGGCAGTT-3'[ 16]。利用LightCycle480荧光定量PCR仪分析, 反应体系20 μL, 含2.0 μL的50 ng μL-1 cDNA模板、10 μmol L-1各0.8 μL上下游引物、 10.0 μL SYBR Premix Ex Taq II、6.4 μL ddH2O, 每个样品3个重复。反应程序为95℃ 30 s; 95℃ 5 s, 60℃ 20 s, 共45个循环; 95℃ 1 s, 65℃ 15 s, 95℃延续, 溶解曲线测定; 40℃ 30 s。利用2-ΔΔCT法计算基因的相对表达量。
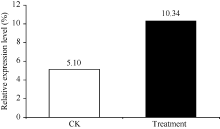
本课题组前期利用蛋白质双向电泳技术研究甘蔗幼苗响应黑穗病菌侵染时发现蛋白点8在接菌处理和对照样品中其相对表达量分别为10.34和5.10 (图1)。质谱鉴定分析(表1)发现, 其与牛奶子和野生稻的 S-腺苷甲硫氨酸合成酶匹配度最高, 蛋白得分和蛋白得分的统计学可靠程度显著高于质谱成功鉴定的阈值60和95%, 初步推断此差异蛋白为 S-腺苷甲硫氨酸合成酶(SAM)。
| 表1 质谱分析结果 Table 1 Mass spectrometry results |
以逆转录合成的cDNA为模板, 利用引物SAM-F和3'端进行PCR扩增, 获得一条约1.5 kb的目标条带(图2-A), 经胶回收纯化、连接转化后挑取阳性克隆测序表明, 该片段长度为1466 bp, 经Blast分析发现其与其他作物 S-腺苷甲硫氨酸合成酶基因的相似性为89%~94%, 命名为 ScSAM, 基因登录号为KC172558。序列分析发现其包含一个375 bp的3'端非编码区, 一个1191 bp的完整开放阅读框(图2-B), 编码396个氨基酸(图3)。
ScSAM gene'>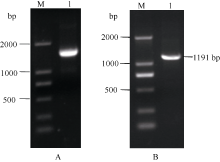 | 图2 ScSAM基因3'RACE (A)和编码框(B)的扩增产物M: DL2000 marker; 1: 目的片段。 M: DL2000 marker; 1: target fragment.Fig. 2 Amplified products of 3'RACE (A) and ORF (B) of ScSAM gene |
在线软件预测 ScSAM基因所编码的氨基酸序列
的等电点为5.40, 蛋白质分子量为43.07 kD; 使用频率较高的氨基酸有Gly、Val、Asp、Ala, 分别占总氨基酸的10.1%、8.6%、7.8%和7.6%, 频率较低的氨基酸有Sec、Trp、Met、Cys, 仅占0、1.0%、1.8%和1.8%; 以SOSUI Signal软件预测, SAM蛋白为可溶性蛋白, 不含信号肽; 二级结构预测结果显示α-螺旋占36.11%, 无规卷曲占40.66%, 延伸链占15.40%, β-转角占7.83%。疏水性最大值为1.73, 最小值为-2.10; 含有1个跨膜区域, 序列为VHT; 蛋白质功能结构域预测结果显示ScSAM包含3个SAMS的特征序列, 分别为GHPDK (17~21)、GAGDQGHMFGY (122~132)和GGGAFSGKD (269~ 277)(图3), 还含有1个酰胺化位点, 1个糖基化位点为, 6个肌酸激酶2磷酸化位点, 6个肉豆蔻基位点和6个蛋白激酶C磷酸化位点。
甘蔗ScSAM的氨基酸序列与其他作物SAM氨基酸序列多重比对分析(图4)发现, 它们之间有较高的同源性, 不同植物SAM存在高度保守序列, 但也有较明显组成变异。可见 S-腺苷甲硫氨酸合成酶在进化的过程中保持了足够的遗传稳定性和演化趋同性。
系统进化树分析(图5)显示甘蔗 S-腺苷甲硫氨酸合成酶与高粱的SAM聚在一起, 表明它们之间亲缘关系最近。另外杨树和桉树聚在一起, 草莓和拟南芥聚在一起。但不同植物间SAM也有很高的同源性。
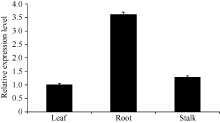
利用qRT-PCR技术分析 ScSAM在甘蔗幼苗中的表达情况表明, ScSAM在根、茎、叶中均有表达, 但表达量存在明显差异, 在根中表达量最高, 是叶片中相对表达量的3.6倍(图6)。
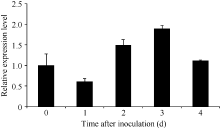
人工接种黑穗病病原菌后 ScSAM的表达总体表现为先下降后上升再下降的变化趋势(图7), 接种1 d后 ScSAM的相对表达量下降, 接种2 d后表达量迅速回升, 在接种3 d后基因的表达量达最高, 为对照的1.89倍, 但4 d后下降到正常水平。
在4种非生物胁迫条件下 ScSAM均被诱导表达, 但响应模式不尽相同(图8)。在4℃低温胁迫下 ScSAM的相对表达量随着胁迫时间的延长整体表现缓慢升高的模式, 48 h后表达量最高, 为对照的2.18倍。在PEG模拟的干旱胁迫下 ScSAM的表达变化不明显, 24 h后表达量最高, 为对照的1.23倍。在NaCl胁迫下 ScSAM表达量表现出先升高后下降再升高的变化特点, 2次高峰分别出现在胁迫12 h和72 h。在H2O2胁迫下 ScSAM的表达整体表现为下降, 12 h后表达量接近对照, 24 h时表达量最低, 仅为对照的0.2倍。
S-腺苷甲硫氨酸由Cantoni[ 17]于1952年首次发现, 是 S-腺苷甲硫氨酸代谢途径关键的中间产物。它参与40多种不同的代谢过程, 其中主要有合成多胺(精胺、亚精胺和腐胺等), 合成乙烯及合成谷胱甘肽[ 18]。这些物质在植物抵御逆境胁迫时起着重要的作用[ 19, 20]。 S-腺苷甲硫氨酸合成酶催化ATP与甲硫氨酸反应, 是目前可知的生成 S-腺苷甲硫氨酸的唯一途径[ 21], 因此研究 S-腺苷甲硫氨酸合成酶对作物抗逆尤为重要。
生物信息学分析发现ScSAM蛋白含有典型的SAM特征序列如ATP结合域、磷酸盐结合区和GHPDK甲硫氨酸结合域, 及一个控制基因催化效率的活性中心等等, 这些结构特点与已报道的无芒隐子草和向日葵的SAM相似[ 22, 23]。由此可见甘蔗ScSAM是典型的 S-腺苷甲硫氨酸合成酶, 是SAM蛋白质家族的一员。同源性分析发现甘蔗 ScSAM编码的氨基酸序列与其他物种 SAM基因编码的氨基酸序列同源性很高, 进化树分析结果表明 ScSAM与高粱 SAM亲缘关系最近, 但不同科属间的进化差异也不是很大, 推测SAM作为 S-腺苷甲硫氨酸代谢途径的重要中间产物 S-腺苷甲硫氨酸合成途径的关键酶, 在进化过程中保持了足够的演化趋同性和遗传稳定性。
组织特异性表达分析发现 ScSAM为组成型表达, 其相对表达量为根>茎>叶, 这与朱晶莹等[ 12]发现的玉米 S-腺苷甲硫氨酸合成酶基因的表达模式相同。前人研究还发现 SAM基因的组织特异性表达受发育时期[ 24]、环境因子[ 25]和植物激素[ 26]等的调节。
在甘蔗黑穗病病原菌胁迫下 Sc SAM的相对表达量整体呈上调表达, 在病菌侵染3 d后其相对表达量最高, 这与蛋白质双向电泳分析的结果吻合, 可见 ScSAM积极参与了甘蔗对黑穗病的响应过程。关于其在病原菌胁迫时的响应特性和机制的研究有待进一步探索, 但已有研究证实该基因受到真菌和细菌的激发子的诱导表达[ 7]。推测 ScSAM表达量的提高会促使其下游代谢产物多胺的积累, 多胺作为一类植物体内重要的次生代谢物质, 在提高植物抗逆性方面具有重要作用[ 5]。Hazarika等[ 27]也发现在转基因番茄中多胺的积累会提高其对尖孢镰刀菌和番茄早疫病的抗性。所以可以推测 ScSAM在甘蔗幼苗抵御黑穗病菌入侵的过程中发挥重要作用。
在4种非生物胁迫条件下, ScSAM的表达模式不尽相同。在4℃低温胁迫下甘蔗 ScSAM相对表达量总体呈升高趋势, 这与甘薯 S-腺苷甲硫氨酸合成酶在低温胁迫的表达特性是一致的[ 28]。在PEG模拟的干旱胁迫条件下甘蔗 ScSAM表达量变化不明显。这与陈锐等[ 29]和林凡云等[ 30]的研究结果不同, 推测是因为 SAM由一个家族基因编码的, 不同的 SAM行使的功能侧重不同。陈锐等[ 29]研究发现小麦 SAMS基因在水分胁迫早期上调表达, 当水分胁迫程度严重时表达受到抑制。林凡云等[ 30]发现糜子 SAMS基因在干旱早期(土壤含水量36%)明显上调表达, 而干旱程度更严重时(土壤含水量为24%)其表达受到严重抑制, 严重干旱后复水2 h, 其表达量增强至干旱早期的表达量, 而复水6 h后表达量降低至对照(干旱处理前)水平。在NaCl模拟的盐胁迫下 ScSAM表现“扬-抑-扬”的变化特点, 推测SAM在植物抵御高盐胁迫过程中发挥了重要作用。周凯等[ 31]研究发现陆地棉 SAMS的表达受盐胁迫的诱导, 不同敏感材料诱导响应的时间不同, 盐敏感材料中诱导延迟。李燕等[ 32]也发现在盐胁迫下, 盐地碱蓬的 S-腺苷甲硫氨酸合成酶基因的cDNA表达上调, 同时 S-腺苷甲硫氨酸合成酶的活性也增加。番茄中 SAM1和 SAM3的mRNA表达水平在盐处理8 h后增加, 并且长时间持续较高水平。较多的 S-腺苷甲硫氨酸可促使植物根部细胞壁的合成及修复, 还可增加细胞间水分的运输。这些改变使得植物根部的选择性更强, 可减少木质部对离子的吸收, 也能够补偿质外体运输过程中水分和有机溶质的流失[ 33]。在H2O2模拟的氧化胁迫下甘蔗体内 ScSAM表达量整体表现下降, 具体原因尚不清楚, 需要进一步验证分析。
克隆获得甘蔗 ScSAM基因全长, GenBank登录号为KC172558。它包含ATP结合域(GAGDQGHMF GY)、磷酸盐结合区(GGGAFSGKD)和甲硫氨酸结合域(GHPDK) 3个 S-腺苷甲硫氨酸合成酶的特征序列。甘蔗ScSAM与高粱SAM的关系最近; ScSAM在甘蔗根、茎和叶中均有表达, 在根中的表达量最高。其表达受黑穗病病原菌胁迫和低温(4℃)、聚乙二醇(PEG)、NaCl非生物胁迫的诱导但被H2O2胁迫所抑制, 推测它参与甘蔗应答黑穗病过程且也在甘蔗抵抗低温、高盐、干旱和氧化胁迫的机制中发挥作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|