第一作者联系方式: E-mail:jiuxinguo@sina.com
F-box是Skp1-Cullin1-F-box (SCF)型泛素连接酶E3的重要组成部分, 在泛素化介导的蛋白质降解中选择性识别靶蛋白。本文从谷子苗期干旱胁迫条件下构建的转录组文库中克隆了与耐旱早期响应相关的F-box基因, 命名为
F-box proteins, components of the Skp1-Cullin1-F-box (SCF) protein E3 ubiquitin ligase complex, serve as the variable component responsible for substrate recognition and recruitment in SCF-mediated proteolysis. The anti-drought relative gene of
研究表明, 泛素化蛋白连接酶E3对植物生长发育和逆境胁迫响应等过程中的关键步骤具有重要的调控作用[ 1], Skp1-Cullin1-F-box (SCF)型蛋白复合物是E3中研究最深入的一类。F-box蛋白也是真核细胞中一大类蛋白质家族, 包含了一个35~60个氨基酸组成的F-box结构域, 在SCF型E3介导的蛋白降解中, 起着靶蛋白识别和稳定SCF复合物的作用。F-box蛋白结构域的N-端部分与SKP结合, 通过其C-端部分与靶蛋白结合发挥作用。在F-box蛋白结构域的下游, 常常伴随一些重要的次级元件, 如LRR (leucine-rich repeat)、WD repeat、亮氨酸拉链结构等[ 2]。
Shinozaki等[ 3]首先在拟南芥基因组序列中发现了近700个编码F-box蛋白的基因, 占基因组编码总蛋白的3%左右。Jain等[ 4]也在水稻基因组中发现了687个F-box蛋白, 根据F-box蛋白C端的不同将其分为10大类亚家族。对功能已知的F-box蛋白深入研究表明, F-box蛋白几乎参与所有的植物生长发育、细胞分裂及植物激素的响应调控过程[ 5], 如 LKP、 ZTL、 FKF参与开花和对光周期的调控[ 6, 7]; EID1参与光形态的建成[ 8]; UFO影响植物花的发育[ 9, 10, 11, 12]; ORE1和 MAX2调控叶片衰老和后期树冠的分支数[ 13]。目前, 通过大规模测序和生物信息学等手段已经预测了大量的F-box蛋白, 除少部分蛋白功能得到验证外, 更多的F-box蛋白还处于功能未知状态, 这些蛋白在干旱胁迫中的作用则知之更少。
谷子( Setaria italic L.)是我国北方古老的谷类作物之一, 具有突出的耐旱性及水分利用效率。谷子具有基因组小(约500 Mb)、自交结实率高、具C4合成途径、与目前主要粮食作物、饲料作物及能源作物亲缘关系较密切等特点, 已经逐步成为基因组学研究的理想的模式作物[ 14]。由于谷子的良好耐旱性, 农艺性状改良方面表现出广阔的研究潜力。利用分子生物学技术, 已经从谷子中发现大量与耐旱相关的基因。目前, 国内学者已经在谷子中克隆到的基因有DnaJ蛋白基因( SiDnaJ)[ 15]、干旱应答元件结合蛋白基因( SiDREB)[ 16]、12-氧代植二烯酸还原酶基因( SiOPR1)[ 17]、3-磷酸甘油醛脱氢酶基因( GAPDH)[ 18]、磷脂酶D基因( SiPLDa1)[ 19]、 CBL家族[ 20]、 PP2C家族[ 14]和 ABF3[ 21]等。但与已知的拟南芥逆境相关的基因(8000个)和水稻干旱应激诱导基因(约5000个)数目相比, 在抗旱性极强的谷子中发现和鉴定的与干旱相关的基因屈指可数。因此, 继续加大谷子抗旱性研究, 发掘谷子抗旱基因, 深入了解谷子抗旱机制尤为重要。
本研究以干旱胁迫处理下的谷子幼苗为材料, 构建了耐旱相关转录组数据库, 克隆得到一个可能参与快速响应干旱胁迫的F-box基因, 命名为 SiFBX。利用生物信息学手段对该基因及其上游启动子序列进行分析, 并通过实时定量PCR初步验证其在干旱胁迫及ABA激素胁迫下的表达调控。该基因的发现, 为研究干旱胁迫下谷子转录后翻译水平的耐性机制提供了基础。
晋谷34由山西农业科学院作物遗传研究所提供。将种子播于苗床(草炭土、珍珠岩和蛭石的质量比为1∶1∶1)上, 在湿度为70%、温度22℃条件下培养。生长20 d后(三至四叶期), 取长势大小一致的幼苗分别进行模拟干旱(幼苗置于含有20% PEG的1/2 Hoagland营养液中, pH 7.0)、正常干旱(断水处理)和喷施ABA (100 μmol L-1)胁迫处理。分别在PEG和ABA胁迫处理后0.5、1.0、2.0、4.0和8.0 h取样, 正常干旱处理为断水后每天9∶00取样, 分别断水1、2、3、4、5和6 d, 每处理每次取10株, 3次重复。样品于液氮速冻, -80℃保存备用。
从注释的干旱诱导的谷子转录组数据库中, 筛选出F-box基因片段, 使用Trinity (release-20130225)进行序列的组装(默认参数), 利用DNAMAN软件(http://www.lynnon.com/)进行ORF搜索(ORF>50), 得到F-box基因编码序列。根据此序列, 设计并合成引物 Si FBX-FM和 SiFBX-RM (表1)。取正常干旱(断水)处理3 d的样品, 用RNAiso Plus (TaKaRa)分离mRNA, 使用PrimeScript First Strand cDNA Synthesis Kit (TaKaRa)反转录合成cDNA。利用 SiFBX-FM和 SiFBX-RM引物进行PCR扩增该基因编码区全长片段, 回收PCR产物, 连接到pMD-18T Simple载体(TaKaRa), 转化大肠杆菌(DH5α), 挑取阳性克隆, 经质粒酶切验证正确后测序。
| 表1 SiFBX基因克隆及Real-time PCR分析所需引物 Table 1 Primers used in SiFBX genes cloning and real-time PCR analysis |
用ProParam (http://espasy.org/tools/protparam.html) 分析 SiFBX蛋白的物理和化学性质。用Predict Protein (http://www.Predictprotein.org/)和ProScale (http://expasy.org/tools/protscale.html)预测 SiFBX蛋白质的二级结构及疏水区域。利用TMpred (http://www.ch.embnet.org/software/TMPRED_form.html)和TMHMM (http://www.cbs.dtu.dk/services/TMHMM)分析 SiFBX的蛋白跨膜结构域。通过PROSITE (http://www.expasy.ch/Prosite)预测该蛋白质的结构域和功能位点。利用CCD数据库和PFAM数据库分析该蛋白的保守结构域和家族, 确定该基因所属的蛋白家族[ 22]。利用ClastalX (默认参数)进行多重序列比对, 使用MEGA (重复次数1000)构建N-J系统进化树。使用在线预测工具PlantCARE[ 23] (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测 SiFBX的启动子结构。
根据获得的 SiFBX基因序列, 设计并合成 Real-time PCR引物 SiFBX-RT-F和 SiFBX-RT-R。以 Actin基因作为内参, 设计引物SiActin-F和SiActin-R (表1)。
利用RNAiso试剂盒(TaKaRa, 辽宁大连)分别提取1.1中材料的总RNA, 分别以总RNA作为模板, 使用PrimerScript RT Master Mix (Perfect Real-time)试剂盒(TaKaRa, 大连)反转录合成cDNA。总RNA 200 ng左右加入5×PrimerScript RT Master Mix (for Real-time) 2 μL, RNase Free dH2O补充至10 μL。于PCR仪(TaKaRa)设定37℃ 15 min; 85℃ 5 s; 4℃合成cDNA。使用One Step SYBR PrimerScript RT-PCR Kit (Perfect Real Time)试剂盒(TaKaRa, 辽宁大连)进行PCR, 反应体系包括2×SYBR Premix Ex Taq II (含荧光染料) 12.5 μL、10 μmol L-1引物各1 μL、ddH2O 8.5 μL和cDNA模板2 μL。以谷子 Actin基因作为内参基因, 采用两步法进行实时荧光定量PCR扩增(ABI7300, Applied Biosystems)。反应条件为95℃ 30 s; 95℃ 5 s, 61℃ 31 s (搜集信号), 40个循环。使用SDS软件分析实时定量PCR结果。
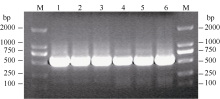
利用生物信息学方法和PCR技术克隆得到一个与耐旱相关的F-box基因(图1)。分析结果表明, 在其编码的蛋白氨基酸序列中, 第72、第73、第80和第96位的氨基酸分别为亮氨酸(L)、脯氨酸(P)、缬氨酸(V)和丝氨酸(S), 具有F-box家族蛋白的基本特征[ 24], 因此命名为 SiFBX, 并将该序列提交到GenBank (登录号为KC252635.1)。
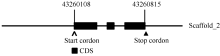
将序列与谷子基因组数据库(http://www.phyto-zome.net/)比对, 发现该基因位于谷子Scaffold_2区段的43 260 108~43 260 815位点。使用DNAMAN对该区域的序列进行预测分析, 发现编码 SiFBX的片段是由2个内含子和3个外显子组成(图2)。
SiFBX蛋白由170个氨基酸组成, 分子量为18.6 kD, 等电点p I为10.90 (图3)。在170个氨基酸残基中, 精氨酸(R, 10.0%), 亮氨酸(L, 11.2%), 丝氨酸(S, 12.9%)所占比例达到了34.1%。
二级结构预测发现, 在 SiFBX蛋白N端含有由48个氨基酸构成的螺旋结构, 在C端含有由12个氨基酸组成的螺旋结构。用ProScale进行疏水性分析显示, 该蛋白含有6个疏水区, 分别位于氨基酸序列的15~17、66~69、76~82、92~96、104~105和155~161区域内, 尤其在66~105处, 疏水区域较为集中, 可能为 SiFBX的作用位点。利用PROSITE进行 SiFBX蛋白质结构域、家族和功能位点分析发现, SiFBX含有一个F-box结构域(66~144)(图4-C)。在已知的SCF型E3复合物中, F-box蛋白结构域的N-端和C-端分别结合SKP蛋白和下游蛋白, 据此预测, 其中2个可能的结合位点, 一个为F-box蛋白与SKP结合部位(实线显示区域), 另一个为F-box蛋白与靶蛋白结合部位(虚线显示区域)(图3)。
利用TMpred和TMHMM对 SiFBX蛋白质进行跨膜结构分析, 结果均未发现跨膜结构, 表明 SiFBX可能不是一个跨膜蛋白。通过Signal IP预测, 未能够找到信号肽结构, 说明该蛋白在细胞中不是分泌蛋白, 可能位于细胞质基质或者细胞核基质中。
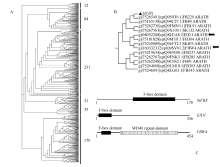
首先利用CCD数据库的CD-search工具, 确定该基因属于 pfam00646基因家族。其次利用NCBI搜索, 得到34 777条相关基因, 其中植物来源共 15 196条。然后结合UniportKB及Swiss-port数据库筛选得到563条非冗余序列。用MEGA4.0软件进行多重序列比对以及构建N-J系统进化树, 563条非冗余序列被分为6大类。 SiFBX与已报道的 EID1 (empfindlicher im dunkelroten Licht 1)和 FBW4 (F-box containing WD40 repeat-domain protein 4)等基因分为同一大类, 该大类共12条蛋白序列(图4-A)。在此大类中, SiFBX与FB220、FB84、FBL91以及SKI32相似度较高(图4-B), 进一步分析 SiFBX、 EID1和 FBW4的保守结构域发现, EID1可能含有一个未知的次级结构域, FBW4含有一个WD40-repeats次级结构域, 而 SiFBX下游没有发现次级结构域(图4-C), 说明 SiFBX是一个新发现的F-box基因。
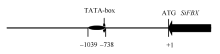
从 SiFBX基因的ATG开始, 截取 S iFBX基因5° 区域上游1925 bp的核苷酸序列, 使用PlantCARE在线预测 SiFBX的结构(图5)。
在ATG上游759 bp处发现TATA-box区域, 转录起始位点位于上游739 bp处, 在上游738 bp至上游1039 bp区域预测到多种逆境胁迫相关的顺式作用元件(表2), 包括与光、温度、激素、厌氧、干旱、细胞周期响应及组织特异性响应元件等。
| 表2 Si FBX基因上游调控区胁迫相关的启动子元件 Table 2 Stress-regulated element in upstream regions of SiFBX gene |
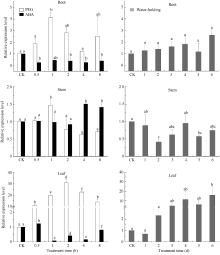
在用20% PEG胁迫处理谷子幼苗后, SiFBX在谷子叶片呈现显著上调表达的趋势, 在2.0 h表达量达到最大, 为对照组的30.9倍。根部和茎部均在1.0 h达到最大, 分别为对照组的4.1倍和1.5倍。当用100 μmol L-1ABA处理后, SiFBX基因在0.5 h叶片中的表达量达到最大, 为对照组的1.2倍, 在1 h表达量最低, 仅为对照组的0.07倍, 随后开始出现上升趋势。茎部在4 h和8 h显著上调表达, 分别为对照组的1.5倍和1.4倍。根部在各个时间点的表达量显著低于对照组, 一直处于抑制状态。在正常干旱处理下, SiFBX基因在第2天和第5天的茎中表达显著下调, 分别为对照组的0.41倍和0.57倍, 而在第6天的叶片中则显著上调表达, 根中没有明显变化(图6)。
F-box蛋白在植物的生长发育和激素响应中具有重要作用[ 5]。我们从谷子中克隆了一个快速响应干旱的F-box基因, 命名为 SiFBX。通过对所有植物F-box家族的分析发现该基因与目前报道的 EID1以及 FBW4同源关系接近。EID1是一个光敏色素A依赖的HIR-信号通路的负调控元件, 参与植物光形态的建成, 具有核定位信号肽[ 25], 能够特异地与 ASK ( Arabidopsis Skp1-like proteins)和 Cullin1相互作用形成稳定的二聚体和三聚体[ 8]。 EDL3 ( EID1-like protein 3)是与 E ID1高度相似的F-box家族蛋白, 在拟南芥中参与依赖ABA的种子萌发、根系生长、黄化苗绿化以及开花等过程的调控, 同时也参与响应温度、干旱、渗透以及盐胁迫[ 26]。 FBW4是一个编码WD40结构域的F-box蛋白, 在氧化胁迫诱导的细胞凋亡途径中, 尽管与 RCAN1相互作用, 但也能够独立应对H2O2刺激[ 27]。本研究中, SiFBX与 EID1和 FBW4被聚为一类, 说明 SiFBX可能具有与 EID1和 FBW4相似的功能。对比 SiFBX、 EID1和 FBW4的结构域发现, SiFBX不仅缺少占据了EID1和FBW4蛋白很大比重的次级结构域, 而且还缺少 EID1和 FBW4所特有的核定位信号肽。在SiFBX蛋白的C端, 仅有一个由12个氨基酸组成的小型双螺旋结
柱上小写字母不同表示在0.05的水平上差异显著。
Bars superscripted by different letters are significantly different at the 0.05 probability level.
构, 说明SiFBX在结合下游靶蛋白时, 蛋白复合物的结合程度可能不如EID1和FBW4稳定。由于缺少可能的细胞定位和跨膜结构域, SiFBX在细胞质中处于游离状态, 加之 SiFBX含有较高比例的精氨酸、亮氨酸和丝氨酸组成, 很容易被丝氨酸/苏氨酸蛋白激酶激活, 参与信号的转导途径。以上原因或许导致SiFBX对于干旱、渗透以及ABA激素胁迫的快速而强烈的响应。
本研究中, 实时定量结果也显示了 SiFBX对干
旱、渗透和ABA胁迫的响应, 与 EDL3的功能比较类似。叶片和根部是ABA的主要合成器官, ABA在叶绿体及其他质体中合成后, 双向运输, 叶片合成的ABA沿着韧皮部向根部运输, 运输速度慢, 而根部合成的ABA沿着导管向叶片运输, 运输速度快。受到胁迫时, ABA会在植物体叶片中迅速积累, 参与对逆境的响应。研究表明, EDL3甚至能够响应轻微胁迫, 低浓度ABA (5 μmol L-1)处理下, 90 min转录水平就能增加4倍, 高浓度的ABA处理反而会抑制 EDL3的转录[ 25]。与该结果相比较, 我们推测 SiFBX可能参与ABA信号分子的转导, ABA的浓度影响 SiFBX的表达。正常干旱处理下, 随胁迫程度逐渐加剧, 叶片中积累的ABA含量在不断增加, 增强了 SiFBX基因的表达, 因此在叶片中的表达量呈现上调趋势。在PEG的处理下, 胁迫程度剧烈而突然, 叶片合成的ABA快速增加, SiFBX的表达量也快速增加, 当ABA的浓度积累到一定程度时, 抑制了 SiFBX信号的转导, 表达量开始呈下降趋势(图6)。而当用100 μmol L-1 ABA处理叶片时, 高浓度的ABA迅速抑制 SiFBX在根和叶中的表达。随着ABA途径的信号分子的降解, SiFBX受到的抑制作用开始缓慢解除, SiFBX在根、茎和叶中表达量呈现上升趋势(图6)。
在 SiFBX的启动子区域发现6类分别与光、温度、激素、厌氧、干旱、细胞周期响应及组织特异性响应相关的顺式作用元件, 推测 SiFBX可能通过这些元件对外界逆境做出应答。 MYB15与 MYB84参与了 SiFBX基因的转录, 过量表达 MYB15基因可以增强拟南芥对于ABA和干旱的耐性[ 28], 而 MYB84基因被报道具有增强水稻抵抗盐害的作用[ 29], 说明 SiFBX在应对逆境胁迫中发挥潜在作用。转录组数据表明干旱胁迫条件下, 谷子中 SiFBX的表达量大幅度上升(结果未列出), 说明干旱应答相关顺式作用元件可能与信号分子结合, 激活该基因的转录。荧光定量PCR结果显示, 干旱和PEG诱导条件下该基因在谷子叶片中表达量显著上调(图6), 这可能与启动子区域的干旱应答顺式作用元件有关。我们推论 SiFBX启动子区域多种逆境应答相关作用元件可能调控该基因在不同逆境条件下的表达。 SiFBX启动子区域中存在ABA、乙烯、茉莉酸应答相关顺式作用元件, 表明该基因参与了信号相关转导途径。进一步表明该基因表达产物SiFBX蛋白是通过上游激素相关顺式作用元件响应激素信号, 而激素信号转导途径与植物的耐逆性相关[ 30, 31]。
从谷子幼苗中克隆获得 SiFBX基因, 编码一个F-box蛋白, 通过启动子区域的逆境及激素应答相关顺式作用元件调控其转录水平, 实现对干旱逆境的响应。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|