第一作者联系方式: E-mail:sylbl1986@163.com
为拓展小麦化控两系途径的药剂种类, 降低化学杂交剂(CHA)成本, 利用西农1376检验15种化学药剂、4个浓度、3个施用时期(小麦不同发育时期)的诱导不育效果, 并对花药败育的机制进行了研究。结果表明, 各处理诱导小麦花粉败育效果差异较大, Feekes 7.5和9.5时期, 15种药剂各浓度处理诱导植株营养生长发育异常或花粉败育不明显; Feekes 8.5时期, T6-CHA药剂0.24 kg hm-2诱导雄性不育率为93.33%, 植株表型及雌蕊发育正常, 对其饱和授粉, 能获得杂交种子, 且饱和授粉结实率较高。石蜡切片观察该处理诱导雄性不育花药的绒毡层细胞降解过程异常, 自单核早期绒毡层细胞核明显降解, 单核中后期花粉内核也开始降解, 直至三核期, 绒毡层细胞及花粉内核及营养物质基本消失, 仅剩少量花粉壁残留, 最终导致花粉败育。因此认为, T6-CHA诱导的小麦生理型雄性不育与绒毡层的异常降解直接相关。
To expand varieties of chemical hybridization agent and reduce their cost, We selected 15 varieties of chemical hybridization agent for treating wheat cultivar Xi’nong 1376 at three growth stages with four concentrations to survey the infertile effect, phytotoxicity and pollen abortion mechanism. The results showed that there were significant differences among the chemical hybridization agent treatments. At stages Feekes 7.5 and Feekes 9.5, abnormal vegetative growth or pollens abortion were not obvious. While at the stage of Feekes 8.5, the rate of male sterility of Xinong 1376 was 93.33% in 0.24 kg ha-1 T6 treatment, and the pistil and the plant showed normal development, we also achieved a high seed setting rate via crossing the male sterile plants with normal fertile lines by saturate pollination. Paraffin sections indicated that the degradable process of tapetum cells in the male sterile anther treated by T6-CHA was abnormal. The nucleus of tapetum cells degraded at uninucleate early stage, and then pollen nucleus degraded at uninucleate late stage. Tapetum cells, nucleus of pollen and nutrients were almost disappeared till trinucleate stage. Finally, a little residue of pollen wall left and pollen aborted. Therefore, we hypothesize that the male sterility induced by T6-CHA could be related to the degradation of tapetum cells in anther.
化学杂交剂(chemical hybridizing agent, CHA)是基于雌雄蕊生长发育过程中对化学药剂的耐受力不同, 而对雄配子选择性杀伤或阻滞其发育, 造成花粉生理型不育的一类化学物质, CHA对雌蕊活性无不良影响或影响很小。近年来, 应用化学杂交剂诱导小麦雄性不育来配制强优势组合已在我国取得较大进展, 成为利用小麦杂种优势的一条重要途径[ 1]。化学杂交剂诱导雄性不育在生产制种过程中克服了现有遗传型雄性不育对不育基因的依赖, 扩大了杂种优势的利用范围, 减少了不育基因转育的繁琐程序, 使选配组合程序灵活、稳定, 增加了强优势组合的筛选几率。
20世纪50年代初, 自Moore首先在玉米上应用马来酰阱(MH)诱导雄性不育后[ 2], 60多年来陆续研制和筛选了大量化学杂交剂, 但各种化学杂交剂均存在自身的缺点。80年代, RH0007 (商品名Hybrex)用于商业化生产, 但其存在制种种子干瘪、生活力降低等问题, 未能大面积推广[ 3]。此后, 美国筛选了新型小麦化学杂交剂WL84811, 具有去雄率高、对植物安全、施药时间较长等优点, 曾被认为是在小麦、水稻上极有希望的化学杂交剂, 但后来发现有残毒问题, 亦不能广泛应用[ 4]; 天津市农业科学院在1988年引进筛选了化学杂交剂SC2053, 初试结果比较理想, 但随研究深入, 发现其对小麦后生分蘖的杀雄效果不好[ 5]; Genesis于1996年被引进我国, 其诱导小麦雄性不育彻底, 且对小麦生长发育无不良副效应, 但存在对倒二叶有灼伤和对某些品种反应敏感的现象, 在杀雄的同时, 随剂量增大有损伤柱头的副作用, 同时生产成本较高[ 6]; 张改生等在国内开发出新型小麦化学杂交剂SQ-1, 经大量实践证明是国内目前比较优良的一种小麦化学杂交剂。SQ-1具有高效、稳定和广谱等特点, 其诱导不育率可达到95%~100%, 饱和授粉结实率可达85%以上, 但该化学杂交剂的成本较高, 导致制种成本增加[ 7, 8], 不利于杂交种的大面积推广。
上述不同类型的化学杂交剂均存在着各自的缺点, 限制了其广泛应用, 最终直接影响到化控两系杂交小麦的大面积制种。因此, 筛选价廉质优的化学杂交剂仍是目前扩大化控两系杂交小麦制种面积的关键。本研究在多年化控两系杂交小麦研究与利用的基础上, 又基于一些除草剂的活性成分及其衍生物对诸如油菜等作物具很好诱导雄性不育的作用, 旨在进一步筛选廉价、无毒、优良的化杀剂, 并将其应用于小麦雄性不育的诱导, 试图大幅度降低制种成本, 进而将化控两系杂交小麦推向更大面积生产。
供试小麦品种为西农1376, 由西北农林科技大学作物杂种优势研究与利用重点实验室提供。2010—2012连续3年的10月, 将西农1376种植于西北农林科技大学试验农场, 小区面积2 m × 1 m = 2 m2, 4行区, 行距25 cm, 管理同大田。
11种供试药剂(由西北农林科技大学作物杂种优势研究与利用重点实验室及杨凌秦丰农业公司提供)配制成15种处理剂型, 其代码为T1~T15, 其中T12为T5和T6的1∶1混合物, T13为T6和T7的1∶1混合物, T14为T7和T8的1∶1混合物, T15为T8和T9的1∶1混合物。
4月初, 依据使用已有化学杂交剂SQ-1杀雄敏感发育期喷施杀雄的经验, 待西农1376发育到Feekes 7.5 (S1)、8.5 (S2, 旗叶伸出倒二叶鞘的一半)和9.5 (S3)时, 喷施不同剂量的化学杂交剂。2011年4月使用7种浓度, 但0.048、0.0096和0.0048 kg hm-2 3个浓度处理后几乎不能诱导雄性不育, 因此以后2年试验只用4种浓度, 分别是4.8 (C1)、0.48 (C2)、0.24 (C3)和0.096 kg hm-2 (C4); 以喷施清水为对照。
取即将散粉的小麦(整)穗10个, 放入冰盒, 快速带回实验室, 分别用1% KI-I2和1.5%醋酸洋红对花粉粒染色, 观察淀粉粒的积累, 镜检花粉粒活性。取样时形态指标以对照(未用CHA处理)作为参照[ 9]。
待小麦抽穗后未散粉前, 于各小区内分别对20株的主茎穗套袋, 成熟后统计结实率, 计算不育率。平均不育率 = (1-处理套袋穗平均结实粒数/未处理套袋穗平均结实粒数)×100%[ 10]。药剂诱导后, 调查上述20个套袋的穗型和穗长, 并测定该套袋株的株高。
取药剂诱导不育性彻底植株的三核期穗, 用体视显微镜观察雌蕊活性, 并对不育性彻底的5株小麦进行饱和授粉, 分析植株饱和授粉结实率, 最终鉴定药剂处理条件下的雌蕊活力。平均授粉结实率 = (平均授粉小花结实数/平均授粉小花数) × 100%。
采用DPS统计软件, 对15种药剂在4种浓度条件下不育率3年重复数据先进行反正弦转换, 然后进行差异显著性分析。
各时期材料经FAA固定液固定1~3 d后, 转入70%酒精4℃保存。采用常规石蜡制片技术, 切片厚度12 μm, 番红-固绿染色, 于光学显微镜(Nikon ECLIPSE E600)下观察、采集图像[ 11]。
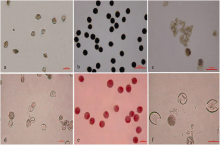
经KI-I2染色, 未用药剂处理的对照花粉粒呈深蓝色(图1-b), 而T8-C2 (图1-a)和T6-C3 (图1-c)处理的花粉粒呈浅黄色, 同时T6-C3处理的花药花粉量极少或无花粉, 其余药剂处理的花粉粒呈现深蓝或表现雌雄均不育。通过比较图1-a、b、c可知, Feekes 8.5时, T8-C2和T6-C3处理均可诱导植株完全雄性不育, 其花粉粒均呈浅黄色, 表现为败育, 而正常花粉粒呈蓝黑色, 具有活性。T6-C3处理, 在即将散粉时花药形态表现为干瘪、失水, 与正常花药相比出现早衰(图2-a), 而对照植株花药表现为饱满, 体积较大, 含水量高, 色泽鲜, 花粉丰富(图2-b)。用1.5%醋酸洋红分别对西农1376未药剂处理以及 T8-C2和T6-C3处理的植株花粉粒染色, 镜检发现对照的花粉粒形状规则, 圆形, 精核发育呈鱼状, 表现为正常可育(图1-e); 而T8-C2和T6-C3处理的花粉粒形状不规则、畸形、部分细胞破裂, 核几乎成透明解体状, 整个花粉粒呈多边结晶状, 明显败育(图1-d和图1-f)。三核散粉期, 田间形态调查表明, T8-C2诱导的不育群体穗部颖壳张开度较低, 几乎呈闭颖状态, 很难接受外来花粉, 而T6-C3 (图2-a)诱导的不育群体穗部颖壳张开度增大, 呈蓬松状, 易于接受外来花粉。在小麦灌浆后期, 田间剥去小麦颖壳看到, T6-C3 (图2-c)处理为空壳而对照(图2-c)结实饱满。说明T6完全可以在合适的药剂浓度和适宜植株发育时期彻底诱导小麦西农1376花粉粒完全败育, 且雌蕊发育正常。
待西农1376发育到Feekes 7.5、Feekes 8.5和Feekes 9.5时, 分别喷施不同浓度的化学药剂, 抽穗期以后调查植株表型。Feekes 8.5时期, 雄蕊对同种药物同浓度处理最敏感; Feekes 7.5时期, 个别浓度的药剂诱导小麦抽穗困难, 出现“卡脖”现象, 普遍表现植株矮化、发育困难; Feekes 9.5时期, 小麦的耐药性增强, 个别药剂特定浓度下可诱导不育, 但败育不彻底。可能不同发育时期的小麦对杂交剂敏感程度不同, 有待深入研究。本试验最终确定的最佳喷施时期为Feekes 8.5。
对Feekes 8.5各处理植株的外部形态和育性调查列于表1。可见, 药剂浓度对穗长、株高等有很大影响, C1和C2高浓度条件下, 部分处理穗短小, 株型矮化, 甚至夭折。随施药浓度的降低, T6、T8、T12、T14和T15在C2浓度条件下完全可诱导植株雄性不育, 但T12、T14和T15 处理在诱导不育的同时也会诱发穗畸形, 植株发育延缓, 抽穗困难等现象, 表明这几种化学药剂在相应浓度条件下诱导雄性不育效果较差。T8-C2处理虽表现花粉败育, 但植株矮化, 颖壳开张度小, 不易接受外来花粉, 可能与喷药时小麦发育时期与处理药物种类、浓度的互作相关。T6-C3处理抽穗正常, 株高、穗型等不受影响, 且能获得不育群体(图2-c), 同时不育穗颖壳呈蓬松状, 开张度较大, 易于接受外来花粉, 天然异交率高。另外还发现, 多数药剂处理的植株均能正常生长, 穗型、抽穗及育性等不受影响, 但T6-C3和T6-C4处理(浓度分别为0.24 kg hm-2和0.0096 kg hm-2)除外。
综上分析, 西农1376植株在4.80 kg hm-2浓度药剂处理下会产生药害, 导致死亡或不抽穗; 0.48 kg hm-2浓度时T12、T14和T15药剂严重影响抽穗, 导致穗畸形, 即使该浓度药剂处理条件下小麦败育, 也不宜应用于生产; 0.24 kg hm-2浓度条件下部分药剂可诱导植株雄性不育(如T6), 且不育率较高。T6与T8相比, 小麦穗型受影响小, 且不育性相对彻底。
T1、T2、T3、T4、T5、T9、T10和T11药剂在较小剂量条件下, 处理株型及花粉育性均表现正常, 与对照差
异不显著; 但高药剂浓度处理出现整株致死现象。T7在不同浓度下均出现抽穗困难, 长期保持营养生长, 不进入生殖生长, 不拔节与抽穗; 4.80 kg hm-2浓度下, T6、T8、T12、T13、T14和T15处理后西农1376植株均显现药害, 抽穗率低、植株畸形或死亡。T6和T8对西农1376诱导不育的有效浓度为0.24~0.48 kg hm-2, 以0.24 kg hm-2杀雄效果最佳, 不育率达93.33%以上, 部分单穗不育率达100%, 且抽穗及穗型不受影响。0.48 kg hm-2浓度的T12、T13、T14和T15均可诱导100%不育, 与对照有极显著差异, 但株型所受影响较大, 表现为严重矮化、穗短, 影响植株正常生长发育。在0.24 kg hm-2和0.096 kg hm-2的低浓度条件下, T12、T13、T14和T15诱导不育率低, 结实率较高, 但有少数单穗的不育率高。
理想的化学杂交剂除了能诱导彻底的雄性不育外, 还要有较高的人工饱和授粉结实率, 才能说明其诱导后雌蕊发育正常。观察T6-C3处理植株雌蕊, 发现散粉期柱头发育基本正常(除药剂喷施不匀而引起的雌蕊死亡), 但与对照植株雌蕊相比, 柱头短小, 子房膨大(图3-a)。对T6-C3诱导杀雄后的植株进行饱和授粉, 能获得杂交种子(图3-b), 结实率为83.33%。
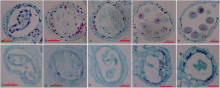
不同的发育时期, 对照和化学药剂处理后不育花药的绒毡层降解速率存在明显的差异[ 12, 13]。四分体时期(图4-a), 绒毡层细胞体积相对其他发育时期明显较大, 近长方形, 细胞质浓厚, 染色较深; 不育花药绒毡层细胞质浓度较低, 染色较浅, 呈不规则状(图4-f)。单核早期, 正常花药小孢子自四分体胼胝质壁中释放后, 体积逐渐增大, 并进一步形成花粉内、外壁和一个萌发孔, 此时, 绒毡层细胞开始转向退化, 正对萌发孔的位置退化严重, 开始呈现不规则的形状(图4-b)。不育花药较对照绒毡层细胞核开始明显降解, 但花粉粒外形发育基本正常(图4-g); 单核后期, 正常花药细胞质液泡化程度增强, 逐渐形成中央大液泡而将细胞核推向一侧, 到花粉粒单核靠边期, 绒毡层退化程度进一步加剧, 可以看到部分未退化完全的绒毡层(图4-c)。不育花药绒毡层细胞质及核基本退化完全, 但仍有残余绒毡层细胞壁, 同时花粉粒核也基本开始退化并伴随着花粉畸形发育(图4-h); 发育至二核期和三核期, 正常花药(图4-d, e)绒毡层退化完全, 仅留表皮和一层细胞壁带状不均匀加厚的药室内壁(纤维层), 但花粉粒发育正常, 精核呈鱼状。不育花药(图4-i, j)除绒毡层完全退化外, 花粉粒(二核期)基本完全破裂, 不具有规则的外形, 内容物持续降解至绒毡层(三核期)和花粉核完全降解, 仅剩花粉粒外壁。结果表明, 处理后不育花药的绒毡层较对照细胞内含物少, 且营养物质不足, 在小孢子发育过程中不能及时足量地提供营养, 导致花粉粒发生自溶败育。
理想的化学杂交剂是在特定时期用于受体作物, 诱导其雄性不育且无其他明显副作用的化学物质。在作物生殖生长时期施用CHA, 药剂能有选择地针对花粉粒, 诱导其生理性败育, 但不影响雌蕊柱头的发育, 且无其他不良影响或影响很小, 从而抑制其自花授粉结实, 促进其异花授粉, 获得杂交种子。相对于遗传型雄性不育, 化学杀雄诱导的生理型雄性不育过程更简单, 操作更简便, 亲本选配也更灵活, 而且还能免去培育保持系和恢复系的繁琐过程。
T6是除草剂Roundup的活性成分, 其作用机制是阻碍芳香氨基酸的生物合成, 即苯丙氨酸、色氨酸及酪氨酸通过莽草酸途径的合成[ 14], 对5-烯醇丙酮酰莽草酸-3-磷酸合酶(EPSP合酶)有抑制作用。该酶可以催化莽草酸-3-磷酸和烯醇丙酮磷酸向5-烯醇丙酮酰莽草酸-3-磷酸(EPSP)的转化, 因此T6干扰这一生物合成的酶促反应, 导致莽草酸在生物体内的积累。我们将T6应用于小麦雄性不育诱导, 尚属首次报道。从试验结果看, T6能够诱导小麦雄性不育, 其败育类型属绒毡层及花粉发育状况异常, 败育机制很可能是能量合成途径受阻, 表现为不育的绒毡层较对照可育的细胞内含物少, 且能量物质不足, 在小孢子发育过程中不能及时足量提供能量, 进而导致花粉粒在二核至三核期发生自溶败育, 仅残留部分细胞壁。T6诱导小麦雄性不育的机制及表现形式与CHA品种Genesis[ 15]、BAU-2[ 16]和SC2053[ 17, 18]较为相似, 但与乙烯利诱导的不育系相比, 败育发生早, 也更彻底。在小麦发育的适宜时期喷施适宜剂量的T6或T8均可以诱导小麦雄性不育率93%以上, 这只是初步试验结果, 还需进行不同基因型对T6的敏感程度试验等, 但可以本研究为起点, 例如, 以T6-C3和T8-C2设计不同施药剂量和施用的多种处理来大量筛选, 以建立小麦化控二系体系, 实现化控两系在小麦杂种优势中的应用。
小麦是自花作物, 天然杂交率为1%~4%。本实验室多年来一直专注于化学杂交剂诱导的小麦杂种优势利用理论与实践方面的研究, 从现阶段研究中也发现, 仍有诸多共性问题需要进一步探索与逐一解决, 其中一个重要制约因素是, 药剂处理小麦授粉阶段颖壳张开度小, 天然异交率低。从提高异交结实率的角度考虑, 应尽量设法提高受体小麦扬花期颖壳张开度及母本的柱头外露率, 从而增加天然异交结实率。本试验结果显示, T6适宜浓度处理后, 植株花粉的不育程度高, 颖壳张开度较大, 且人工饱和异交率高, 但是, 其天然异交结实率能否满足大面积配制杂交种要求, 需要进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|