第一作者联系方式: E-mail:13639767407@163.com, Tel: 13639767407 (赵会彦); E-mail:xlu2005@yahoo.com.cn (肖麓)
** 同等贡献(Contributed equally to this work)
利用青海大黄油菜和褐籽白菜型油菜09A-126构建BC4和F2分离群体, 结合AFLP与群体分离分析法(bulked segregant analysis, BSA)筛选引物, 获得5个与黄籽基因
A BC4 population and a F2 population, derived from the cross between Dahuang and 09A-126 (brown seed,
油菜菜籽油是我国食用油的重要来源, 菜籽饼粕是良好的蛋白质饲料, 提高含油量和蛋白质含量是油菜品质育种的最重要目标。大量研究表明, 相同遗传背景下, 黄籽油菜的籽油含量和蛋白质含量通常高于黑籽或褐籽油菜, 而且黄籽具有种皮薄、纤维素和多酚类物质含量低、油质清澈透亮等优点,因此, 黄籽油菜的选育倍受研究人员的重视[ 1, 2, 3, 4]。Mohammad等[ 5]研究表明, 黄籽沙逊油菜黄籽性状受3对基因( Br1、 Br2和 Br3)控制, 3对基因同时为隐性时表现黄籽, Jönsson[ 6]研究得出同样的结论; Stringam[ 7]研究表明, 黄籽沙逊菜籽种皮颜色受2对独立基因( Br1和 Br3)控制, 当2对基因同时为隐性时, 种皮颜色为黄色; Zaman[ 8]和Rahman[ 9]同样认为黄籽性状受双基因控制; Ahmed和Zuberi[ 10]研究认为白菜型油菜的黄籽性状受1对基因控制, Hawk[ 11]和Chen等[ 12]的研究与之相同; Schwetka[ 13]认为白菜型油菜的粒色性状受母本影响较大, 且与7对基因( Br1、 Br3~ Br8)有关。Teutonico和Osborn[ 14]构建了白菜型油菜RFLP标记遗传连锁图谱, 将控制黄籽和褐籽性状的位点 Yls定位于第5连锁群; Chen等[ 15]利用白菜型油菜-芥蓝单体异附加系筛选到一个与种皮颜色基因紧密连锁的RAPD标记, 并推测由于同源重组或染色体缺失, 该粒色基因位于外来的C基因组第一条染色体的末端; Rahman等[ 16]利用黄籽沙逊为材料, 筛选到一个与粒色基因( Br1/ br1)紧密连锁的SRAP标记SA7BG29-245, 遗传距离为0.47 cM, 并将该标记转化为SNP标记和SCAR标记。
白菜型黄籽油菜是自然界存在的天然黄籽资源之一, 白菜型油菜的黄籽性状的研究对甘蓝型黄籽油菜品种的遗传改良具有一定的指导意义。青海大黄油菜是起源于青藏高原的地方品种, 属白菜型油菜, 菜籽种皮颜色鲜黄且遗传稳定, 自交亲和性好, 是进行油菜黄籽性状研究的良好材料[ 17]。Xiao等[ 18]认为黄籽性状受一个隐形基因位点( Brsc1)控制, 构建了 Brsc1的遗传连锁图谱, 并定位于白菜型油菜A9染色体上, 将目标基因锁定2.8 Mb的区间。本研究扩大作图分离群体, 利用新的引物组合, 以筛选更多与目标基因紧密连锁的分子标记, 与前人所获得标记进行整合, 构建高密度的遗传连锁图谱, 为黄籽油菜分子标记辅助选择育种体系的建立和图位克隆奠定基础。
选用亲本材料为青海大黄油菜(黄籽)和09A- 126 (褐籽), 由青海省农林科学院春油菜研究所提供。大黄油菜和09A-126均已连续自交或兄妹交8代以上, 粒色性状稳定。以09A-126为供体亲本, 大黄油菜为轮回亲本, 进行连续回交。在BC1、BC2和BC3世代中均保留褐籽单株上收获的种子播种, 用于下一轮的回交, 获得的BC4分离群体作为 Brsc1基因的定位群体; 大黄油菜和09A-126杂交获得的F1单株自交, 获得F2群体, F2中每一个单株套袋自交, 获得F2:3家系, 用于F2单株基因型的鉴定。
在苗期, 从BC4群体和F2群体每株油菜中取适量叶片, 采用CTAB法提取总DNA, 参考Doyle[ 19]的方法并略作改动。使用紫外分光光度计测定每个单株总DNA浓度, 稀释至50 ng µL-1, 冷藏备用。
在角果完全成熟后, 采用目测法调查BC4群体、F2群体及F2:3家系所有单株种皮颜色。根据粒色将BC4群体所有单株DNA分为黄籽和褐籽两组; 根据F2群体单株粒色性状和F2:3家系中粒色性状是否分离将F2群体单株DNA分为黄籽、纯合褐籽(不分离)和杂合褐籽(分离) 3组。
在BC4群体中随机挑选12个黄籽单株和12个褐籽单株, 每6个单株DNA等量混合, 分别构建2个黄籽基因池和2个褐籽基因池。采用 Pst I/ Mse I的酶切组合, 首先利用256对选扩引物(P01~16/MG01~ 16)和4个基因池筛选标记, 用6%聚丙烯酰胺凝胶电泳检测PCR扩增产物。能区分黄籽和褐籽基因池的多态性标记继续用BC4分离群体单株检测, 最终筛选出与粒色性状紧密连锁的AFLP标记[ 20, 21]。参照陆光远[ 22]的方法操作。AFLP引物由上海生工生物工程有限公司合成。
在6%聚丙烯酰胺凝胶胶板干燥之前将AFLP特异片段用刀片轻轻挖出并转入0.5 mL离心管中, 加20~40 μL ddH2O, 沸水浴10 min后取上清液利用原引物重新扩增, 用1%琼脂糖凝胶电泳检测扩增产物, 用Sanprep柱式DNA胶回收试剂盒(上海生工生物工程有限公司)从琼脂糖胶块中回收目标片段。将目标片段与pMD18-T载体(大连宝生物工程有限公司)连接, 导入DH5α大肠杆菌感受态细胞克隆扩增, 经蓝白斑筛选和电泳检测, 从每个目标片段挑选3个阳性克隆菌液, 送上海生工测序。具体操作参照易斌[ 23]的方法。
测序后, 在BRAD数据库(http://brassicadb.org/brad/index.php)和TAIR数据库(http://www.arabido-psis.org/)中, 使用Blast命令分析每个AFLP特异片段与白菜型油菜基因组和拟南芥基因组的序列共线性, 确定每个特异片段所在染色体及在染色体上的物理位置[ 24, 25, 26]。
根据AFLP特异片段的序列信息, 利用Primer3软件(http://frodo.wi.mit.edu/)设计SCAR引物, 由上海生工生物工程有限公司合成。首先在基因池和BC4分离群体部分单株中检测合成后的SCAR引物是否具有多态性, 然后在F2群体中用黄籽、杂合褐籽和纯合褐籽的单株检测其是否为共显性标记。参照李霞[ 27]的方法进行SCAR引物PCR。
利用4个基因池检测AFLP引物, 若多态性片段同时出现在2个褐籽基因池中, 而在2个黄籽基因池中都缺失, 则认为可能与目标基因连锁。将这些引物组合挑出, 用于分析BC4群体中随机挑选的6个黄籽单株和6个褐籽单株。部分标记, 尤其是在基因池检测中多态性条带较弱的标记, 在进行单株检测时多态性消失; 部分标记检测出的重组单株大于2株, 说明离目标基因较远, 同样予以舍弃。特异条带清晰且检测出的重组单株少于2株(包含2株)的AFLP标记, 被认为是与目标基因紧密连锁的AFLP标记。本研究中, 共筛选256对引物组合, 获得5个与目标基因紧密连锁的标记, 将其分别命名为Y11~Y15 (表1)。
5个AFLP特异片段经回收、克隆和测序, 序列信息提交BRAD数据库序列比对表明, 5个特异片段均与白菜型油菜A9染色体序列高度同源, 与Xiao等定位结果一致, 进一步证实控制粒色性状的基因位于A9染色体上; 5个AFLP特异片段的序列信息同时提交TAIR网站序列比对表明, Y11和Y15标记分别与拟南芥第5染色体和第2染色体部分序列同源(表1)。
根据5个AFLP特异片段的序列信息, 在靠近特异片段序列末端区域设计SCAR引物, 每个AFLP特异片段设计一对SCAR引物, 分别命名为SC11~ SC15, 其引物序列及退火温度见表2。5个SCAR标记经基因池和BC4群体单株验证, 检测结果与对应AFLP标记一致, 表明5个AFLP标记均被成功转化为SCAR标记。5个SCAR标记在F2群体部分单株中检测结果表明, SC14在黄籽、杂合褐籽和纯合褐籽单株中扩增出了不同的带型, 能够区分黄籽、杂合褐籽和纯合褐籽3种类型的单株, 为共显性标记。其余4个SCAR标记均为显性标记。
| 表1 与 Brsc1紧密连锁的AFLP标记 Table 1 AFLP markers closely linked to Brsc1 |
| 表2 由特异性AFLP标记转化所得SCAR标记 Table 2 SCAR markers developed from AFLP markers |
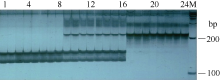
从BRAD数据库中白菜型油菜A9染色体上目标基因所在区段下载得到已公布的SSR标记, 并在该区段每隔一段距离设计开发一个新的SSR标记。合成后的SSR引物在基因池和BC4分离群体中进行多态性检测, 结果发现, 在已公布的SSR标记中, 共有3个标记(B089L03-3、BrID10607和KS10760)与目标基因连锁。图1所示为KS10760在BC4群体部分单株中的扩增结果。新开发的SSR引物中, 有4个标记(A1~A4)表现为与目标基因连锁。以上获得的7个特异性SSR标记的引物序列及在染色体上的位置详见表3。利用F2群体3种类型的单株(黄籽、杂合型褐籽和纯合型褐籽)对7个特异性SSR标记进行检测, 结果发现只有标记A1具有共显性, 其扩增结果如图2所示。
BC4定位群体共包含1739个单株。获得的所有特异性标记的物理位置可由BRAD数据库获得, 首先在BC4群体中随机挑选48个黄籽单株和48个褐籽单株, 对所有特异性标记进行初步检测, 根据交换单株的分布和数目及特异性标记在染色体上的位置, 选择位于目标基因两侧且扩增条带清晰、交换单株数目适中的B089L03-3和Y14标记对BC4群体所有单株进行检测, 寻找交换单株, 然后利用B089L03-3和Y14之间的所有特异性标记对这些交换单株进行检测, 包括Xiao等所获得的4个AFLP标记(Y05~Y07, Y10)和本研究所获得的8个特异性标记(Y12、Y15、BrID10607、KS10760和A1~A4), 其中Xiao等所获得的标记在BC4群体中仍具有明显多态性, 分别得到这些标记的交换单株, 确定重组率, 计算遗传距离, 如表1和表3所示, 构建遗传连锁图谱如图3-B所示, 并结合Xiao等定位结果, 绘制了整合后的物理图谱, 如图3-C所示。新构建的遗传连锁图谱中包含2个共分离标记Y05和Y12, 除Y12外, 各标记在连锁图中的分布与其在染色体上的物理位置基本一致, 据此将目标基因锁定于Y06 (19.3 Mb)和A4 (17.6 Mb)标记之间1.7 Mb的区间内。
| 表3 与 Brsc1紧密连锁的SSR标记 Table 3 SSR markers closely linked to Brsc1 |
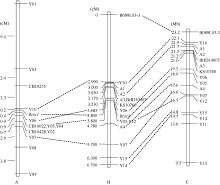 | 图3 Brsc1基因区域的遗传连锁图谱A: Xiao等[ 18]构建; B: 本课题组构建; C: A9染色体上与 Brsc1连锁的分子标记的物理图谱。虚线为同一标记在不同图谱中的位置。Fig. 3 Linkage map of Brsc1geneA: constructed by Xiao et al.[ 18]; B: constructed by our research group; C: map of markers linked with Brsc1 on A9 of B rassica rapaL. dotted lines indicate the same marker on different maps. |
Xiao等[ 18]构建了包含456个单株的BC1群体对大黄油菜黄籽基因进行定位, 采用P0/MC的引物组合, 共筛选到10个AFLP标记和3个SSR标记, 距离目标基因最近的AFLP标记Y10与目标基因间的遗传距离为0.2 cM, 最近的SSR标记与目标基因间的遗传距离为0.8 cM, 并筛选到2个共显性SSR标记CB10022和CB10255。本研究采用不同的AFLP引物组合, 筛选得到5个与目标基因连锁的AFLP标记, 其中Y12与目标基因共分离。5个AFLP标记被成功转化为SCAR标记, 将更加有利于今后的育种实践工作。同时共显性标记SC14和A1的获得, 为黄籽油菜分子标记辅助选择育种体系的建立创造了有利条件。
BRAD数据库的建立为本研究提供了很大的帮助, 根据特异性AFLP特异片段与白菜型油菜基因组序列同源比对结果, 进行了SSR引物的开发和收集, 成功筛选到7个特异性SSR标记。随着测序技术的发展, 芸薹属作物基因组序列信息越来越丰富, 使基于DNA序列的分子标记开发越来越便捷, 必将为芸薹属作物优良性状分子水平的研究提供极大的便利。
本研究将Xiao等[ 18]在BC1群体中所获得的特异性标记在BC4群体中进一步检测, 4个AFLP标记(Y05~Y07, Y10)的遗传距离与前人测定的结果不同, 与 Brsc1的的相对位置也发生了一定的变化。由于Xiao等定位所用群体为BC1群体, 且群体单株数目较少, 随着作图群体单株数目的增加, 特异性标记与目标基因间的遗传距离和相对位置的测定应更为准确, 本研究采用BC4分离群体, 群体单株数目较前人的BC1群体多, 且由于回交次数的增加, 分离群体中黄籽和褐籽两种单株的遗传背景更为一致, 定位更准确。虽将目标基因的位置进行了矫正, 但其所在染色体区域(1.7 Mb)仍比较大, 需进一步扩大作图群体, 并设计开发更多的分子标记, 进一步对目标基因定位。Xiao等所获得的标记Y08和本研究所得标记Y12的遗传距离和物理位置间有一定差异, 除可能与群体大小相关外, 还可能与白菜型油菜基因组序列信息不够完备有关, 随着BRAD数据库的不断完善和作图群体的不断扩大, 可对相关标记的位置进一步矫正。
Li等[ 32]和Kebede等[ 33]对白菜型油菜黄籽性状的研究, 均将控制黄籽性状的基因或主效位点定位于A9染色体, 与本研究定位结果相似, 但可能由于试验材料、试验方法等的不同, 具体定位结果也不完全相同。Li等用黄籽沙逊为材料将黄籽基因定位于A9染色体上11.4 Mb处, 与本研究定位区间(17.6~ 19.3 Mb)相距较远, 可能为控制黄籽性状的不同的基因。Kebede等同样对黄籽沙逊进行研究, 在A9染色体上得到控制黄籽性状的1个主效QTL (SCA9-2) (18.9 Mb左右)和1个微效QTL(SCA9-1) (7.0 Mb左右), 与Li等的研究结果相比, 虽然研究材料同为黄籽沙逊, 但2个QTL在A9染色体上的位置不同; 与本研究结果相比, 虽然试验材料不同, 但其中主效QTL SCA9-2包含一个与本研究黄籽基因同样表现连锁的SSR标记CB10022, 且该标记位于本研究目标基因被锁定的区域内, 说明两者可能为同一位点, 可利用2个基因位点所在区域更多的连锁标记互相验证, 并对2个基因位点进一步精细定位, 直至获得基因序列, 方可确定其是否为同一位点。A9染色体为A基因组中最长的一条染色体, 其上有许多控制油菜优良农艺性状的基因。将本研究所得与目标基因紧密连锁的分子标记在A9染色体上进行同源基因比对, 部分标记具有同源基因, 也具有对应拟南芥同源基因, 但未发现与种皮颜色形成相关基因。在本研究中目标基因被锁定的A9染色体上的区域内, 包含许多已公布的基因, 其中我们发现基因 Bra028067与控制类黄酮合成的拟南芥基因 TT1 [ 34, 35, 36]同源, Bra028067 (18.7 Mb)位于目标基因被锁定的1.7 Mb的区间内, 且距离共分离标记Y05 (18.9 Mb)较近, 可对该基因进行研究, 为目标基因的定位提供有利的信息。Zhang等[ 37]利用图位克隆的方法, 在白菜型油菜双单倍体系中, 得到一个同时控制粒色性状和毛状体性状的基因, 该基因与拟南芥 TTG1基因同源。在甘蓝型油菜和芥菜型油菜中, 也有一些与拟南芥透明种皮基因同源的基因被克隆分离[ 38, 39], 拟南芥作为模式植物, 其上许多功能已知的基因可为油菜栽培种中控制优良性状的基因的研究提供帮助。本研究和Kebede等研究所得与黄籽基因紧密连锁的标记CB10022来源于甘蓝型油菜N9染色体[ 40], 由于芸薹属作物在起源进化上的互相关联, 不同油菜栽培种间对相同性状的分析结果可互为参考, 加快对目标性状的研究利用。
筛选到与大黄油菜粒色基因 Brsc1紧密连锁的5个AFLP标记(Y11~Y15)和7个SSR标记(B089L03-3, KS10760, BrID10607, A1~A4), 并将5个特异性AFLP标记转化为SCAR标记, 多态性明显, 还筛选到2个共显性标记(SC14, A1)。将前人获得的标记与本研究获得的标记整合, 对目标基因进一步定位, 得到2个共分离标记Y05和Y12, 将目标基因锁定于白菜型油菜A9染色体上Y06和A4标记之间1.7 Mb的区间。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|