第一作者联系方式: E-mail:wang521wgp@163.com
** 同等贡献(Contributed equally to this work)
穗发芽是影响小麦品质和产量的重要因素之一, 通常红粒小麦比白粒小麦具有较高的穗发芽抗性。转录因子
Pre-harvest sprouting (PHS) is one of important factors affecting yield and quality of wheat (
穗发芽是指小麦在成熟收获期遇到阴雨或潮湿环境穗上发芽的现象[ 1, 2]。它是影响小麦生产的一种世界性灾害, 严重降低小麦品质和产量, 即使是受害轻未发芽的麦粒, 也会由于胚萌动和α-淀粉酶活性提高, 导致降落值下降, 加工品质变劣[ 3, 4]。在国际市场上, 穗发芽率超过5%的小麦即被认定为饲料麦, 价格只有粮食小麦的一半。我国北方冬麦区大部、长江中下游和西南麦区、以及东北春麦区经常遭受穗发芽危害, 提高穗发芽抗性成为我国小麦育种的重要目标之一。
小麦穗发芽是环境因素和基因型互作的结果, 环境因素包括光照、温度、湿度以及土壤环境等; 基因型因素包括穗部和籽粒性状、α-淀粉酶活性、种子休眠性和种皮颜色等[ 5, 6, 7]。对于抗穗发芽, 根据表型选择效果较差, 利用分子标记可以提高其选择效率。目前, 已开发出许多与穗发芽抗性相关的标记[ 8, 9, 10, 11]。
小麦种皮颜色不仅影响面粉品质, 而且影响小麦的穗发芽抗性, 通常红粒小麦比白粒小麦具有较强的穗发芽抗性[ 12, 13]。小麦种皮颜色是由位于3A、3B、3D染色体长臂上的 R-1(red grain color gene)基因控制的。红粒小麦的种皮颜色是由类黄酮生物合成途径产生的儿茶酸、原花青素和花青素组成的, 其合成途径中主要含有查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)和二羟基黄酮醇还原酶(DFR)[ 14]。Himi等[ 15, 16]克隆了 CHS、 CHI、 F3H和 DFR基因, 发现这些基因主要在红粒小麦的未成熟种皮中表达, 在白粒小麦中几乎完全被抑制。 Tamyb10基因是调控该合成途径的一个重要转录因子, 位于小麦3A、3B、3D染色体的长臂上[ 17]。 Tamyb10的瞬时表达可使胚芽鞘上出现红色斑点, 吸收光谱鉴定为花青素, 而 DFR在胚芽鞘中的瞬时表达, 没有红色斑点出现[ 18, 19], 进一步说明 Tamyb10基因作为转录因子调控种皮花青素合成相关基因的表达, 从而调控种皮颜色。对 T amyb10基因结构和功能的进一步分析发现, Tamyb10-A1存在3种等位变异, Tamyb10-B1和 Tamyb10-D1分别存在2种等位变异, 并开发了鉴定其变异的特异分子标记[ 18]。因此, 利用该标记组合可确定小麦 Tamyb10单倍型。
目前, 小麦籽粒颜色与穗发芽抗性关系的分子机制尚不清楚, 多数红粒小麦具有穗发芽抗性, 但部分红粒小麦表现为穗发芽敏感。为了明确 Tamyb10单倍型与穗发芽抗性的关系, 本研究利用 Tamyb10-A1、 Tamyb10- B1和 Tamyb10- D1基因的特异分子标记, 探讨了中国红粒小麦的 Tamyb10单倍型及其与穗发芽抗性的相关性, 以及不同麦区中 Tamyb10单倍型与穗发芽抗性的关系, 为进一步解析红粒小麦穗发芽抗性机制和通过分子标记选择培育穗发芽抗性小麦品种奠定基础。
119个红粒小麦品种来自国内不同麦区, 具有不同穗发芽抗性, 其中东北春麦区71份, 北部冬麦区30份, 长江中下游麦区10份, 西南冬麦区6份, 黄淮麦区2份。
采用种子发芽指数(germination index, GI)鉴定小麦穗发芽抗性[ 20]。2000—2001年和2001—2002年小麦生长季节分别于河南安阳和北京种植供试材料。在小麦蜡熟期收获麦穗, 手工脱粒, 将种子HgCl2灭菌后, 胚朝上置于铺有滤纸的培养皿中, 每皿100粒, 3次重复, 加适量无菌水, 室温下发芽。每天观察记录发芽籽粒数, 并移除发芽籽粒, 持续观察记录7 d。

式中, m为观测总天数, 本试验中 m=7; i为观测的某一天; n i为第 i天发芽种子数, N为所有实验种子数。119份材料的GI值在年份间具有高度的相关性( r = 0.898, P<0.0001), 因此采用两年两点的平均值作为一个基因型的GI观测值。按蒋国梁等[ 21]的分类标准, 119份材料的穗发芽抗性可分为抗(GI<26%)、中抗(26%≤GI<61%)和感(GI≥61%) 3种类型, 分别包括68、25和26个品种。
用植物基因DNA提取试剂盒(天根生化有限公司), 按说明书步骤从小麦种子中提取DNA。根据Himi等[ 19]报道的 myb10特异引物序列(表1), 由北京六合华大基因科技股份有限公司合成引物。PCR反应体系25 µL, 含10×buffer 2.5 µL、250 µmol L-1dNTP各2 µL、10 mmol L-1引物各0.5 µL、r Taq DNA聚合酶(大连宝生物工程有限公司) 0.2 µL、模板DNA 1 µL。反应条件为95℃预变性5 min; 95℃变性30 s, 退火30 s, 72℃延伸, 40个循环; 最后72℃延伸10 min。用1.2%琼脂糖凝胶, 在5 V cm-1电压下电泳分离PCR产物, 用0.01%EB溶液染色15 min, 用紫外成像仪照相。
由于myb10-B引物在 Tamyb10-B1a和 Tamyb10- B1b位点扩增片段大小相近, 采用6%变性聚丙烯酰胺凝胶电泳确定 Tamyb10-B基因的2种单倍型。凝胶总体积为75 mL, 其中40%聚丙烯酰胺溶液11.25 mL、尿素31.54 g、5×TBE15 mL、TEMED 45 µL、10%过硫酸铵200 µL。取PCR产物10 µL, 加入2 µL变性缓冲液后, 98℃变性10 min, 立即放入冰水混合物中。取5 µL上样, 80 W恒功率电泳约 1.5 h后, 采用银染法观察记录结果。
按扩增结果进行单倍型分类, 采用SAS (Statistical Analysis System) 9.0软件对 Tamyb10单倍型与穗发芽抗性进行相关分析, 以及麦区间的方差分析和多重比较。
| 表1 Tamyb10分子标记与单倍型鉴定 Table 1 Tamyb10 PCR marker and genotype identification |
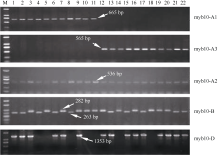
Ta myb10基因在119份材料中的部分琼脂糖凝胶结果见图1, 各引物扩增片段大小与预期结果一致(表1)。 Tamyb10-A1、 Tamyb10-B1和 Tamyb10-D1三种基因的单倍型分布见表2。
myb10-A1引物检测到91个 Tamyb10-A1b单倍 型材料; myb10-A2引物检测到28个 Tamyb10-A1a单倍型材料。供试119份材料中, myb10-A3引物扩增条带大小全为565 bp, 说明 Tamyb10-A1a只存在一种等位变异类型。在抗穗发芽的68个品种中, 有51个为 Tamyb10-A 1b单倍型, 17个为 Tamyb10-A1a单倍型; 在中抗穗发芽的25个品种中, 20个为 Tamyb10-A1b单倍型, 5个为 Tamyb10-A1a单倍型; 而在26个感穗发芽品种中, Tamyb10-A1b和 Tamyb10 - A1a单倍型分别为20个和6个。单倍型 Tamyb10-A1b和 Tamyb10-A1a品种的平均GI值没有显著差异, 说明 Tamyb10-A1基因对红粒小麦的穗发芽抗性影响较小。
| 表2 Tamyb10基因不同单倍型在119份材料中的分布穗发芽指数(GI)为两年两点平均值。 Table 2 Distribution of different Tamyb10 haplotypes in 119 red-grained wheat varietiesGermination index (GI) is the mean of two locations over two years. |
myb10-B引物检测到67个 Tamyb10-B1b单倍型品种, 其余52个品种为 Tamyb10-B1a单倍型。 Tamyb10-B1b在抗、中抗和感穗发芽品种中的比例分别为63.2%、56.0%和38.5%; 而 Tamyb10-B1 a所占比例依次为36.8%、44.0%和61.5%。 Tamyb10-B1b单倍型的品种GI平均值为(25.1±3.7)%, T a myb10- B1a单倍型的品种GI平均值为(37.6±4.9)%, 两者存在显著差异( P<0.05), 说明 Tamyb10-B1b单倍型与穗发芽抗性相关。
myb10-D引物在119份材料中检测到98个 Tamyb10-D1b单倍型和21个 Tamyb10-D1a单倍型。 Tamyb10-D1b在抗、中抗和感穗发芽品种中的比例分别为89.8%、68.0%和76.9%, 而 Tamyb10-D1 a所占比例依次为10.3%、32.0%和61.5%。 Tamyb10-D1b和 Tamyb10-D1a单倍型的品种GI平均值分别为(26.9±3.2)%和(48.1±7.9)%。
将119份材料按照 Tamyb10-A1、 Tamyb10-B1和 Tamyb10-D1的单倍型(见附表)分成7类, 即baa、aba、bba、aab、bab、abb、bbb。对单倍型与穗发芽抗性的方差分析和多重比较分析发现, 单倍型baa与aab、baa与bbb穗发芽抗性差异极显著( P<0.01), baa与bba、baa与abb、aba与bbb穗发芽抗性差异显著( P<0.05)(表3)。由此推测, Tamyb10单倍型与穗发芽抗性具有相关性。其中, 单倍型bbb和aab具有较低的穗发芽率, 平均穗发芽率分别为(18.1±4.2)%和(20.5±8.0)%。因此, 这2种 Tamyb10单倍型可作为红粒小麦抗穗发芽品种的优选基因型加以利用。在A、B和D组同源基因中, Tamyb10-D1基因可能对穗发芽抗性具有较大的影响, 其次是 Tamyb10-B1, 作用最小的是 Tamyb10-A1, 特别是 Tamyb10-D1b对提高小麦穗发芽抗性起重要作用。
| 表3 不同 Tamyb10单倍型的穗发芽指数(GI) Table 3 Germination index (GI) in different Tamyb10 |
71份东北春麦区品种中, 存在6种单倍型, 未出现baa单倍型, 仅aba单倍型品种感穗发芽, 其余为抗穗发芽品种, 占98.6%, 其中, bbb单倍型占45.0%。在30份北部冬麦区品种中, 存在7种单倍型, 且全为感穗发芽品种。 Tamyb10单倍型在该地区与穗发芽率抗性的关系较小。在10份长江中下游麦区品种中, aba、abb、bab、bba、bbb单倍型都为中抗穗发芽品种, 未出现aab和baa单倍型。西南冬麦区的6份品种包含4种单倍型, 平均穗发芽率均为中抗水平。黄淮麦区2个品种分别为bba和bbb单倍型, 平均为中抗穗发芽(表4)。
| 表4 不同麦区的 Tamyb10单倍型及其品种平均穗发芽指数(GI) Table 4 Tamyb10haplotypes in different wheat region and their average germination index of varieties correlation analysis between PHS and haplotypes distribution across six wheat growth zones |
红粒小麦普遍具有穗发芽抗性, 可能是控制种皮颜色基因的多效性造成的[ 12, 22, 23]。细胞遗传学方法证明, 麦粒颜色由位于小麦第3同源群长臂上的3个 R显性基因 R-A1b、 R-B1b和 R-D1b控制, R-1基因可以上调类黄酮合成途径中粒色相关基因的表达[ 24]。 R-1基因与种子休眠性也密切相关, 可增强种子的休眠性[ 23]。 R-1基因以一种转录因子的形式参与粒色的调控, 并且 Tamyb10基因与 R-1基因在控制籽粒的颜色方面具有相同的功能, Tamyb10是 R-1基因的一个强候选基因[ 19]。
本文利用 Tamyb10基因分子标记检测了119份来自不同麦区红粒小麦的 Tamyb10单倍型, 共发现 7种单倍型, 即baa、aba、bba、aab、bab、abb和bbb, 未发现aaa单倍型。因为当 Tamyb10位点3个同源基因全表现为隐性单倍型(aaa)时, 种皮颜色为白色, 反之任何一个位点出现显性等位基因时种皮表现红色[ 25]。
目前, 小麦籽粒颜色与穗发芽抗性关系的分子机制尚不清楚。因此, 了解籽粒颜色合成相关基因的功能和作用机制, 将有助于解析红粒小麦穗发芽抗性机制。 TaDFR基因是类黄酮合成途径中控制籽粒颜色生成的一个关键基因, Tamyb10转录因子可以调控该基因的表达。本实验室分析了不同穗发芽抗性红粒小麦中 TaDFR基因的等位变异类型, 发现 TaDFR-A和 TaDFR-D无功能差异或等位变异, 而 TaDFR-B存在3种等位变异, 与 TaDFR- Ba相比, TaDFR- Bb在启动子区有一个8 bp插入, TaDFR- Bc存在一个SNP差异点; 在120份红粒小麦材料中, 启动子区含有8 bp插入序列的品种( TaDFR- Bb)具有较高穗发芽抗性( P<0.01)[ 18]。推测该8 bp的插入可能影响 Tamyb10转录因子与 TaDFR- Bb启动子的结合效率, 导致表达上的差异, 最终影响红粒小麦穗发芽抗性。本研究表明, 不同 Tamyb10单倍型材料的平均穗发芽率存在差异, 其中单倍型bbb和单倍型aab具有较低的穗发芽率, 与其他5种单倍型间存在显著差异, 说明 Tamyb10单倍型与穗发芽率相关。同时发现, Tamyb10- D1b对提高小麦穗发芽抗性起重要作用。就 Tamyb10-D1的2种单倍型来说, Tamyb10-D1b和 Tamyb10- D1a单倍型材料的平均穗发芽率无显著差异, 但综合分析 Tamyb10位点3个同源基因的效应, Tamyb10-D1对穗发芽率的影响最大, 可能与基因间互作有关。
各生态麦区中, 东北春麦区(71份)和北部冬麦区(30份)品种数较多, 对其进行单倍型地理分布分析, 但未发现明显的地域性特征, 东北春麦区红粒小麦品种中存在6种单倍型, 无baa型, 而北部冬麦区红粒小麦品种中则存在7种单倍型。与此相反 Tamyb10单倍型与穗发芽抗性的关系在不同地域存在一定差异, 例如在71个东北春麦区品种中, 81.7%的抗穗发芽品种的单倍型是aab、bab或bbb, 其中bbb型占45.0%, 表明该单倍型在东北春麦区的小麦抗穗发芽育种中起重要作用。而在北部和长江中下游(40份材料)的冬小麦种植地区, 这3种单倍型的材料却表现为感穗发芽或中抗穗发芽。说明在北部和长江中下游的冬小麦种植地区, 红粒小麦穗发芽抗性育种可能主要针对其他穗发芽抗性性状, 例如, 穗部和籽粒性状、α-淀粉酶活性和种子休眠性等。此外, 由于受不同麦区中所分析的小麦品种数量限制和分布不平衡的影响, Tamyb10单倍型与穗发芽抗性的关系在地域间的分布特征还有待进一步研究。
利用 Tamyb10分子标记, 确定了119份中国红粒小麦的 Tamyb10单倍型, 发现 Tamyb10基因在中国红粒小麦品种中存在7种不同的单倍型, 且不同单倍型间材料的平均穗发芽率存在差异。bbb和aab单倍型与较高穗发芽抗性相关, 可作为小麦抗穗发芽品种的优选基因型加以利用。 Tamyb10-D1基因对穗发芽抗性的影响大于 Tamyb10-B1和 Tamyb10-A1。 Tamyb10单倍型bbb在东北春麦区与较高穗发芽抗性相关。
| 附表 119份中国红粒小麦材料的GI值和 Tamyb10单倍型 Supplemental Table GI values and Tamyb10 haplotypes in 119 Chinese red-grained wheat varieties |
| (续附表) 119份中国红粒小麦材料的GI值和 Tamyb10单倍型 Supplemental Table Table GI values and Tamyb10 haplotypes in 119 Chinese red-grained wheat varieties |
| (续附表) 119份中国红粒小麦材料的GI值和 Tamyb10单倍型 Supplemental Table Table GI values and Tamyb10 haplotypes in 119 Chinese red-grained wheat varieties |
| (续附表) 119份中国红粒小麦材料的GI值和 Tamyb10单倍型 Supplemental Table Table GI values and Tamyb10 haplotypes in 119 Chinese red-grained wheat varieties |
致谢: 衷心感谢肖世和研究员、闫长生副研究员等提供的穗发芽抗性数据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|