分别构建CaMV35S启动子驱动的
To obtain better
果聚糖是一种以蔗糖为底物由果聚糖转移酶基因催化合成的果糖基聚合物, 它不仅是一种重要的贮藏性碳水化合物, 也是一种渗透调节物质, 其分解产生的单糖能够提高液泡溶质浓度, 增强植物对多种不良环境胁迫的抗性。大多数植物都以淀粉和蔗糖作为储存物质, 只有约15%的温带和冷寒地区的被子植物, 如禾本科、百合科、天门冬科、菊科和桔梗科植物以果聚糖作为碳水化合物的储存方式[ 1]。目前已从小麦、大麦、冰草、菊芋、莴苣等植物中克隆了果糖基转移酶基因并开展了相关的基因功能和转基因研究。高翔等[ 2]、李慧娟等[ 3]和Bie等[ 4]都以CaMV35S启动子驱动 Ta6-SFT(蔗糖: 果聚糖-6-果糖基转移酶基因)、 1-SST(蔗糖: 蔗糖-1-果糖基转移酶基因)和 Ta1-FFT(果聚糖: 果聚糖-1-果糖基转移酶基因)在烟草中组成型表达, 提高了转基因烟草的抗旱、抗盐和抗低温能力。张小芸[ 5]以玉米Ubi-1启动子驱动冰草 1-FFT在黑麦草中表达, 王正鹏等[ 6]构建了在茎杆中特异性表达的连接有转运肽序列的番茄rbcs启动子驱动的菊芋 1-SST植物表达载体。
蔗糖是光合作用的重要产物, 是多数植物体内长距离运输碳水化合物的主要形式, 如果导入外源基因使受体植物持续性地消耗蔗糖, 可能会对植物的生长和代谢产生不利影响。CaMV35S、Ubi-1和rbcs启动子等组成型或组织特异型启动子都使果糖基转移酶基因在转基因植物的所有组织或特异组织中持续性表达, 虽然未见引起转基因植物不良影响的报道, 但从能量的节约和高效利用角度考虑, 利用逆境诱导型启动子使果糖基转移酶基因在正常条件下微量表达或不表达, 在植物遭受逆境时高效表达, 将更好地利用植物体内的物质和能量, 并最大程度地减少外源基因导入对受体植物的影响。本研究以来自抗旱小麦品种扬麦6号的 Ta6-SFT为目的基因, 构建CaMV35S启动子驱动的 Ta6-SFT组成型表达载体和rd29A启动子驱动的逆境诱导型表达载体, 并分别导入烟草, 比较干旱胁迫下2种启动子驱动的 Ta6-SFT转基因株系的相对表达量和果聚糖含量, 分析株高等部分农艺性状指标, 筛选烟草中 Ta6- SFT的高效表达方式, 为植物中高效表达外源果糖基转移酶基因和抗逆相关基因提供理论依据和参考, 同时也可为果聚糖在植物抗旱中的作用提供形态的和分子的证据。
烟草( Nicotiana t abacumL.)组培苗NC89、植物表达载体pCAMBIA3300、大肠杆菌菌株DH5α、农杆菌菌株LBA4404均由甘肃省农业科学院生物技术研究所实验室保存。 Ta 6-SFT、rd29A启动子分别由中国农业科学院作物科学研究所叶兴国博士和甘肃农业大学生命科学院司怀军博士惠赠。
1.2.1 组成型植物表达载体pCAMBIA-6-SFT的构建
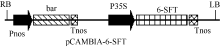
用 Hind III和 EcoR I从pBI121-6-SFT载体中将2938 bp的CaMV35S启动子、 Ta6-SFT和 nos终止子DNA大片段(简写为P35S-6-SFT-Tnos, 以下同)酶切下来并回收; 同时用 Hind III和 EcoR I酶切消化pCAMBIA3300质粒, 用P35S-6-SFT-Tnos片段替换pCAMBIA3300载体上的P35S-Tnos片段, 构建成pCAMBIA-6-SFT植物表达载体(图1)。
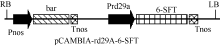
1.2.2 诱导型植物表达载体pCAMBIA-rd29A-6- SFT的构建 将CaMV35S启动子片段从植物表达载体pCAMBIA-6-SFT上用 Hind III和 BamH I酶切下来, 用rd29A启动子代替之, 构建成pCAMBIA- rd29A-6-SFT载体(图2)。
将pCAMBIA-6-SFT和pCAMBIA-rd29A-6-SFT质粒DNA用冻融法转化根癌农杆菌LBA4404。采用农杆菌介导的叶盘法转化烟草, 用草胺膦25 mg L-1筛选再生植株。对获得的抗性植株进行PCR、Southern杂交和Northern斑点杂交分子检测。
以含 Ta6-SFT质粒为阳性对照, 非转基因烟草为阴性对照, 提取的草胺膦抗性植株基因组DNA为模板, 以 Ta6-SFT特异引物进行PCR扩增。上游引物5'-CTGGATATCATGGGGTCACACGGCAAGCC-3', 下游引物5'-GGACTAGTTCATTGAACATACGAGT GATC-3', PCR产物长度为1851 bp。
Southern杂交以地高辛标记的 Ta6-SFT全长为DNA探针, Hind III酶切PCR检测阳性的转基因烟草基因组DNA, 参照Roche公司DIG High Prime DNA Labeling and Detection starter Kit I (货号: 11745832001)说明书操作。Northern斑点杂交以 Ta6-SFT全长为DNA探针, 将Southern杂交呈阳性的转基因株系的总RNA变性后固定在尼龙膜上, 杂交、免疫检测等步骤同Southern杂交。
挑选Southern杂交和Northern斑点杂交都呈阳性的转基因株系进行干旱胁迫。取0~20 cm表层土壤过筛混匀, 用称重法测土壤含水量。装盆, 盆高为30 cm, 上口径28 cm, 下口径22 cm, 每盆装干土 20 kg。参试的转基因烟草株系通过无性繁殖, 挑选生长势一致的植株随机盆栽, 每盆栽3株, 为3次重复。待烟草植株长到七叶一心期浇水至盆中土壤含水量达25%, 开始干旱胁迫, 一直持续18 d, 处理期间不浇水。
提取胁迫0 d和18 d各转基因株系和非转基因对照叶片总RNA, 参照Invitrogen GoldScript cDNA合成试剂盒(货号: c81401190)合成cDNA第一链。以烟草 actin基因(gi:50058114)为内参, 采用半定量RT-PCR分析 Ta6-SFT在干旱胁迫不同时期的转录水平表达。烟草 actin基因上游引物5′-TCCATGCTCA ATGGGATACT-3′,下游引物5′-TTCAACCCCTTGT CTGTGAT-3′。 Ta 6-SFT引物同前。
取干旱胁迫0 d和18 d各转基因株系和非转基因对照同一叶位叶片, 利用GENMED植物果聚糖化学比色法定量检测试剂盒(货号: GMS19023.1v.A)测定果聚糖含量, 参照《植物生理学实验指导》电导法测定细胞质膜透性和硫代巴比妥酸(TBA)法测定MDA含量[ 7]。
用直尺测量干旱胁迫0 d和18 d各转基因株系和非转基因对照的株高, 用螺旋测微器测1/2株高处茎粗(以下简称茎粗), 直尺测量1/2株高处上下相邻3片真叶的最长和最宽处, 烟草叶面积 = 0.6435×叶长×叶宽。
利用Microsoft Excel软件绘图, 并用DPS 7.05软件的SSR法进行多重比较。
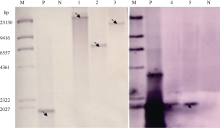
PCR检测获得了CaMV35S启动子驱动 Ta6-SFT的组成型表达的转基因烟草12株(编号S1, S3~S13), rd29A启动子驱动 Ta6-SFT的逆境诱导型表达的转基因烟草10株(编号R1~R10)。取9株进行了Southern印迹杂交, 以有杂交信号的5株进行Northern斑点杂交。图4和图5说明 Ta6-SFT已经整合到这5个植株的染色体上(图4), 并得到了转录(图5)。
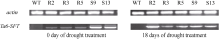
Ta6-SFT的半定量RT-PCR分析结果表明, 干旱胁迫0 d和18 d各转基因株系中 Ta 6-SFT都能被正常转录。干旱胁迫0 d, 逆境诱导型表达转基因株系R2、R3、R5中 Ta6-SFT微量表达, 而组成型表达转基因株系S9和S13中 Ta6-SFT表达水平明显高于R2、R3、R5。干旱胁迫18 d时, R2、R3、R5中 Ta6-SFT表达较干旱胁迫0 d 时明显升高, 尤其是R2株系, S9和S13中 Ta6-SFT表达较干旱胁迫0 d时不变或略有降低。
以上说明rd29A启动子驱动的 Ta 6-SFT逆境诱导型表达转基因株系只有在遭受逆境时才启动外源基因的正常转录和表达, 而CaMV35S启动子驱动的 Ta 6-SFT组成型表达转基因株系在任何条件下外源基因都处于转录的激活状态。
图7所示, 干旱胁迫0 d, 转基因株系R2、R3、R5的果聚糖含量与非转基因对照无显著差异, S9、S13的果聚糖含量与对照具显著差异, 分别高于对照20.0%、21.2%。干旱胁迫18 d时各转基因株系和对照中果聚糖含量较胁迫前都提高了, 果聚糖含量为R2>R5>R3>S13>S9>CK, 除S9外, 转基因株系显著高于对照(图7), 尤其是R2株系。与非转基因材料相比, R2、R3、R5株系果聚糖含量分别增加5.21、2.17和3.23倍, S9、S13株系分别增加1.1倍和1.7倍(表1)。
| 表1 干旱胁迫后烟草各株系果聚糖、细胞膜透性和丙二醛的变化 Table 1 Changes of fructan, cell membrane permeability, and MDA in transgenic lines under drought stress |
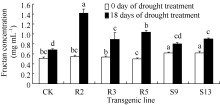 | 图7 干旱胁迫对转基因株系果聚糖含量的影响柱形图上不同字母表示株系间差异达到0.05的显著水平。Fig. 7 Fructan concentration of the transgenic lines under drought stressBars superscripted by different letters are significantly different at P<0.05. |
数据表明正常生长条件下, 逆境诱导型表达转基因株系R2、R3、R5中 Ta 6-SFT有微量表达, 当遭受逆境胁迫时, Ta 6- SFT的表达被激活, 表达量大幅上调。组成型表达转基因株系S9、S13在正常生长条件和逆境胁迫下 Ta 6-SFT都有一定表达, 在逆境胁迫时, Ta 6-SFT的表达量并不比正常条件下有所增强。由此说明逆境诱导型的转基因株系在应对非生物胁迫时可以更好地协调植物体内的物质和能量分配, 实现物质和能量的高效利用。
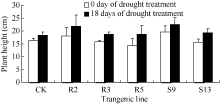
干旱胁迫0 d, 各植株长势旺盛, 形态正常。干旱胁迫持续到18 d时, 转基因株系及非转基因对照都表现出不同程度的萎蔫和叶片皱缩的现象, 后者更严重。这些外部形态与测定的株高、茎粗、叶面积数据相一致(图8、图9和图10)。表2表明, 如设定非转基因对照在干旱胁迫期间的株高和茎粗的增长量均为100%, 则rd29A启动子驱动的 Ta 6-SFT的逆境诱导型表达转基因株系R2、R3、R5的株高增长量分别是193.4%、149.2%和213.1%, 茎粗的增长量是736.9%、161.2%和1399%; CaMV35S启动子驱动的 Ta 6-SFT的组成型表达转基因株系S9和S13的株高增长量分别是144.3%和180.3 %, 茎粗增长量是367%和336%。
各株系叶面积在干旱胁迫18 d后有不同的变化趋势, 非转基因对照的叶面积较胁迫前平均减小4.00 cm2, 转基因株系R2、R3、R5胁迫后面积小幅增加, S9稍有减小, S13基本无变化(表2和图10)。
综合干旱胁迫下转基因株系株高、茎粗和叶面积的增长量分析说明, 干旱胁迫对转基因烟草株系生长的影响小于非转基因对照, 且rd29A启动子驱动的 Ta 6-SFT转基因株系的生长势强于CaMV35S启动子驱动的 Ta 6-SFT转基因株系。
在正常生长情况下, 转基因株系和非转基因对照的细胞质膜透性无显著差异( P<0.05)(图11)。表明 Ta6-SFT在烟草中的表达不但未影响植株的生长, 也未改变其生理生化特性。干旱胁迫处理18 d后各株系相对质膜透性明显上升, 逆境诱导型表达转基因株系R2、R3、R5的细胞质膜透性显著低于对照和S13, 但与S9无显著差异(图11)。转基因株系丙二醛含量在干旱胁迫前后的变化显著低于对照, 各转基因株系间无显著差异(表1和图12)。
 | 图11 干旱胁迫对转基因株系质膜透性的影响柱形图上不同字母表示株系间差异达到0.05的显著水平。Fig. 11 Cell membrane permeability of transgenic lines under drought stressBars superscripted by different letters are significantly different at P<0.05. |
| 表2 干旱胁迫后转基因烟草株系部分性状的变化 Table 2 Changes of part of agronomic traits in transgenic lines under drought stress |
转录能否启动是基因能否表达的决定性一步, 因此, 启动子的选择在转化外源基因的表达调控中具有至关重要的作用。CaMV35S启动子是在植物基因工程中最常用的启动子, 但是持续性的过量表达功能基因或胁迫应答转录因子会对转基因植株在正常条件下的生长产生不利影响。Liu等[ 8]和Kasuga等[ 9]报道CaMV35S启动子驱动的 CBF/DREB1转基 因拟南芥的抗逆性虽然增强了, 但对生长产生了不利影响。Hsieh等[ 10, 11]转CaMV35S:CBF1马铃薯表现出不同程度的生长迟缓、发育异常和产量下降。用玉米Ubi启动子驱动的 OsNAC6转基因水稻也有生长方面的缺陷[ 12]。在逆境诱导型表达中, rd29A启动子应用较多, 其中rd29A: DREB1表达盒已在烟草[ 9]、菊花[ 13]、马铃薯[ 14]、花生[ 15]、大豆[ 16]、小麦[ 17]、水稻[ 18]等植物中应用, 转基因植物的抗逆性增强了, 且没有表现出生长发育缺陷。本研究中CaMV35S启动子和rd29A启动子驱动的转基因烟草株系都没有观察到生长方面明显的缺陷, 根据rd29A启动子和CaMV35S启动子驱动的两种转基因株系在正常生长条件和干旱胁迫时外源基因的转录水平表达、果聚糖含量以及对株高、茎粗和叶面积等数据分析, 说明在遭受干旱胁迫时rd29A启动子驱动的 Ta6-SFT的逆境诱导型表达株系比组成型表达株系积累了更多的果聚糖, 具有更强的生长势和更好的耐胁迫能力。
外源基因插入的不同位点和拷贝数对基因的表达具有重要的影响, 导入的外源基因在转基因植物中的表达可能在转录、翻译水平或者成熟酶蛋白加工过程中出现差异[ 19]。本研究中rd29A启动子驱动的3个 Ta6-SFT转基因株系在干旱胁迫诱导下目的基因的mRNA表达水平、果聚糖含量上都有差异, 可能与这几个转基因株系中 Ta6-SFT在染色体插入的位置有关。Southern杂交显示S9、S13株系中外源基因的插入位置一致, 这2个株系中 Ta6-SFT在正常条件下和干旱胁迫时表达量基本一致, 果聚糖含量无显著差异, 但在干旱胁迫处理时细胞质膜透性和丙二醛含量存在差异, 这可能与植物个体对环境的响应有关。
植物生长对水分逆境高度敏感, 特别是叶子, 轻度的水分亏缺就足以使叶生长显著减弱[ 20]。本研究中对同一叶片进行了干旱胁迫0 d和18 d的跟踪测量, 结果逆境诱导型表达转基因株系R2、R3、R5的叶面积都有小幅增加, 组成表达型转基因株系S9叶面积稍有减小, S13基本无变化, 非转基因对照的叶面积减小, 证明逆境诱导表达型转基因株系确实具有更好的耐干旱胁迫性。同时株高、茎粗等生长相关数据也有力地证实了这一点。
Ta6-SFT的逆境诱导型表达使转基因株系在干旱胁迫下外源基因表达增强, 积累更多的果聚糖, 有利于提高植物对干旱胁迫的抗耐性, 具有更强的生长势。因此, 推荐在转基因植物中逆境诱导型表达抗逆基因, 使其发挥最大的作用, 减少对转基因植物的其他不良影响。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|