超氧化物歧化酶(SOD)是一种逆境条件下清除细胞内活性氧的关键酶, 而铜锌超氧化物歧化酶(Cu/Zn-SOD)是该酶系中最主要的活性氧清除剂, 与植物的抗逆性关系密切。本研究根据已发表的十字花科植物
Superoxide Dismutase (SOD) is a key enzyme eliminating reactive oxygen species (ROS), and the copper and zinc superoxide dismutase (Cu/Zn-SOD) is the most important active oxygen scavenger in SOD family, which can improve plant tolerance to environmental stresses. The cDNA of
白菜型冬油菜是西北寒旱区主要的油料作物和生态作物[ 1, 2]。但该地区冬季寒冷干燥, 极端低温天气频发, 冬油菜在整个生育期都经历低温环境, 极易遭受低温冻害而使细胞内大量超氧阴离子自由基(O2-)积累, 引起细胞代谢异常及生物膜结构和功能损坏, 致使油菜不能安全越冬。超氧化物歧化酶(superoxide dismutase, SOD)作为一种氧自由基的清除剂, 能够催化植物体内超氧阴离子自由基的歧化反应, 降低自由基的毒害, 维持细胞膜结构和功能的稳定性[ 3, 4], 增强植物的抗逆性[ 5, 6]。SOD是普遍存在于植物体内的一类金属酶类, 根据酶活性中心辅基结合金属离子的不同, 可分为Fe-SOD、Mn-SOD和Cu/Zn-SOD三种类型[ 7], 其中Cu/Zn-SOD在活性氧清除的酶系中尤为重要, 与植物的抗旱、抗寒、耐盐碱等多种抗逆性关系密切[ 8, 9, 10]。转基因烟草研究发现, Cu/Zn-SOD的过量表达可减轻水分胁迫对植株的伤害[ 11]。迄今, 已从棉花[ 12]、水稻[ 13]、玉米[ 14]等作物中克隆出 Cu/Zn-SOD基因, 但关于白菜型冬油菜的 Cu/Zn-SOD基因的克隆、生物信息学分析以及低温胁迫下的表达模式未见全面的报道。SOD是典型的诱导酶, 在逆境条件下, 能诱导植物SOD基因的表达来提高植物对环境胁迫的抵抗能力[ 15]。本研究探讨SOD酶蛋白家族 Cu/Zn-SOD基因在超强抗寒冬油菜中的表达情况及其在低温胁迫下的作用并分析该低温诱导蛋白的种类及其表达, 旨在进一步确定 Cu/Zn-SOD基因的抗寒功能, 为利用转基因技术选育抗寒冬油菜新品种奠定基础。
以超强抗寒白菜型冬油菜品种( Brassica campestris L.)陇油7号和陇油6号作为试材, 选取饱满、大小一致的种子, 以自来水浸泡30 min后, 播于装有育苗基质的营养钵(上口尺寸10 cm, 下口尺寸7 cm, 高10 cm)培养6周左右。培养条件为温度25℃/ 20℃(昼/夜)、光周期10 h/14 h (光/暗), 光照强度 100 μmol m-2 s-1。
以生长良好的陇油7号植株幼嫩叶片, 参照TRIzol试剂说明书提取总RNA, 电泳检测后按
M-MuLV第一链cDNA合成试剂盒(BS249)说明反转录, 得到单链cDNA, 置-20℃冰箱保存备用。
以GenBank数据库中查到的十字花科植物 Cu/Zn-SOD基因编码区的序列为模板, 利用Primer Premier 5.0软件设计一对简并引物CZSD-F: 5'-ATGG(C/G)CAAGGGAGTTGCAGTTT-3'和CZSD- R: CTTAGCCNTGAAGACCAATAAT(A/G)CC-3', 引物按照十字花科编码区的首尾序列设计, 可扩增出编码区的全序列。
以陇油7号幼苗叶片反转录cDNA为模板, 利用简并引物CZSD-F和CZSD-R进行RT-PCR扩增, 扩增程序为, 94℃预变性4 min; 94℃变性40 s, 60℃退火40 s, 72℃延伸1 min, 循环35次; 72℃延伸10 min, 4℃保存; 扩增产物经2% (w /v)琼脂糖凝胶电泳检测后, 用普通琼脂糖凝胶DNA纯化回收试剂盒(生工SK1141)进行目的条带回收, 连入pUCm-T载体, 反应体系为模板2 μL, pUCm-T Vector 1 μL, 10倍的T4 DNA连接液1 μL, T4 DNA连接酶1 μL。16~23℃连接1~2 h, 连接后的质粒转化大肠杆菌trans1-T1感受态细胞, 37℃过夜培养, 蓝白斑筛选后挑白斑进行菌液培养, 菌液PCR检测为阳性克隆后, 送生工生物工程(上海)股份有限公司测序。
利用Blast软件从GenBank中挑选甘蓝型油菜(登录号为AAY40317.1)、大白菜(登录号为Aac25568.1)、萝卜(登录号为AAD05576.1)、拟南芥(登录号为ABN50366.1)、琴叶拟南芥(登录号为XP002889716.1)和芥菜(登录号为AAN60796.1) 6个十字花科植物的 Cu/Zn-SOD基因编码的氨基酸序列, 利用DNAStar软件将其与白菜型冬油菜Cu/Zn-SOD的氨基酸序列进行多序列比对, 并通过MEGA 4.0软件构建系统发生树。
利用Protparam软件进行理化性质分析(http://www.expasy.ch/tools/protparam.html); 利用TMHMM软件(http://genome.cbs.dtu.dk/services/ TMHMM/)进行蛋白质跨膜区段的预测分析; 利用SignalP软件(http://www.cbs.dtu.dk/services/SignalP/)预测N-末端信号肽序列; 利用ScanProsite服务器(http://prosite.expasy.org/cgi-bin/prosite/)对蛋白功能
位点进行预测。利用NCBI在线CDS进行结构域预测分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/); 利用ExPASy工具中的SOPMA软件进行蛋白质二级结构预测。
选取生长良好的陇油7号植株进行低温胁迫处理, 先于4℃培养8 d, 继而转入-4℃超低温培养箱培养3 d, 最后于-8℃继续培养3 d, 每一低温处理完毕, 取其叶片和根冷冻保存备用, 以未低温处理的植株为对照(CK)。提取处理及对照(CK)叶片和根总RNA, 并反转录成cDNA, 测定cDNA浓度使其浓度一致, 作为半定量RT-PCR的模板。根据陇油7号 Cu/Zn-SOD基因的cDNA序列设计半定量表达引物CZS-R: 5'-TGAAACCTGGTGGGTGAG-3'和CZS-F: 5'-AGTGATTGTGAAGGTGGC-3'。以浓度一致的陇油7号叶片和根的cDNA (不同低温处理以及未低温处理)为模板, β-actin基因(正向引物Act-F: 5'-CACTTCTCCTCCTTCTTTGG-3'; 反向引物Act-R: 5'-GTAGGCATCCTTCTGGTTCA-3')为内参, 进行半定量RT-PCR, 同机分管扩增内参基因和目的基因, 电泳检测 Cu/Zn-SOD基因对低温胁迫的响应模式。PCR扩增程序同上, 退火温度为51℃。
选取生长良好的陇油6号幼苗, 于4℃连续低温胁迫25 d, 每5 d取一次样, 待胁迫25 d后, 将幼苗置常温恢复生长10 d, 并取样。低温胁迫以及室温恢复生长的叶片用于蛋白质的提取, 以未经低温处理的陇油6号幼苗为对照(CK)。参考Perras等[ 16]的方法提取低温诱导蛋白质, 并将所提取的蛋白质进行SDS-PAGE分析。
SDS-PAGE电泳结束后, 参照Hon等[ 17]的方法回收、纯化蛋白质条带。先用冷ddH2O冲洗凝胶, 并用0.1% (w /v)考马斯亮蓝R-250染色以及在脱色液(45%甲醇+45%双蒸水+10%乙醇)中脱色后, 将所选择的胶带用切胶笔切下相应位置的凝胶并粉碎后放入透析袋, 加入5倍体积的洗脱液(25 mmol L-1 Tris, pH 8.3, 192 mmol L-1 Gly, 0.1% SDS), 在100 mA恒流电泳至凝胶无色, 13 160 × g离心30 min弃沉淀, 将上清液过滤冻干。
将回收样品送生工生物工程(上海)股份有限公司进行蛋白质串联质谱(LC-MS/MS)分析。
2010年8月20日, 将陇油7号播种于甘肃农业大学油菜试验基地, 待油菜生长至五叶期, 依据气温的变化取样, 时间分别为2010年10月8日(气温14~20℃)、2010年10月17日(气温8~17℃)、2010年10月31日(气温-2~12℃)、2010年11月15日(气温-10~ -4℃)以及2011年1月18日(气温-20~ -8℃)。采用氮蓝四唑(NBT)光还原法[ 18]测定SOD酶活性。
以陇油7号cDNA为模板, 利用简并引物CZSD-F和CZSD-R进行RT-PCR扩增, 扩增产物经2.0% (w /v)的琼脂糖凝胶电泳检测得到约460 bp片段, 与目标条带大小基本一致(图1)。回收纯化该片段, 连接到pUCm-T载体上, 转化大肠杆菌, 筛选重组子后送生工生物工程(上海)股份有限公司测序得到碱基序列, 全长为459 bp, 与其他十字花科基因组数据库 Cu/Zn-SOD基因编码区序列具有很高的同源性(与甘蓝型油菜和大白菜具有99 %的同源性), 起始密码子为ATG, 终止密码子为TAA, 证明已成功获得目的基因, 并利用DNAStar软件将该序列翻译, 共编码152个氨基酸(图2)。
白菜型油菜 Cu/Zn-SOD基因预测蛋白质的相对分子质量为15.18 kD, 理论等电点为5.64。该蛋白由20种氨基酸组成, 以Gly和Thr所占比例最高, 分别为19.1%和10.5%, 酸性氨基酸(D、E)占9.9%, 碱性氨基酸(K、R)占5.9 %, 疏水氨基酸(A、I、L、F、W、V)占30.3%, 极性氨基酸(N、C、Q、S、T、Y)占23.7%, 带电荷的氨基酸(R、K、H、Y、C、D、E)占22.4%, 蛋白质不稳定指数(instability index)为
 | 图1 白菜型油菜 Cu/Zn-SOD基因的RT-PCR结果M: DL2000 marker; 1: Cu/Zn-SOD基因扩增结果。Fig. 1 RT-PCR results of Cu/Zn-SODgene in winter turnip rapeM: DL2000 marker; 1: PCR result of Cu/Zn-SOD gene amplification. |
 | 图2 Cu/Zn-SOD基因的编码区核酸序列及推导氨基酸序列方框为起始密码子ATG; *为终止密码子TAA。 ATG is indicated in box; TAA is marked by asterisk.Fig. 2 Nucleotide sequence of Cu/Zn-SODgene and its deduced amino acid sequence |
17.51, 是一个稳定蛋白(稳定系数>40时不稳定); 总平均疏水指数(grand average of hydropathicity, GRAVY)为-0.171, 为水溶性蛋白。利用在线工具TMHMM和SignalP 3.0分析Cu/Zn-SOD蛋白, 结果表明该蛋白N端不含信号序列, 无跨膜结构域, 因此推测该酶蛋白是位于细胞基质中的非分泌蛋白。
用在线工具SOPMA对Cu/Zn-SOD蛋白的二级结构预测显示, 该蛋白包含50.66%无规则卷曲(random coil)、35.53%延伸链(extended strand)、9.21%
β-转角(beta turn)和4.61% α-螺旋(alpha helix)。
应用NCBI CCD数据库对Cu/Zn-SOD蛋白保守序列预测发现, 该蛋白含有5个Cu/Zn-SOD超家族(Cu-Zn superoxide dismutase superfamily) 保守结构域。
白菜型冬油菜胞质Cu/Zn-SOD与其他十字花科植物酶蛋白相似性比较结果(图3)显示, 该蛋白与甘蓝型油菜( Brassica napus)的Cu/Zn-SOD蛋白完全一致, 与大白菜( Brassica rapa subsp. pekinensis)、琴叶拟南芥( Arabidopsis lyrata)、拟南芥( Arabidopsis thaliana)、萝卜( Raphanus sativus)和芥菜( B. juncea)的同源蛋白也具有较高的相似性, 达到91%~99%。
进一步分析Cu/Zn-SOD蛋白亲缘关系(图4)表明, 白菜型油菜(Longyou 7)与其他十字花科植物SOD酶蛋白的系统进化关系可以大致分为4类。白菜型油菜(Longyou 7)、甘蓝型油菜( Brassica napus)和大白菜( B. rapasubsp. pekinensis)为同一亚族, 属于芸薹属; 拟南芥( Arabidopsis thaliana)和琴叶拟南芥( Arabidopsis lyrata)同属于鼠耳芥属; 萝卜( Raphanus sativus)和芥菜( B. juncea)各自单独为一类, 分别为萝卜属和芸薹属。可见Cu/Zn-SOD在系统进化关系具有一定的属性特征。
通过对 Cu/Zn-SOD基因半定量RT-PCR分析(图5)
 | 图3 白菜型冬油菜与其他植物的Cu/Zn-SOD蛋白氨基酸的多重比较Fig. 3 Sequence multi-alignment of the deduced Cu/Zn-SOD protein of winter rape with other species |
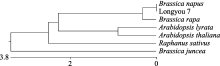 | 图4 陇油7号Cu/Zn-SOD蛋白与其他相关蛋白序列的系统进化树分析Fig. 4 Phylogenetic analysis of Longyou 7 Cu/Zn-SOD proteins with other related proteins |
发现, 低温胁迫下 Cu/Zn-SOD在叶片和根中的表达存在差异, 在最初4℃低温处理下, 叶片和根部的表达量均上调, 继续低温胁迫后, 叶片中 Cu/Zn-SOD基因表达开始下调, 甚至低于对照(CK), 而根部的表达量在-4℃时仍继续增强, 在-8℃表达减弱, 但仍高于对照(CK), 由此说明 Cu/Zn-SOD基因是低温诱导条件下差异表达的基因, 根部 Cu/Zn-SOD表达量的增强有利于冬油菜越冬过程中对低温的抵御。
低温胁迫处理后, 陇油6号叶片的可溶性蛋白SDS-PAGE分析结果(图6)表明, 在SDS-PAGE图谱上有4条带(D1、D2、D3、D4)随着低温胁迫时间的延长表达量增加, 当解除胁迫常温恢复10 d后, 表达量下降, 其中在相对分子质量为15 kD左右的D3条带的变化很明显。为此将该条带回收, 并通过蛋白串联质谱技术鉴定发现, D3条带与数据库中白菜( Brassica rapa)铜/锌超氧化物歧化酶(编号为gi|312837922)中3个肽段高度匹配(表1), 离子分值分别为82、133和157, 说明回收的蛋白质条带为白菜型冬油菜铜/锌超氧化物歧化酶(单个离子分值大于44说明具有广泛的同源), 也进一步说明铜/锌超氧化物歧化酶与冬油菜的抗寒性关系密切。
叶片和根部总SOD活性的变化呈现先上升后下降趋势(图7), 在10月31日(气温-2~12℃), 叶片SOD活性最高, 为10月8日(气温14~20℃)样品的4.75倍, 而根部酶活性达到最大值的时间较叶片推迟, 在11月15日(气温-10~ -4℃)达到最大, 为10
月8日(气温14~20℃)的3.06倍。该结果与 Cu/Zn- SOD基因表达变化规律一致, 说明在总SOD中, 胞质Cu/Zn-SOD是起主要作用的同功酶。
| 表1 蛋白质串联质谱(LC-MS/MS)的数据库搜索鉴定结果 Table 1 Result of searching protein database using peptide sequenced from LC-MS/MS |
不同来源Cu/Zn-SOD在氨基酸序列上具有较高同源性, 结构上有高度的同一性[ 19]。本研究从白菜型冬油菜中克隆了 Cu/Zn-SOD基因的cDNA序列, 该序列拥有完整的阅读框(ORF), 预测编码蛋白无信号肽和跨膜结构, 具有胞质 Cu/Zn-SOD超家族特有的保守结构区域, 这与所预期的胞质 Cu/Zn-SOD一致, 显示所克隆基因序列的准确性。分析发现该基因与十字花科的甘蓝型油菜、大白菜等氨基酸序列具有极高的相似性, 具有Cu2+结合位点以及二硫键功能位点, 无规则卷曲和延伸链是该蛋白质二级结构主要元件, 这些特征与其他植物 Cu/Zn-SOD的序列组成、结构及酶活性位点均有高度的相似性[ 20, 21]。
生物体内Cu/Zn-SOD是3种超氧化物歧化酶中分布最广、稳定性最高的同工酶, 其表达量与植物抗逆性关系密切[ 22, 23]。前人研究认为逆境胁迫初期常引发 SOD基因表达的快速上调, 提高植物对各种逆境胁迫的抗性[ 24]。本研究中, 最初4℃低温处理可增强叶片和根中胞质 Cu/Zn-SOD基因表达量, 随着胁迫温度的继续降低以及胁迫时间的延长, 叶片中该基因表达量下降甚至低于对照(CK)。其原因可能是最初的降温导致冬油菜叶片内活性氧的大量积累, 为维持较高的抗寒力和正常的活性氧水平, Cu/Zn-SOD基因表达量上调, 而后由于继续零下低温以及长时间的胁迫, 过量活性氧使叶片细胞结构受到不可逆转的损伤, 抗寒能力下降, Cu/Zn-SOD表达量急剧下降并低于对照(CK)。这符合实际生产中冬油菜的生长表现(-2℃的低温使冬油菜地上部分抗寒力开始下降, -8℃时冬油菜进入枯叶期)。 Cu/Zn-SOD基因在植物不同组织特异性表达, 胡根海等[ 12]研究发现, 胞质 Cu/Zn SOD基因在棉花根中表达活性最高, 推测根可能是胞质 Cu/Zn-SOD基因的主要表达部位。李玉坤等[ 25]研究显示东方山羊豆叶绿体 Cu/Zn-SOD基因在根中表达量最少。根是冬油菜越冬最主要的器官, 低温胁迫下, 根部胞质 Cu/Zn-SOD的表达量明显上调, 即使在-8℃的低温下, 其表达量仍高于对照(CK), 可见 Cu/Zn-SOD基因是低温诱导条件下差异表达的基因, 其表达可减轻或抵抗低温条件下产生的活性氧对根部伤害, 有利于冬油菜安全越冬。已知逆境胁迫可诱发细胞内活性氧浓度的增加而导致氧化胁迫, 所以植物抗逆性的形成常常与抗氧化系统活性的增强关系密切[ 26, 27, 28, 29]。本研究中, 叶片和根部SOD酶活性在低温条件下均高于常温条件下, 表明SOD在适应低温过程中起一定作用。
植物低温诱导蛋白是植物在低温作用下由于基因表达的改变而诱发合成的蛋白质[ 30]。关于棉花与低温诱导关系研究发现, 低温锻炼期间, 植物细胞内可溶性蛋白质和抗(冷)冻性之间呈现明显的正相关, 即可溶性蛋白质含量随低温锻炼过程中抗(冷)冻性的提高而增加[ 31]。本研究结果表明, 在4℃的连续低温胁迫下, 相对分子质量为15 kD处(D3)有一条蛋白带的表达量受低温诱导, 并随胁迫时间的延长而逐步增加, 当解除胁迫后又下降, 说明该蛋白在增加冬油菜抗寒性方面有重要的作用。为了进一步了解该蛋白的性质和类型, 对其进行回收并通过蛋白串联质谱技术做鉴定, 结果显示该蛋白很可能为铜/锌超氧化物歧化酶(Cu/Zn-SOD), 由此进一步证实 Cu/Zn-SOD为抗逆基因[ 32], 其表达受低温诱导[ 33, 34]。已有的研究认为活性氧活性的抑制和活性氧的清除是保护植物细胞膜系统, 提高植物抗逆性的有效途径[ 35], 因此Cu/Zn-SOD的抗寒机制可能一方面是作为活性氧的清除剂, 保护植物在逆境条件下细胞膜系统免受损伤, 另一方面Cu/Zn-SOD为亲水性胶体, 其表达量的增加有助于增强细胞的保水力, 从而提高细胞中束缚水的比例, 降低冰点, 增强植物的抗寒性。
从超强抗寒白菜型冬油菜中获得了一个长度为459 bp Cu/Zn-SOD基因的cDNA序列, 该序列编码152个氨基酸残基的蛋白质, 在进化上十分保守, 具有胞质Cu/Zn-SOD超家族特有的序列特征和保守结构区域。在总SOD中胞质Cu/Zn-SOD是起主要作用的同功酶。 Cu/Zn-SOD是受低温诱导表达的抗逆基因。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|





