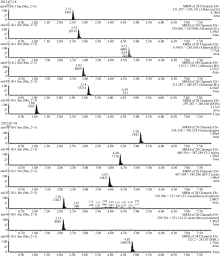
建立了简单、快速、同步测定谷物中12种常见真菌毒素的超高效液相色谱串联质谱分析方法。样品用80%乙腈水溶液振荡提取, 多功能净化柱净化, Waters ACQUITY UPLCTMBEH C18色谱柱分离, 串联四极杆质谱多反应离子监测方式检测, 并采用外标法定量。结果表明, 12种真菌毒素在各自的线性响应范围内线性关系良好, 相关系数均不低于0.998, 12种真菌毒素的检出限为0.016~1.000 μg kg-1, 低、中、高3个加标水平的平均回收率(
A determination method was developed using ultra-high performance liquid chromatography-tendem mass spectrometry (UPLC-MS/MS). Samples were sequentially extracted with 80% acetonitrile, and then the extracts were pooled and cleaned up with multifunction cleaning column before being separating by a chromatographic column of Waters ACQUITY UPLCTMBEH C18. The Mass spectrometry was conducted by using positive (ESI+) electrospray ionization and Multi-reactions monitoring (MRM) models, with external standard method. The results indicated that contants of the 12 mycotoxins had good linear relationship with than peak areas. The detection limits for them ranged from 0.016 to 1.000 μg kg-1, and the average recovery rates at three levels of adding external standard were from 60.0% to 122.4%, with a relative standard deviation (RSD) varying from 0.9% to 20.3%. The method is simple, rapid, accurate and suitable for simultaneously by measuring 12 kinds of mycotoxins in cereals.
真菌毒素(mycotoxins)是某些真菌产生的二级代谢产物, 目前已知的真菌毒素有300多种, 按其主要菌种可分为曲霉菌毒素, 如黄曲霉毒素, 包括黄曲霉毒素B1(aflatoxin B1, AFB1)、黄曲霉毒素B2(aflatoxin B2, AFB2)、黄曲霉毒素G1(aflatoxin G1, AFG1)、黄曲霉毒素G2(aflatoxin G2, AFG2)和棕曲霉毒素等; 镰刀菌毒素,如脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)、玉米赤霉烯酮(zearalenone, ZEN)、T2毒素(T-2)、HT-2毒素(HT-2)等; 以及青霉菌毒素。其中AFB1被公认为是目前致癌力最强的天然物质。我国规定小麦、玉米中黄曲霉毒素的限量值分别为5 μg kg-1和20 μg kg-1, 而国际食品法典委员会标准中是按黄曲霉毒素总量(AFB1+AFB2+AFG1+ AFG2)指标制定限量指标, 限量值在10~20 μg kg-1 [ 1, 2, 3]。
目前检测真菌毒素的方法主要有薄层色谱法(TIC)、酶联免疫吸附法、气相色谱法、免疫亲和柱净化高效液相色谱法[ 4, 5, 6, 7, 8], 它们均只能检测单一类的真菌毒素。液相色谱串联质谱法由于其较好的分离度和较高的灵敏度逐渐成为同时检测多种真菌毒素的主要手段[ 9, 10, 11, 12, 13, 14, 15]。Ren等[ 12]建立了免疫亲和法净化与内标法定量, 利用两种不同流动相分别测定食品中17种真菌毒素, 获得较好的回收率。Frenich等[ 13]利用一步萃取法, 不经过净化对谷物中11种真菌毒素进行测定, 检出限和定量限分别为0.01~2.10 μg kg-1和0.03~6.30 μg kg-1, 回收率分别为70.0%~ 108.4%。孟娟等[ 14]建立了谷物及其制品中6种玉米赤霉烯酮类物质的超高效液相色谱串联质谱的方法, 采用石墨化炭黑固相萃取柱富集净化、内标法定量, 取得了较好的回收率。内标法存在内标物不易选择及成本较高等不足, 而样品不经过净化柱净化前处理, 极易损伤色谱柱及仪器, 影响分析稳定性。本研究目的是探讨建立前处理方法更为简便、稳定性更高、外标法同时测定12种真菌毒素的分析方法。
甲醇、乙腈、甲酸均为色谱纯(美国Fisher公司); AFB1、AFB2、AFG1、AFG2、ZEN、DON、3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl deoxynivalenol, 3-ADON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl deoxynivalenol, 15-ADON)、疣孢青霉原(verruculogen, VCG)、杂色曲霉素(sterigmatocystin, SMC)、T-2、HT-2等12种标准品纯度均不低于99% (国家标物中心)。
超高效液相色谱-串联四级杆质谱(UPLC- XEVO TQ, 美国Waters公司), 配有电喷雾离子源; 恒温培养摇床(上海-恒科学仪器公司); MILLI-Q纯水机(美国Millipore公司); 氮吹仪; 涡旋混匀器; 天平(感量0.01 g); Mycosep 226多功能净化柱(美国Romer实验室)。
液相色谱的色谱柱为ACQUITY BEH C18柱(50.0 mm × 2.1 mm, 粒径1.7 μm), 流速为300 μL min-1, 柱温为26℃, 进样体积为5 μL。
流动相种类和比例是本研究的处理因素。比较乙腈-水、甲醇-水两种流动相对质谱信号及峰形对称的影响, 选择一种流动相作进一步添加不同浓度的乙酸铵对各组分保留时间、分离效果和峰型的影响试验。甲醇-10 mmol L-1乙酸铵流动相中浓度设计为10%、20%、25%、30%、40%和50%。
质谱分析的离子源为电喷雾离子源(ESI), 扫描方式为正离子扫描, 检测方式为多反应监测(MRM), 毛细管电压是2.50 kV, 离子源温度为110℃, 去溶剂气流量为800 L h-1, 溶剂气温度为450℃。其他质谱采集参数见表1。
准确称取10 g粉碎均匀的试样(精确到0.01 g)于150 mL三角锥形瓶中, 加入50.0 mL乙腈水溶液, 恒温振荡器中振荡30 min, 取出后过滤。取处理好的样品滤液8 mL至MycoSep萃取柱的试管中, 将MycoSep萃取柱的红色橡胶头插入试管内, 缓慢将萃取柱推入试管底部, 使提取液通过固定相进入套管中, 时间不少于1 min, 取4 mL套管中的纯化液至干净的刻度试管中, 将试管置于50℃水浴中氮吹至近干, 用甲醇-10 mmol L-1乙酸铵水溶液(1∶1, 体积比)溶解, 定容至1 mL, 旋涡1 min, 过0.22 μm聚醚砜滤膜于2 mL样品瓶中, 待测。
样品前处理提取溶剂乙腈水溶液浓度是本研究的处理因素, 设计为30%、50%、70%、80%、84%、90%和100%。
毒素标准储备液的配制(100 mg L-1): 用纯甲醇将AFB1、AFB2、AFG1、AFG2配制成200 μg L-1、60 μg L-1、200 μg L-1、60 μg L-1的标准储备液, 其余8种真菌毒素配制成100 mg L-1的标准储备液, -18℃以下贮存。
混合标准工作溶液: 根据AFB1、AFB2、AFG1、AFG2、ZEN、VCG、SMC、T-2、HT-2、DON、3-ADON、15-ADON各毒素在质谱中的响应值, 用甲醇-10 mmol L-1乙酸铵(1∶1, 体积比)逐级稀释各储备液, 最终配制成10、3、10、3、20、20、20、20、20、100、100和100 μg L-1的标准溶液。
基质标准溶液是本研究的处理因素。将空白小麦或玉米按照1.4方法处理, 用空白基质溶液将12种真菌毒素配制成混合标准溶液, 浓度同1.5。
本实验分别考察了乙腈-水、甲醇-水作为流动相的结果, 表明以甲醇-水作为流动相, 质谱信号提高, 峰形对称。考察了在甲醇-水中添加不同量的乙酸铵对质谱灵敏度的影响, 最终采用甲醇-10 mmol L-1
| 表1 12种真菌毒素UPLC-MS/MS测定参数 Table 1 UPLC-MS/MS acquisition parameters for 12 mycotoxins |
乙酸铵水溶液作为流动相。由于电喷雾质谱的电离是在溶液状态下电离, 因此流动相的种类和比例不仅影响目标化合物的保留时间和峰形, 还会影响到目标化合物的离子化效率, 从而影响灵敏度。
由于12种真菌毒素的化学性质差异较大, 而采用等度洗脱很难在短时间内达到基线分离, 因此采用梯度洗脱方式分离。实验中逐渐调整甲醇初始浓度, 结果表明, 初始甲醇比例越大, 出峰越快, 特别是呕吐毒素在0.6 min内便出峰, 且对4种黄曲霉毒素类的分离效果较差, 峰型有重叠, 而甲醇的初始比例较小时, 出峰较慢, 后出组分峰形变宽, 灵敏度下降。综合考虑, 确定梯度洗脱程序为0~5.5 min, 20%~85% A; 5.5~5.8 min, 85%~100% A; 5.8~6.0 min, 100%~20% A; 6.0 min, 20% A, 平衡2 min。在上述优化液谱和质谱最佳条件下得到12种真菌毒素的多反应监测(MRM)色谱图(图1)。
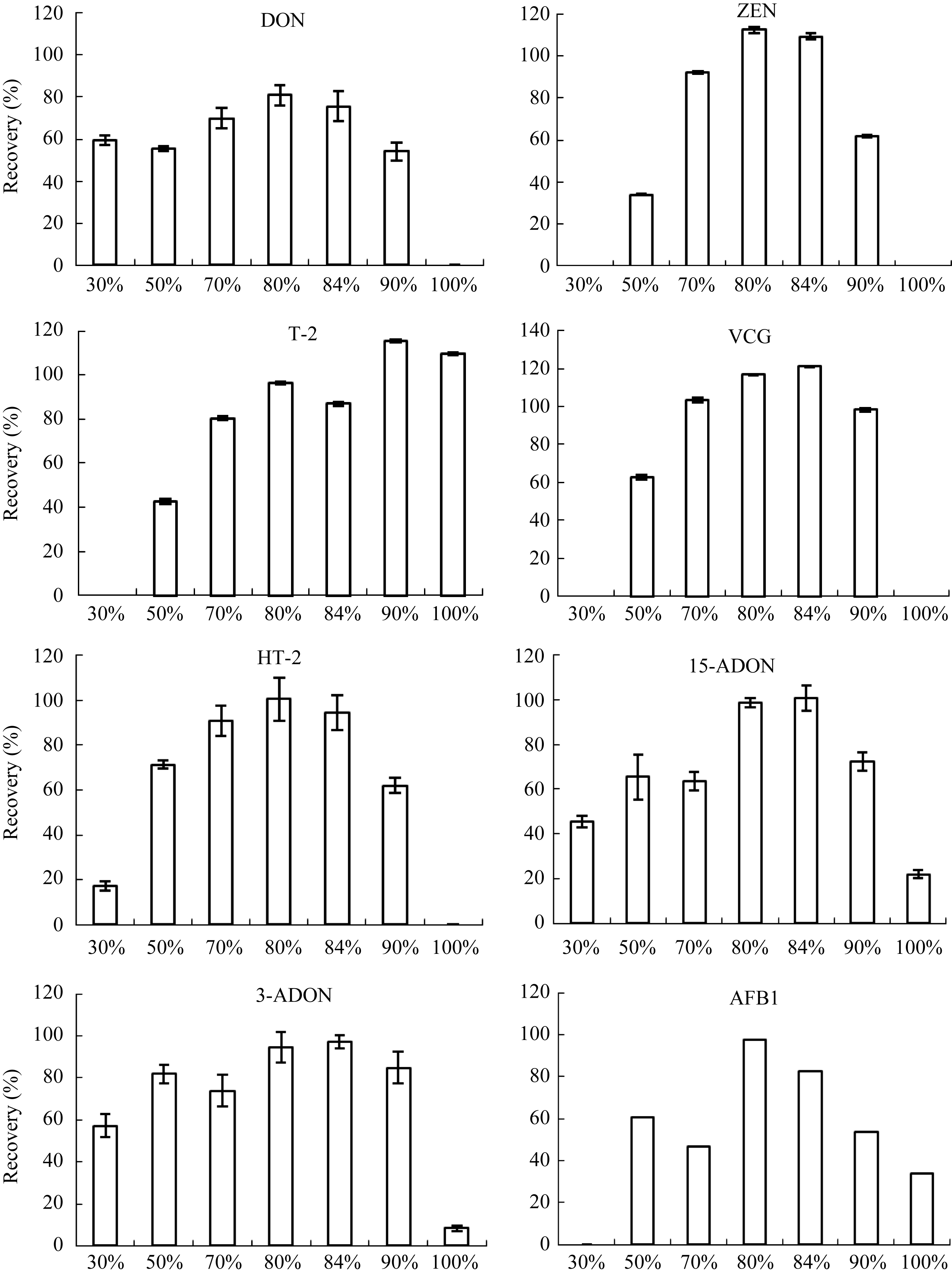
Ren等[ 12]及宫小明等[ 15]均采用84%乙腈-水溶液作为提取液。不同浓度提取液(30%、50%、60%、70%、80%、84%、90%和100%)的提取效果差异很大(图2)。随着乙腈-水体积比逐渐增大, 提取回收率逐渐提高。当乙腈-水为80%和84%时, 提取回收率相当, 且达到最大。因此, 选择80%乙腈-水溶液作为提取溶液。
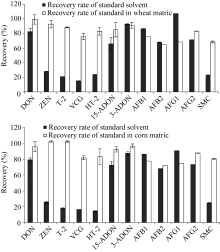
根据1.4操作步骤对小麦样品进行空白和添加实验处理, 分别采用溶液配制标液以及空白基质配制标液对12种真菌毒素进行定量测定(图3)表明, DON、15-ADON、3-ADON三种呕吐类毒素以及
AFB1、AFB2、AFG1、AFG2四种黄曲霉类毒素受基质效应影响较小, 而ZEN、T-2、HT-2、VCG、SMC五种毒素受基质效应影响较大。
2.4.1 标准曲线与线性范围 在优化条件下, 配制标准溶液系列, 进样分析表明, 12种组分在正离子模式下均呈良好的线性关系, 相关系数( r)均不低于0.998 (表2)。
2.4.2 检出限和定量限 根据12种真菌毒素在质谱MRM模式下响应不同, 将其配制成不同浓度的混标溶液, 分别取空白小麦粉和玉米粉样品作为基质, 添加12种真菌毒素的混标溶液, 按照1.4样品预处理方法处理, 分析测定后, 按照3倍信噪比(S/N)可得最低检出限(LOD), 按10倍信噪比(S/N)可得最低定量限(LOQ), 如表2所示。结果表明, 12种
真菌毒素的最低检出限LOD在0.016~1.000 μg kg-1, 最低定量限LOQ在0.02~ 3.00 μg kg-1之间, 均低于中国、欧盟和日本等国家规定的最大残留限量。
2.4.3 精密度试验 取AFB1、AFB2、AFG1、AFG2、DON、ZEN、3-ADON、15-ADON、T-2、HT-2、VCG、SMC浓度分别为10、3、10、3、100、20、100、100、20、20、20、20 μg L-1的12种真菌毒素混合标准溶液连续进样6次, 测得12种真菌毒素的RSD%, 连续进样11 d, 测得日间重复性(表3), 表明日内精密度及日间精密度均在允许范围内。
Volume ratio of acetonitrile to water
 | 图2 不同浓度提取液对12种真菌毒素的提取效果Fig. 2 Recovery rate of 12 mycotoxins using different concentrations of extractant |
分别称取小麦和玉米的空白样品10.0 g, 对12种真菌毒素进行低、中、高3个不同水平添加, 不同组分每个浓度进行6个水平测定, 结果见表4。12种毒素的平均回收率为60.0%~122.4%, 相对标准偏差为0.9%~20.3%。
采用超高效液相色谱串联质谱法分析生物毒素时, 流动相通常选择乙腈-水或甲醇-水, 有时也在乙腈-水或甲醇-水流动相中加入低浓度的甲酸或乙酸铵。所有的分析研究都采用梯度洗脱, 但流动相的梯度洗脱时间设计和组合则相差很大。如王岩松等[ 20]在研究谷物中黄曲霉毒素B1、B2、G1、G2和M1分析方法时, 流动相A为水加甲酸(0.2%甲酸), 流动相B为甲醇, 梯度洗脱时间设计为0、2、5、9、10和12 min, 流动相A/B比为85/15、85/15、5/95、5/95、85/15和85/15。王晓春等[ 21]在研究谷物中T-2毒素和HT-2毒素分析方法时, 流动相A为1.0 mmol
| 表2 12种真菌毒素的标准工作曲线、线性范围、相关系数、检出限及定量限 Table 2 Calibration curve, linear ranges, correlation coefficients(r), LODs, and LOQs of 12 mycotoxins |
| 表3 12种真菌毒素的日内精密度和日间精密度 Table 3 Within-day precision and day to day precision of 12 mycotoxins |
L-1乙酸铵溶液, 流动相B为甲醇, 梯度洗脱时间设计为0、2、4、4.3、4.31 和7.3 min, 流动相A/B比为50/50、5/95、5/95、0/100、50/50和50/50。优化的流动相设计有利于缩短分析物出峰时间, 又不至于形成不同分析物峰型重叠。可见, 由于分析物的差异, 优化的流动相设计有较大的差异, 同时分析测定的分析物越多, 流动相的优化设计就越重要。
生物毒素的化学结构类似, 都易溶于有机溶剂。乙腈和甲醇是近年来生物毒素分析中最常用的2种萃取溶剂。相对于过去常用的乙酸乙酯或乙醚, 乙腈和甲醇可以减少旋转蒸发操作, 简化实验步骤、节省实验时间和降低实验成本。不同研究报道的乙腈或甲醇的溶液浓度变化很大。当乙腈或甲醇
| 表4 12种真菌毒素的添加回收率( n = 6) Table 4 Recoveries of 12 mycotoxins in wheat and corn samples ( n = 6) |
| 表5 本研究方法与国家标准方法比对结果 Table 5 Comparison of results measured by method used in the study with the national standard method |
浓度增加时, 一般会增加分析物的萃取回收率, 但随着浓度的增加, 会降低多功能净化柱净化过程中分析物在净化柱柱体的保留效果, 否则易将谷物基质中的极性物质, 如氨基酸、矿物质等, 引入待分析组分中, 产生较强的离子抑制效果, 进而干扰质谱信号的测定[ 21]。因此, 萃取溶剂种类选择和浓度设计的优化因分析目标物的差异和同时分析的目标物数量有着较大的差别, 也是近年研究超高效液相色谱串联质谱法分析生物毒素时的主要研究内容。
现有的谷物产品中生物毒素检测标准和科学文献报道, 基本上采用溶液配标的方法绘制标准曲线。其优点是标准曲线线性关系显著, 精确度高, 操作简便; 缺点是不能消除分析样品基质对萃取回收率干扰及对分析仪器灵敏性干扰的系统误差。同时测定多种生物毒素时, 由于不同毒素受基质影响程度不一样, 采用基质配标可明显提高萃取回收率, 减少基质对分析仪器灵敏性的干扰影响, 从而提高分析测试的准确性。
本研究的创新性在于采用超高效液相色谱串联质谱-正离子模式对小麦和玉米中12种真菌毒素进
行了同时测定; 采用空白基质配制标液克服了同时定量测定12种真菌毒素时, ZEN、T-2、HT-2、VCG、SMC等5种毒素受基质影响较大的问题; 优化了同时分析测定12种真菌毒素时的液相色谱的流动相条件和样品前处理的萃取溶剂。本研究的结果在生物毒素萃取回收率、最低检测限方面明显高于同类研究水平[ 20, 21], 也为尚未建立国标方法的3-乙酰基脱氧雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇、疣孢青霉原、杂色曲霉素、HT-2等5种毒素的测定提供了方法基础。
为进一步验证本研究的结果, 将分别添加了脱氧雪腐镰刀菌烯醇(呕吐毒素)、玉米赤霉烯酮和T-2毒素等3种毒素的标品小麦试样分发给5个农业部部级质检中心进行相同试样不同添加水平回收率测定试验。结果表明, 5家实验室回收率测定值均在80%~120%范围内, 相对标准偏差在规定范围内, 表明本研究建立的方法在实验室间的重复性及再现性均较好。本实验室2011、2012和2013年从华北地区随机抽取的157份玉米样品及全国各地抽取的1350份小麦样品的真菌毒素检测结果也表明, 本研究建立的方法与现行国标方法的测定结果吻合[ 16, 17, 18, 19], 验证了本研究建立的方法的可靠性。
本研究工作的整体设计中前处理部分和液相条件的优化过于简单, 未考虑色谱分离的检测指标以及回收率。本研究建立的方法测定HT-2、VCG、SMC毒素时回收率底限低于70%, 不是很理想。
进一步研究工作将考虑同时测定12种毒素时, 现有的色谱条件是否有改进和优化的空间, 研究分析部分毒素回收率较低的原因和提高这些毒素回收率的措施, 进一步研究同时测定谷物中更多毒素的方法。
致谢: 感谢农业部稻米及制品质量监督检验测试中心, 农业部农产品质量安全监督检验测试中心(长沙), 农业部农产品质量安全监督检验测试中心(南京), 农业部谷物及制品质量监督检验测试中心(哈尔滨), 和农业部农产品质量监督检验测试中心(郑州)在实验室比对实验中提供的数据帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|