第一作者联系方式: E-mail:wulizhu2008@163.com
以抗病海岛棉Pima 90-53、耐病陆地棉冀棉20和感病陆地棉邯208为材料, 研究黄萎病菌胁迫下棉花细胞壁的组织结构和木质素含量与棉花抗性的关系, 并分析参与木质素合成的胞外漆酶的基因表达水平。结果发现, 室内接种黄萎病菌24 h, 在Pima 90-53的根部导管组织中没有发现病原菌的侵入, 而在冀棉20和邯208的导管组织均有病原菌侵入; 接种35 d时, Pima 90-53的茎部导管细胞壁高度木质化且导管堵塞不明显, 冀棉20的导管细胞壁中度木质化且导管堵塞不明显, 而邯208的导管细胞壁仅发生轻度木质化且导管堵塞严重。对田间病圃种植棉花叶片和叶柄的测定发现, 3个品种的酸不可溶性木质素含量与品种的病情指数呈显著负相关(
To search cotton resistance to Verticillium wilt, we inoculated
棉花黄萎病是由大丽轮枝菌( Verticillium dah l iae Kleb.)引起的土传维管束真菌病害, 已成为影响我国棉花持续高产、稳产的主要障碍[ 1, 2]。细胞壁是植物抵御病原菌侵入的重要屏障, 也是寄主与病原菌互作的重要场所。其固有的、诱导的组织结构和在逆境条件下发生的生理生化变化对增强棉株的抗逆性具有重要作用, 与抗病植株的抗性存在直接关系[ 3]。大量研究结果表明, 抗病棉花品种和感病品种在组织结构上存在较大差异, 如抗病品种的细胞壁较厚、木质部坚实且木质部的间隙小[ 4]。Smit等[ 5]通过黄萎病激发子诱导不同抗性棉花品种的下胚轴, 发现细胞壁的木质素等成分迅速积累, 木质化程度加大, 抗病品种较感病品种的木质素合成相关酶的活性更高、反应更迅速。利用黄青霉激发子同样可诱导棉花组织的木质化以及细胞壁木质化的相关酶类如过氧化物酶活性的增加, 以提高棉花对黄萎病的抗性[ 6]。王莉[ 7]以室内培育的不同抗性品种棉苗为试材, 对棉花黄萎病株不同部位的组织横断面连续切片观察发现, 抗病品种的主根和茎导管细胞壁厚度大于感病品种, 导管数、髓射线数和单位面积的薄壁细胞数多于感病品种。可见当受到病原菌侵染时, 植物会通过复杂的代谢途径诱导合成木质素, 以形成新的细胞壁来抵御病原菌侵入的机械压力和病原菌酶类对细胞壁的降解, 并阻断病原菌与寄主植物间的物质交流[ 8]。
木质素是由薄壁组织细胞合成木质素单体并分泌至胞外经过氧化物酶和漆酶等胞外酶类的脱氢聚合反应而成, 对植物抗逆生理活动具有积极作用[ 9]。其中来源于胞间层的木质素主要为酸不可溶性木质素(klason木质素), 来源于细胞壁的木质素主要为酸可溶性木质素[ 10]。Xu等[ 11]通过RNA-Seq大规模测序分析海岛棉品种海7124接种黄萎病菌后的抗病基因表达谱, 发现苯丙环类物质代谢路径的相关基因在表达谱中得到富集, 其中木质素合成相关基因的表达水平提高, 细胞内苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性增加。目前国内外对参与木质素合成的与植物抗病相关的胞外酶类研究很少, 且对细胞壁酸可溶性木质素和酸不可溶性木质素与植物抗病性的关系尚不明确。本研究以不同抗病棉花品种为材料, 观察黄萎病菌侵染后的棉花细胞壁的组织结构, 明确黄萎病菌侵染棉花组织的时间和路径; 探索棉花细胞壁酸可溶性木质素和酸不可溶性木质素含量变化与其抗病性关系, 了解参与木质素合成的胞外漆酶基因的表达特性, 为进一步解析棉花抗黄萎病机制和抗病品种改良提供依据。
海岛棉Pima 90-53为抗黄萎病品种, 陆地棉冀棉20为耐病品种, 陆地棉邯208为感病品种, 均由河北农业大学棉花遗传育种研究室提供。强致病力黄萎病菌系VD-gfp77为绿色荧光蛋白标记的大丽轮枝菌, 由中国农业科学院戴小枫研究员惠赠。
按照Zhang等[ 12]方法培养黄萎病菌, 将4℃冷藏保存的VD-gfp77转移至PDA平面培养基中, 于25℃培养箱培养7~10 d, 然后将菌落破碎成合适大小的菌块, 接种于Czapek’s培养液中, 25℃振荡(110转 min-1)培养10 d, 用3层纱布过滤后, 调节滤液孢子浓度至每毫升1×107个备用。
棉花种子经硫酸脱绒后于室温浸泡8 h, 25℃催芽24 h, 选择发芽整齐一致的种子播于装有蛭石的营养钵中, 在生长室内(昼温25~26℃, 夜温20~22℃)培养, 并定期浇Hoagland营养液。当棉苗长至第一片真叶展开时将孢子悬浮液从底部注入营养钵, 每钵接种15 mL, 对照接种等量的水。其后继续培养。
分别取接种黄萎病菌后0、4、8和24 h的棉苗, 利用激光共聚焦显微镜, 以488 nm光激发, 观察黄萎病菌侵染棉花根部组织的进程。
分别取黄萎病菌侵染0 h、2 h、4 h、8 h、12 h、24 h、2 d、4 d、7 d、14 d、21 d、28 d和35 d的棉苗子叶基部下方1 cm处的茎段组织, 制作石蜡切片, 经番红-固绿染色后以Olympus BX51荧光显微镜蓝光激发, 观察黄萎病菌侵染的棉花茎部组织细胞结构变化。
以河北农业大学育种中心田间病圃种植的Pima 90-53、冀棉20和邯208为材料, 在黄萎病发病高峰期分别取各品种中部果枝(第5~第6果枝)基部的叶片和叶柄组织备用。按照Sluiter等[ 13]中所述方法将冷冻干燥处理后的样品研磨成粉末, 准确称取3.00±0.01 g, 在索氏提取器中用乙醇抽提24 h, 风干后置具盖试管, 加72% H2SO4 3 mL, 剧烈振荡 1 min混匀。30℃水浴60 min, 期间每5 min振荡一次。再加84 mL蒸馏水, 稀释H2SO4浓度至4%, 并混匀。此时反应体积为86.73 mL。121℃水解60 min后经滤纸过滤, 收集滤液用于酸可溶性木质素(acid soluble lignin, ASL)含量测定, 残渣用于酸不可溶性木质素(acid insoluble lignin, AIL)含量测定。
以4% H2SO4为对照, 使用320 nm检测滤液中酸可溶性木质素, 若吸收值超出0.7~1.0范围, 可适当稀释滤液。
酸可溶性木质素含量 ASL(%) = A320 nm× 86.73 × n/(30 × W) × 100%, 式中 A320 nm为滤液在320 nm处的吸收值, 86.73为反应液体积(mL), n为滤液稀释倍数, 30为百分吸光系数(L g-1 cm-1), W为样品干重(g), 比色杯的厚度为1 cm。
将坩埚在马弗炉内575℃±25℃干燥6 h以上, 冷却后称重, 至恒重后记录结果。以105℃烘干滤纸6 h以上, 恒重后记录为W1; 575℃±25℃焚烧24 h冷却后称至恒重W2, 滤纸灰分率为W2/W1。105℃烘单张滤纸6 h以上, 称至恒重后记录为W3。用不少于50 mL的蒸馏水冲洗残渣, 将滤膜和残渣共同放入坩埚内, 105℃±3℃干燥4 h, 冷却后称重为W4。575℃±25℃焚烧24 h冷却后称至恒重W5。
酸不可溶性木质素(AIL)=滤渣干重(W4)-灰分重(W5)-滤纸干重(W3)×滤纸灰分率(W2/W1)/样品干重×100%, 式中W单位为g。
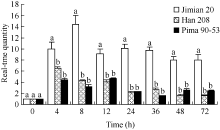
使用TRIzol总RNA提取试剂盒(天根生化科技(北京)有限公司)分别提取Pima 90-53、冀棉20和邯208的接水对照及接菌处理后0、2、6、12、24、36、48和72 h的根部总RNA。取1 μg经DNaseI消化的总RNA, 反转录得到cDNA用于Real-time PCR分析。以棉花组成型表达基因 Ghactin作为内参, 使用LightCycler 1.5罗氏荧光定量PCR仪进行3次生物学重复Real-time检测。根据本实验室克隆的漆酶EST序列信息[ 14, 15]设计合成Real-time引物Lacr-F: 5'-ATGGGTTTACAGCAAGG-3'和Lacr-R: 5'-GCA ATGTGGTTGTGTTG-3', 根据NCBI数据库提供的陆地棉GhActin 1~15的保守序列, 设计合成Ghactin的Real-time引物GhActin-F: 5'-TTCTCACGGAAGC ACCTCTC-3'和GhActin-R: 5'-ACGACCACTGGC ATACAAAG-3'。PCR程序为95℃, 10 s; 95℃ 10 s, 55℃ 10 s, 72℃ 15 s荧光检测, 35个循环; 72℃→94℃ 0.05℃ s-1溶解曲线荧光检测。采用2-ΔΔCT法[ 16]分析基因相对表达量。
观察绿色荧光蛋白标记的黄萎病菌VD-gfp77 (图1)侵染的不同抗性棉花品种的根部组织, 结果显示, 在接菌4 h时, 不同抗性的棉花品种的根部组织均已被病原菌附着; 接菌24 h时, 在海岛棉抗病品种Pima 90-53的根部导管组织中没有发现病原菌的侵入, 仅在根部组织的表皮层有黄萎病菌VD-gfp77的附着, 而陆地棉耐病品种冀棉20和感病品种邯208的导管组织均有病原菌侵入(图2)。荧光显微观察结果说明海岛棉与陆地棉根部在抵御黄萎病菌进入时存在明显差异, 而陆地棉抗、感品种之间无差异。
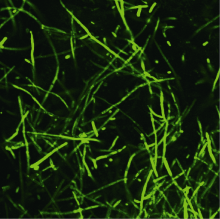 | 图1 绿色荧光蛋白标记的黄萎病菌VD-gfp77荧光显微观察Fig. 1 Observation of fluorescence in Verticillium dahliae VD-gfp77 marked with gfp using Confocal |
观察病菌侵染后0 h、2 h、4 h、8 h、12 h、24 h、2 d、4 d、7 d、14 d、21 d、28 d和35 d不同品种茎部组织石蜡切片的细胞结构, 发现接菌后随着棉花生长时间延长, 抗(耐)病品种的导管组织细胞壁木质化程度高, 导管堵塞轻; 而感病品种木质化程度低, 导管堵塞严重。接菌4 d时, 海岛棉抗病品种Pima 90-53茎部导管组织的细胞壁被番红着色后呈红色, 说明已普遍木质化且导管未发生堵塞现象, 而陆地棉耐病品种冀棉20导管的细胞壁无显著变化且导管亦未发生堵塞现象, 陆地棉感病品种邯208导管细胞壁亦无显著变化而导管内部发生轻度堵塞现象。接菌35 d时, Pima 90-53的茎部导管细胞壁均被番红特异染色呈红色, 而固绿不着色, 蓝光波长激发下木质素自发荧光较强, 说明细胞壁已高度木质化, 且导管堵塞不明显; 冀棉20导管细胞壁均被番红和固绿染色, 且着色较轻, 自发荧光强度居中, 说明细胞壁中度木质化, 且导管堵塞不明显; 而邯208根部组织细胞壁番红特异着色很少, 固绿染色较深, 自发荧光较弱, 说明细胞壁仅发生轻度木质化, 且导管堵塞严重(图3)。由此可见, 导管细胞壁的木质化程度与棉花抗性表现一致。
相对于陆地棉感病品种邯208, 抗病海岛棉Pima 90-53的叶片和叶柄中的酸可溶性木质素含量分别降低17.1%和31.3%, 均差异显著; 陆地棉耐病品种冀棉20的同一组织中分别降低2.5%和6.2%, 差异分别为不显著和显著。而在抗病海岛棉Pima 90-53的同一组织中酸不可溶性木质素含量分别提高39.7%和36.6%, 均差异显著; 在陆地棉耐病品种冀棉20中分别提高18.7%和29.5%, 亦均差异显著(表1)。相关分析结果显示叶片中的细胞壁酸不可溶性木质素含量与Pima 90-53、冀棉20和邯208的病情指数(18.14、41.00和60.49)[ 17]呈显著负相关( r= 0.99991*), 即细胞壁酸不可溶性木质素含量与棉花黄萎病抗性呈显著正相关。此外, 通过对酸不可溶性木质素与酸可溶性木质素的比值分析发现, 其比值大小与棉花的抗性强弱亦表现一致。
| 表1 病圃中不同抗性棉花品种细胞壁木质素含量 Table 1 Content of lignin in three different cotton varieties in the disease nursery |
在陆地棉耐病品种冀棉20和感病品种邯208中, Laccase基因在较短时间内对病原菌侵染迅速应答, 其中冀棉20接种黄萎病菌后, Laccase表达量较0 h升高9~14倍, 在8 h时达到最高并在72 h内一直维持较高水平, 且在各检测时间点均显著高于邯208, 后者的表达量较0 h仅升高1~6倍(图4), 说明漆酶基因 Laccase的表达丰度与陆地棉品种抗病性高低完全一致。 Laccase在海岛棉Pima 90-53中的表达量较0 h升高1~4倍, 其表达水平与在邯208中相近。
接菌后黄萎病菌能够成功附着于棉花根系组织,但对不同抗性棉花品种的侵入速度不同[ 18], 且附着于根系表面的病原菌并不能全部侵入, 只能作有限的生长甚至死亡, 仅有0.02%的菌丝能成功侵入宿主的皮层[ 19]。而不同抗性的棉花品种在接种黄萎病菌后, 其木质素含量均有不同程度的增加, 且其中抗病品种较感病品种的木质素含量显著增加, 木质素合成的相关酶类反应更迅速, 表达量更高[ 5, 11]。在土壤中直接添加木质素亦可达到减少病原菌生长繁殖的效果[ 20]。可见, 细胞壁是植物抵御病原菌侵入的天然屏障, 细胞壁的木质化和木质素的积累对于抵御病原菌侵入具有重要作用[ 5, 21]。本研究发现, 在接种24 h时, 黄萎病菌没有侵入抗病品种Pima 90-53, 而在耐病品种冀棉20和感病品种邯208的导管组织均有病原菌侵入。在接种35 d时, Pima 90-53的茎部导管细胞壁高度木质化且堵塞不明显, 冀棉20导管细胞壁中度木质化且堵塞不明显, 而邯208茎部导管细胞壁仅发生轻度木质化且堵塞严重, 表现棉花茎部导管细胞壁木质化与其抗病性一致。上述研究结果与前人报道一致。由此可见, 木质素在抵御病原菌侵入的过程中起着重要作用, 这可能是受侵染的植株通过细胞壁木质化和增厚来提高植株抗性、抵御病原菌侵入, 从而抑制由于病原菌的侵入而导致的导管堵塞, 进而表现出抗病特征。
利用硫酸水解法可得到酸可溶木质素酸和酸不可溶性木质素两种组分, 且后者与植物抗病性的联系更紧密。Xu等[ 11]研究发现, 在黄萎病菌侵染14 d的抗病海岛棉海7124和感病陆地棉YZ-1中, 其酸不可溶性木质素含量均表现明显增加。张松贺等[ 22]也发现在受软腐欧文氏菌侵染后的大白菜叶片中的酸不可溶性木质素及其单体成分含量同样出现增加的现象。在本研究以田间病圃条件下种植的3个不同黄萎病抗性棉花品种为材料, 研究品种叶柄和叶片中的酸可溶性和不可溶性木质素含量与棉花抗性的关系, 结果发现酸不可溶性木质素为木质素的主要成分, 约占总木质素含量87%~92%; 且酸不可溶性木质素含量与棉花品种的抗性表现一致, 与品种的病情指数[ 17]呈显著负相关; 同时发现, 酸不可溶和可溶性木质素的比值与棉花品种黄萎病抗性表现也高度一致。由此可见, 细胞壁的木质化对于抵抗病原菌的侵入与扩展具有重要作用[ 23], 且酸不可溶性木质素在细胞壁木质化和抵御病原菌侵入等过程中具重要功能。在细胞壁木质化过程中, 漆酶是木质素聚合反应的关键酶类, 并且参与了植物对病原菌胁迫的应答反应[ 24, 25, 26]。Li等[ 27]研究发现, 在番茄( Solanum tuberosum)中过量表达马铃薯漆酶基因可显著提高转基因植物对丁香假单胞菌( Pseudomonas syringepv)的抗性。王省芬等[ 14, 15]对黄萎病菌诱导下陆地棉抗病品种冀棉20 SSH文库分析发现, 包括漆酶在内的木质素合成相关基因参与了黄萎病菌的诱导应答反应。从亚洲棉中克隆获得漆酶基因 GaLAC1不仅可显著提高转基因杨树漆酶活性和茎段中的总木质素[ 28], 同时提高了转基因拟南芥对芥子酸等有机酸以及对三氯苯酚的抗性[ 29]。Smit等[ 5]利用黄萎病菌激发子处理不同抗性的棉花品种, 检测木质素合成相关基因的应答效率表明, 基因的应答效率与棉花抗黄萎病性密切相关。本研究发现, 在接种黄萎病菌4~8 h内, 漆酶基因的表达水平在不同抗性棉花品种中均迅速上升并达到最高水平, 表现出较高的应答效率; 并且在抗病品种冀棉20中的表达水平显著高于在感病品种邯208中的表达水平, 这与前人研究结果一致, 充分说明漆酶基因在棉花抗黄萎病过程中可能起着关键的预警和防御作用。另外, 漆酶基因在海岛棉Pima 90-53中的表达水平与在邯208中相近, 不存在显著差异, 其机制有待进一步研究。
海岛棉与陆地棉根部在抵御黄萎病菌进入时存在明显差异, 且黄萎病菌侵入根部组织的速率和茎部导管细胞壁的木质化程度与棉花抗性表现一致。细胞壁酸不可溶性木质素含量与品种的病情指数呈显著负相关, 与棉花黄萎病抗性呈显著正相关, 且酸不可溶性木质素与酸可溶性木质素的比值大小与棉花的抗性强弱一致。漆酶参与了木质素的合成, 漆酶基因的表达丰度与陆地棉品种抗病性表现完全一致, 且在短时间内对黄萎病菌侵染做出迅速的应答反应, 对于抵抗黄萎病菌侵染具有重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|